胰腺实质性假乳头状肿瘤的影像学诊断
吴娇娇,陈基明,张峥嵘,江 峰,逄 博,朱向明
(皖南医学院附属弋矶山医院 1.超声医学科;2.影像中心,安徽 芜湖 241001)
胰腺实质性假乳头状肿瘤(solid pseudopapillary tumors of pancreas,SPTP)是胰腺少见良性肿瘤之一,约占胰腺外分泌肿瘤的1% ~2%,具有恶性潜能或低度恶性,组织起源及发病机制不清。可发生于胰腺任何部位,以胰腺体、尾部多见,肿瘤多位于胰外,仅部分与胰腺组织相连。国内外有关SPTP的报道并不多见,国内有关SPTP的报道相对较少,至今不过几十余例[1-2]。笔者回顾我院近10年6例经手术病理证实的SPTP患者的影像学表现,报道如下。
1 资料与方法
1.1 一般资料 收集2000~2010年我院收治的经手术后病理证实的6例胰腺实质性假乳头状肿瘤患者资料,其中2例因腹部隐痛不适而就诊,2例因扪及腹部包块而就诊,2例为体检行腹部超声检查时发现。6例患者均为女性,年龄26~38岁。入院常规血检验及肿瘤标记物检测未见异常。
1.2 检查方法 ①6例患者均行超声检查,分别采用日本阿洛卡 Aloak(型号:SSD-1000,黑白超声机)、深圳迈瑞Mindray(型号:MA78-0897,彩色多普勒超声机)、美国GE(型号:P5,彩色多普勒超声机)检查,3例常规检查后嘱患者饮水行进一步复查。②其中4例进行了CT检查,分别采用德国西门子Siemens plus 4层 CT机、荷兰飞利浦 Philips Brilliance 64层CT机扫描层厚5 mm,层间5 mm;4例均行增强,使用对比剂为碘比醇(300 mg/ml),采用高压注射器,经肘静脉推注,计量约80~100 ml,注射流率为3 ml/s,分别于30 s、60 s及120 s对病灶进行分时相扫描。③2例进行了MRI检查,采用美国GESigna1.0TMR机,体线圈,扫描层厚5~6 mm,层间1~2 mm,常规采用轴位、冠状位扫描,辅以矢状位或其他体位。平扫横断面采用4通道腹部相控阵线圈,常规采用 T1WI、T2WI、T2WI+压脂、CE、GRE-T1WI;T1WI:TR 100~250 ms,激发角为 50°~90°,TE 最短成 4.4 ms,层厚 3 ~5 mm,间距为 0,NEX 为0.75;T2WI:TR 3 000~4 000,TE 80~120;采用256×256的矩阵,激励次数NEX为2,平扫后增强,使用对比剂为 Gd-DTPA,剂量为0.1 mmol/kg,横断面多时相增强。
1.3 图像分析 所有图像均由两名以上高年资医师共同进行回顾性分析。分析病灶部位、大小、形态、边缘、回声或密度、信号、位置、强化、病灶与邻近器官血管关系、淋巴结及转移灶,并与病理结果相对照,意见不一致时进行协商取得一致意见。
2 结果
所有患者均行腹部B超检查,表现为胰腺囊实混合性占位性病灶(见图1)。其中2例位于胰头,3例位于胰体,1例于胰尾,大小48 mm×15 mm×28 mm~23 mm×57 mm×78 mm,边缘清晰,多数可见完整包膜,内呈低回声或等回声,1例可见不规则钙化强回声,病灶周边可见环状血流信号,其中有4例肿瘤内实性区可见少许血流信号,多普勒显示为微动静脉,流速不完全相同。病灶对周边组织有推挤,1例位于胰头钩突后下方压迫肝门部血管,门静脉及肝动脉推挤、扭曲。1例病灶位于胰头上方,压迫胰管及胆总管开口,胰管、胆总管明显扩张。3例病灶位于胰腺体部,嘱患者饮水后复查,在胃充盈的状态下,超声显示较清晰,可见后方受推挤的脾静脉;1例病灶位于胰尾的,因胃肠气体干扰,病灶显示欠清晰,从脾门切面可探及病灶,仔细探查,可见被压迫的脾静脉自病灶后方延伸往前。2例腹膜后探及肿大淋巴结。4例行CT平扫及增强检查,并行3D及多平面重建,病灶均表现为椭圆形囊实性混杂密度灶,其中2例位于胰头部,2例位于胰体部,病灶呈外生性生长,边界清晰,2例病灶周边可见斑片样钙化(见图2),增强扫描病灶实性成分有不同程度强化,动脉期稍强化(见图3),随着时间的推移,静脉期及实质期强化越来越明显,强化程度略低于胰腺实质,肿瘤包膜强化明显。胰头部病灶可见胰管及胆总管受压扩张,肝门部血管受压推挤。CT3D及多平面重建也可从不同角度更清晰、准确显示病灶与血管关系,2例腹膜后见多枚中等增大淋巴结影,4例病灶周边脏器均未见明显转移。2例行MRI检查,1例位于胰头部,1例位于胰尾部,病灶表现为混杂信号影,其中囊性部分为T1WI低信号,T2WI高信号;实性部分为T1WI稍低信号,T2WI稍高信号;1例肿瘤出血,T1WI为高信号,T2WI为低信号,增强后肿瘤实性部分可显示中等程度强化,动脉期不均匀强化(见图4),随着时间的推移,病灶强化越来越明显。
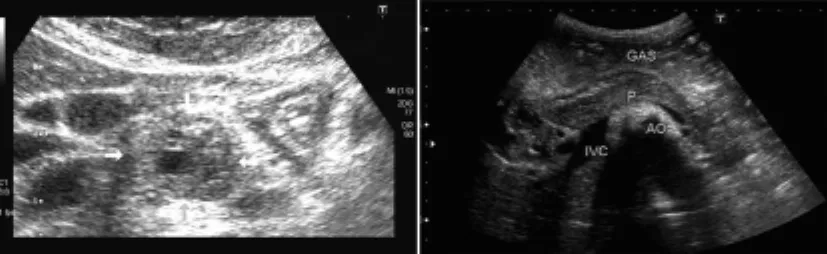
图1 腹部超声示实液混杂回声包块,可见完整包膜,内呈低、等回声Fig 1 The yellow arrow shows the lesions was solid liquidmixed echo mass on ultrasound

图2 CT平扫提示胰头钩突部混杂密度病灶,周边厚薄不均环状钙化,边界不清Fig 2 Mixed density lesions of the head of the pancreas uncinate process can be shown on CT scan,with peripheral uneven thickness annular calcification and unclear boundary
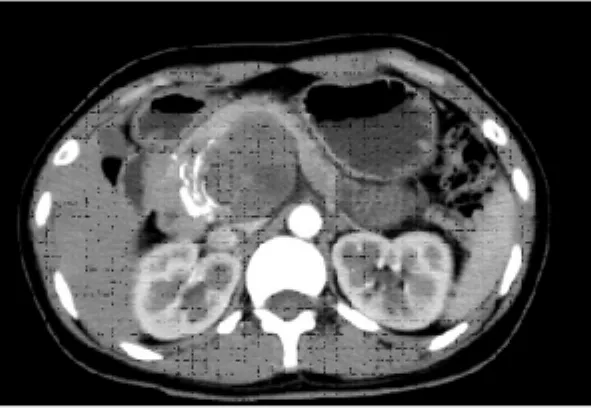
图3 CT增强(动脉期):胰腺头钩突部病灶不均匀稍强化,正常胰腺受压推移Fig 3 Enhanced CT(arterial phase):The pancreas uncinate process lesion was uneven slightly strengthened,normal pancreas was pressed aside

图4 MRI(动脉期):胰腺头钩突部病灶不均匀强化,其内见斑片状低信号影Fig 4 MRI(arterial phase):The pancreas uncinate process lesion was uneven strengthened,showing patchy low signal intensity
3 讨论
胰腺实质性假乳头状肿瘤为胰腺少见肿瘤,以青年女性多见,有报道男女比约为1∶9.5[3]。临床表现较为隐匿,发病早期通常没有特异性表现,临床常见症状与周围组织压迫有关,部分可出现黄疸。最常见的症状为腹痛,或可触及腹部包块,包块可缓慢增大,体检除了上腹部肿块外,缺少特异性表现,约20%的患者无明显症状而意外发现,本病具恶性潜能,但较少发生转移、扩散。本病相关血检验对诊断无重要价值,其诊断主要依赖于影像学及影像学引导下的穿刺活检。
SPTP通常是具完整包膜的较大肿块,可发生在胰腺头、体、尾部,体、尾部多于头部[4],此外偶有报道发生于胰腺以外的腹膜后、肠系膜甚至肝脏。肿瘤包膜大多完整,与周围胰腺分界清楚,周边淋巴结转移少见。镜下示均有厚薄不一的纤维性包膜,肿瘤有实性区、囊性区及假乳头区。假乳头区肿瘤细胞围绕血管周围排列,以纤细的纤维血管为轴心形成假乳头结构,伴有不同程度的出血、坏死。肿瘤细胞有丝分裂的比率高,异型核增多,血管侵犯往往提示肿瘤恶变,但在SPTP无一项有预测意义[5]。由于SPTP独特的形态学和生物学特点,在其起源上仍存在较多争论,虽然进行了大量的研究,至今其细胞起源仍不明确。免疫组化及电镜显示肿瘤同时具有内分泌和外分泌组织成分。
SPTP超声典型表现为边缘锐利,包膜完整,体积较大的囊实性肿块,其中囊性部分无回声,实性部分为中等回声,内部可有分隔或不规则钙化强回声。彩色多普勒显示肿瘤周边可见少许环状血流信号,内部囊性区内无血流信号,实性部分可探及少许微动静脉。有报道微小SPTP可能没有囊性改变和包囊[6-7]。Mirko 等[7]报道对比增强超声可见 SPTP典型表现,肿瘤呈现轻度的边缘增强,提示可能为微小胰腺假乳头状实质肿瘤对邻近胰腺实质的挤压形成的假包膜,其高质量的诊断性图像和增强的动态观察能力甚至优于CT和MRI。病灶可压迫推挤邻近组织、器官及血管,以胰头部肿瘤明显,如本组2例胰头部病灶,明显压迫门脉、胰管及胆总管。本病可有腹膜后淋巴结增大,本组2例腹膜后淋巴结增大。超声检查具有经济、快速便利的优势,且无放射性损害。内镜超声引导活检用于确诊本病,Jani等报道其诊断准确率达到75%[8]。SPTP的CT典型表现:肿瘤多位于胰腺边缘,呈外生性生长,为囊实性,可大可小,包膜完整,肿瘤密度取决于肿瘤实性和囊性成分比例,常为囊实混合性,偶见单纯囊性或单纯实性肿块密度。肿瘤可见钙化和出血,钙化多位于肿瘤周边部,表现为斑片样,多少不一。CT对钙化显示有优越[9-10],V增强扫描实性部分渐进性强化,强化程度略低于胰腺组织,包膜强化明显,但这些表现在诊断上无明显特异性[11]。增强CT同样可清楚显示肿瘤对周围组织结构及血管的受压推移。MSCT多平面成像及三维重建可从多角度更准确显示肿瘤与周围血管关系。CT可清楚显示腹膜后淋巴结增大。本组4例检查均呈囊实性混杂密度,2例病灶周边部钙化,2例腹膜后淋巴结中等增大。CT引导下的穿刺活检有诊断价值,但只有约25%的SPTP是由CT引导的穿刺活检来明确诊断的[12]。MRI组织分辨率高,可多方位直接成像,对于显示肿瘤及其邻近组织结构关系十分优越。SPTP在MRI上多表现为囊实性混杂信号影,其信号特征与肿瘤的组织成分有关。多表现为混杂长T1长T2信号,增强扫描肿瘤呈渐进性中等强化。MRI可显示SPTP出血,信号强度与出血时间长短有关,T1WI多表现为不均匀高信号,T2WI多表现为不均匀低信号。
年轻女性,符合上述USG、CT、MRI表现的胰腺肿瘤,可考虑为本病。本病鉴别诊断包括:①非功能性胰岛细胞瘤:血供较为丰富,一般强化显著。②囊腺瘤:多房性囊性肿块,壁和分隔可钙化,囊壁及分隔强化明显。③胰腺癌:乏血供肿瘤,增强后肿瘤强化不明显,包膜不完整,呈浸润性生长,常侵犯周围结构。
SPTP是胰腺少见肿瘤,发病隐匿,临床缺乏特异性表现,其诊断主要依赖于影像学,确诊需要影像学引导下的活检病理检查。本病多数属低度恶性,主要治疗方式为手术切除,术前详细的影像学检查对于手术策略的制定有重要的参考价值,除了传统开腹手术外,对于没有局部及远处转移的SPTP可采取侵袭小的微创手术治疗[13-15]。
[1] LAM KY,LO CY,FAN ST.Pancreatic solid-cystic-papillary tumor:clinicopathologic features in eight patients from Hong Kong and review of the literature[J].World J Surg,1999,23:1065 -1050.
[2] 康维明,廖泉,赵玉沛,等.胰腺实质性假乳头状肿瘤的外科诊治[J].中国医学科学院学报,2004,26(3):310 -312.
[3] MADAN AK,WELDON CB,LONG WP,et al.Solid and papillary epithelial neoplasm of the pancreas[J].J Surg Oncol,2006,85:193 - 198.[4] SALLA C,CHATZIPANTELIS P,KONSTANTINOU P,et al.Endoscopic ultrasound-guided fine-needle aspiration cytology diagnosis of solid pseudopapillary tumor of the pancreas:a case report and literature review[J].World JGastroenterol,2007,13:5158 -5163.
[5] CHANG H,GONGY,XUJ,et al.Clinical Strategy for the Management of Solid Pseudopapillary Tumor of the Pancreas:Aggressive or Less[J]?International Journal of Medical Sciences,2010,7(5):309-313.
[6] HYANG-EUN SEO,MYUNG-KWON LEE,YOUNG-DOO LEE,et al.Solid-pseudopapillary Tumor of the Pancreas[J].J Clin Gastroenterol,2006,60:919 -922.
[7] MIRKO D'ONOFRIO,ROBERTO MALAGO,FRANCESCA VECHIATO,et al.Contrast-Enhanced Ultrasonography of Small Solid Pseudopapillary Tumors of the Pancreas:Enhancement Pattern and Pathologic Correlation of 2 Cases[J].J Ultrasound Med,2005,26:869 -856.
[8] JANI N,DEWITT J,ELOUBEIDI M,et al.Endoscopic ultrasoundguided fine-needle aspiration for diagnosis of solid pseudopapillary tumors of the pancreas:a multicenter experience[J].Endoscopy,2008,60(3):200 -203.
[9] CANTISANI V,MORTELE KJ,LEVY A,et al.MR imaging features of solid pseudopapillary tumor of the pancreas in adult and pediatric patients[J].AJR Am J Roentgenol,2003,181:395 -601.
[10]葛玉杰,闻彩云.胰腺实体假乳头状瘤CT诊断分析[J].浙江临床医学,2009,11(5):565 -566.
[11]COLEMAN KM,DOHERTY MC,BIGLER SA.Solid-pseudopapillary tumor of the pancreas[J].Radiographics,2003,23:1666 -1668.
[12]KY A,SHILYANSKY J,GERSTLE J,et al.Experience with papillary and solid epithelial neoplasms of the pancreas in children[J].JPediatr Surg,1998,33:62 - 66.
[13]LEE W,PARK Y,CHOI J,et al.Solid and papillary neoplasms of the pancreas[J].Yonsei Medical J,1996,37:131 -161.
[14]BAKER MS,BENTREM DJ,UJIKI MB,et al.A prospective single institution comparison of peri-operative outcomes for laparoscopic and open distal pancreatectomy[J].Surgery,2009,166:635 -663.
[15]MARINIS A,ANASTASOPOULOS G,POLYMENEAS G.A solid pseudopapillary tumor of the pancreas treated with laparoscopic distal pancreatectomy and splenectomy:a case report and review of the literature[J].Journal of Medical Case Reports,2010,6:387.

