α-SMA在肝包虫囊肿周围组织中的表达*
刘桂生,彭心宇,吴向未,赵 瑾,张永国,张示杰,孙 红,张宏伟
2.石河子大学医学院病理教研室 ,石河子 832008
肝包虫病是畜牧地区常见的人兽共患性疾病,前期研究发现肝包虫囊肿周围纤维囊壁分为两层,外囊层和外膜层,且二者的形成机制不同[1],外膜是由于肝细胞变性、萎缩、坏死及寄生虫体刺激等原因,启动肝纤维化机制,被挤压肝内的Glisson系统和肝静脉系统及其所属纤维结构不断纤维化,最终形成包绕在外囊周围,外囊是棘球蚴定位于宿主脏器后由于宿主的免疫功能形成的肉芽肿,在外膜中TGF-β1的表达高于外囊[2],TGF-β1是一种具有多种生理功能的多肽,其作用因靶细胞和作用浓度不同而不同。TGF-β1是提高肝纤维化最有效的细胞因子,能够抑制肝细胞的增殖,激发HSC的活化,同时也能诱导肉芽组织中肌成纤维细胞表达高水平的A-SMA m RNA[3]。本实验采用免疫组化的方法检测α-平滑肌肌动蛋白在50例肝包虫囊肿中的表达,来探讨其肝包虫囊肿的病理生长过程的关系。
1 材料与方法
1.1 标本来源及取材 收集2010年3月-2011年6月间石河子大学医学院第一附属医院肝包虫新鲜手术标本50例,男27例,女23例。年龄10~78岁。大部分病例无特殊临床表现,并经手术证实。所有标本取材均包括肝包虫外囊、外膜及其邻近肝实质组织。
1.2 免疫组织化学染色 采用免疫组织化学En-Vision二步法。En Vision试剂盒、一抗为鼠抗人α-SMA(中杉金桥)。每批染色以磷酸盐缓冲液(PBS)代替一抗作阴性空白对照,同时用已知阳性表达的子宫肌瘤组织切片作阳性对照。具体方法按说明书进行。结果判断:根据显色深浅划分为4级,呈棕褐色或棕黄色反应分别为强阳性(+++)或阳性(++),浅黄色反应为弱阳性(+),无着色为阴性(-)。
1.3 统计学处理 对结果计数资料比较采用χ2检验。
2 结 果
2.1 免疫组织化学染色结果
2.1.1 阳性对照中α-SMA呈棕黄色片状分布(图1);阴性对照中无着色(图2)。
图1 阳性对照(SP,×100)Fig.1 Positive control(SP,×100)

图2 阴性对照(SP,×100)Fig.2 Negative control(SP,×100)
2.1.2 肝包虫囊肿周围α-SMA在外膜层表达呈棕黄色片状分布,定位于肌成纤维细胞。在外囊偶有表达,且多为浅黄色散在分布(图4),定位于肌成纤维细胞。周围肝组织中成棕黄色片状分布,主要集中在Glisson系统,定位于肌成纤维细胞和血管平滑肌细胞(图3)。其在外囊表达阳性率低于外膜层,差异有统计学意义(χ2=30.136,P<0.01)(表1)。

图3 免疫组织化学检测α-平滑肌肌动蛋白在肝包虫囊肿周围组织中的表达(SP,×40)Fig.3 Expression ofα-SMA in the surrounding tissues of hydatid cysts(SP,×40)
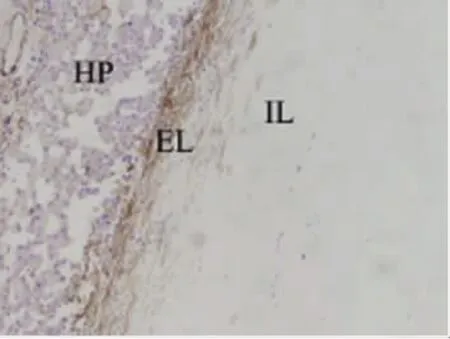
图4 免疫组织化学检测α-平滑肌肌动蛋白在肝包虫囊肿周围纤维囊壁中的表达DAB染色,肝包虫囊肿周围纤维囊壁分两层(IL:外囊;EL:外膜)。EL呈棕褐色反应为强阳性(⧻),IL无着色为阴性(-)(SP,×100)Fig.4 Expression ofα-SMA in the pericystic layers of hydatid cystsDAB staining,delaminated expression was observed in the pericystic layer(inner-layer,IL;external-layer,EL)(SP,×100)
3 讨 论
成纤维细胞(fibroblast,FB)是创伤愈合中的主要修复细胞,不仅具有旺盛的合成功能,还能合成一种类似平滑肌细胞具有收缩功能的细胞亚型-肌成纤维细胞(myofibroblast;MFB),MFB表达有平滑肌细胞特有的α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA),其特性还包括双极型的细胞形态,大量应力纤维及转膜连接的形成[4]。迁移中的FB转化为MFB,MFB既能合成胶原纤维,又具有收缩功能[5]。肌成纤维细胞最早由 Gabbiani(1971)报道,其形态特点介于FB和平滑肌细胞之间,光镜下为梭形或长扁形细胞,不易与结缔组织中其他细胞区分;电镜观察可见胞质内微丝束、核切迹、密体及细胞与细胞、细胞与基质的连接,而这些不同于FB的超微结构是 MFB具有收缩功能的基础[6],MFB表达出α-SMA,肌成纤维细胞经由α-SMA构成的压力纤维传递张力给细胞外基质,从而引起组织收缩[7],大量实验也证实组织的收缩与α-SMA的表达呈正相关[8-9]。α-SMA 作为细胞骨架蛋白,是成纤维细胞收缩表型的典型标志[10],它通过跨膜复合物Fibronexus与成纤维细胞外纤维粘连蛋白相连,在外界信号的刺激下产生强烈而持久的收缩,而成纤维细胞外纤维粘连蛋白可与细胞外基质或其它成纤维细胞相连,从而能把成纤维细胞的收缩传导至整块组织[11]。
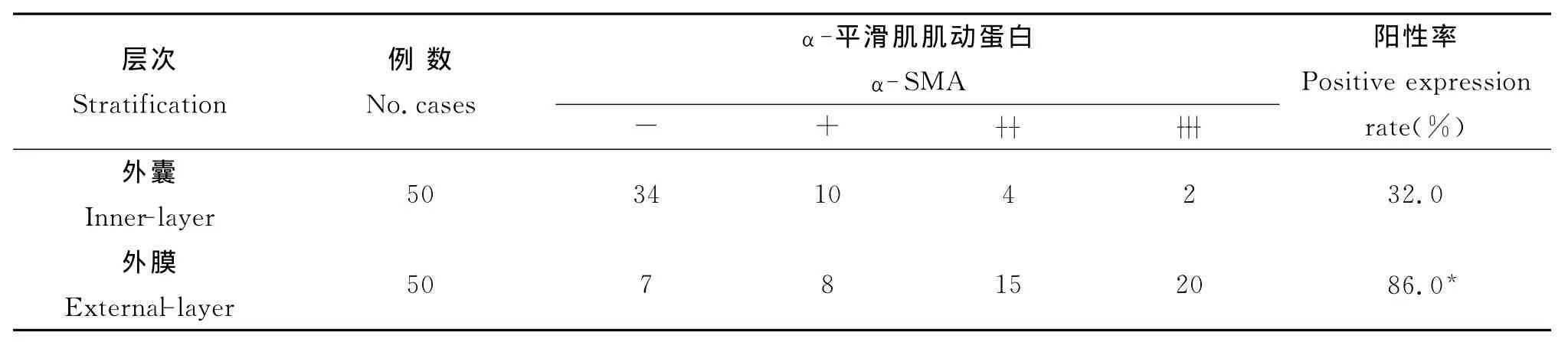
表1 α-平滑肌肌动蛋白在肝包虫囊肿周围纤维囊壁中的表达Tab.1 Comparison of the expression of A-SMA in the pericystic layers of hydatid cysts
正常情况下,肌成纤维细胞存在于一些需要收缩的器官组织中,在某些病理状态下,肌成纤维细胞也会出现[12],尤其是在损伤修复过程中,肌成纤维细胞是伤口收缩的主要力量[13]。在某些特殊的病理状态下,肌成纤维细胞并不消退,持续表达肌动蛋白及分泌胶原等细胞外基质,并产生收缩,从而导致一系列病理生理过程的发生。
肝星状细胞是肝纤维化发生细胞机制的重要环节。肝星状细胞是肝脏间质细胞之一,正常肝脏的肝星状细胞为静止型细胞,储存大量的维生素A,产生少量的Ⅰ型及Ⅳ型胶原[14-15]。当肝脏发生损伤时,由枯否细胞、肝实质细胞、内皮细胞和血小板产生的激活始动因子激活肝星状细胞[16-18]。这个活化过程包括表型向肌成纤维样的改变,增殖速度增加,粗面内质网肥大,细胞外基质沉积增加,维生素A减少或消失,其中以α-平滑肌肌动蛋白显著增殖,合成大量细胞外基质为特征[19]。
前期研究认为由于肝细胞变性、萎缩、坏死及寄生虫体刺激等原因,启动肝纤维化机制,而肝发生纤维化时,由于慢性损伤的长期刺激,肝星状细胞(hepatic stel-late cell,HSC)被激活,转化为肌成纤维细胞,表达α-SMA[13]。实验中我们发现在不同时期的肝包虫囊肿周围组织中α-SMA都有不同程度的表达,肝包虫囊肿周围α-SMA在外膜层表达呈棕黄色片状分布,在外囊偶有表达,且多为浅黄色散在分布,其在外囊表达阳性率低于外膜层,而且两者有显著差异,这说明外膜与外囊形成机制不同。由于肝细胞变性、萎缩、坏死及寄生虫体刺激等原因,启动肝纤维化机制,被挤压肝内的Glisson系统和肝静脉系统及其所属纤维结构不断纤维化,最终形成外膜包绕在外囊周围。外囊是棘球蚴定位于宿主脏器后由于宿主的免疫反应形成的肉芽肿,这与前期研究提出的外膜与外囊的形成机制相符。
研究表明在正常肝脏中α-SMA只分布于血管壁[20]。α-SMA在肝包虫囊肿周围肝组织中呈棕黄色片状分布,主要集中在Glisson系统,这可能与肝纤维化进程相关,而外膜的形成与肝纤维化机制相关,因此α-SMA在肝包虫囊肿生长过程中起着重要作用。可能与我们临床上观察到的许多现象相关。
上述研究尚属初步,对于肝包虫病囊肿自然病程中动态生长的观察及其与α-SMA的关系,人体其他脏器的局部反应等还有待于进一步的研究。
[1]Wu XW,Chen XL,Peng XY,et al.The specific expression of collagen I,III and IV in the pericystic layer of hepatic hydatid cyst[J].Chin J Zoonoses,2004,20(10):876-879.(in Chinese)
吴向未,陈雪玲,彭心宇,等.Ⅰ、Ⅲ、Ⅳ型胶原在肝包虫囊肿周围人体纤维囊壁中的特异性分层表达[J].中国人兽共患病杂志,2004,20(10):876-879.
[2]Peng XY,Wu XW,Zhang SJ,et al.Recognition on pathological structure of fibrotic cyst wall around hydatid cyst of liver[J].World Chin J Digestol,2005,13(3):276-279.(in Chinese)
彭心宇,吴向未,张示杰,等.肝包虫囊肿周围纤维囊壁病理结构的再认识[J].世界华人消化杂志,2005,13(3):276-279.
[3]Desmoulière A,Geinoz A,Gabbiani F,et al.Transforming growth factor-beta 1 induces alpha-smooth muscle actin expression in granulation tissue myofibroblasts and in quiescent and growing cultured fibroblasts[J].J Cell Biol,1993,122(1):103-111.
[4]Liu YK,Lu SL.The influence of mechanical stimulation on the outcome of muscle fibroblasts[J].Chin J Traumatol,2002,18,(11):703-704.(in Chinese)
刘英开,陆树良.力学刺激对肌成纤维细胞转归的影响[J].中华创伤杂志,2002,18(11):703-704.
[5]Liu Y,Cen Y,Tang Y,et al.The role of myofibroblast in the development of pathological scar[J].Chin J Reparat Reconstruct Surg,2005,19(1):39-41.(in Chinese)
刘勇,岑瑛,唐颖等.肌成纤维细胞在病理性瘢痕形成中的机制[J].中国修复重建外科杂志,2005,19(1):39-41.
[6]Eyden B.Electron microscopy in the study of myofibroblastic lesions[J].Semin Diagn Pathol,2003,20(1):13-24.
[7]Hinz B,Gabbiani G.Cell-matrix and cell-cell contacts of myofibroblasts:role in connective tissue remodeling[J].Thromb Haemost,2003,90(6):993-1002.
[8]Zaleskas JM,Kinner B,Freyman TM,et al.Growth factor regulation of smooth muscle actin expression and contraction of human articular chondrocytes and meniscal cells in a collagen-GAG matrix[J].Exp Cell Res,2001,270(1):21-31.
[9]Tian YF,Tang SM,Luo SJ,et al.A study on the expressions
and the correlation of TGF-βandα-SMA in scar[J].Chin J Plasts Surg,2000,16(2):75-77.(in Chinese)
田宜肥,汤少明,罗少军,等.TGF-β和α-SMA在瘢痕组织中的表达及相关性研究[J].中华整形外科杂志,2000,16(2):75-77.
[10]Muchaneta-Kubara EC,el Nahas AM.Myofibroblast phenotypes expression in experimental renal scarring[J].Nephrol Dial Transplant,1997,12(5):904-915.
[11]Huang H,Tang SJ,Bao WH,et al.Expression ofα-smooth muscle attin in scar fibroblastsinvitro[J].Chin J Reparat Reconstruct Surg,2001,15(6):347-350.(in Chinese)
黄辉,唐胜建,鲍卫汉.α-平滑肌肌动蛋白在瘢痕成纤维细胞中的表达[J].中国修复重建外科杂志,2001,15(6):347-350.
[12]Schurch W,Seemayer TA,Gabbiani G.Myofibroblast,//Stemberg SS,Histology for pathologists[M].New York:Ra-ven Press,1992,109-144.
[13]Darby I,Skalli O,Gabbiani G.Alpha-smooth muscle actin is transiently expressed by myofibroblasts during experimental wound healing[J].Lab Invest,1990,63(1):21-29.
[14]Ramadori G,Armbrust T.Cytokines in the liver[J].Eur J Gastroenterol Hepatol,2001,13(7):777-784.
[15]Masunaga H,Fujise N,Shiota A,et al.Preventive effects of the deleted form of hepatocyte growth factor against various liver injuries[J].Eur J Pharmacol,1998,342(2/3):267-279.
[16]Lee KS,Lee SJ,Park HJ,et al.Oxidative stress effect on the activation of hepatic stellate cells[J].Yonsei Med J,2001,42(1):1-8.
[17]Kim WH,Matsumoto K,Bessho K,et al.Growth inhibition and apoptosis in liver myofibroblasts promoted by hepatocyte growth factor leads to resolution from liver cirrhosis[J].Am J Pathol,2005,166(4):1017-1028.
[18]Cramer T,Schuppan D,Bauer M,et al.Hepatoctye growth factor and c-Met expression in rat and human liver fibrosis[J].Liver Int,2004,24(4):335-344.
[19]Guo YH,Yu XF,Yu HQ,et al.The effect of perioperative entreal immunonutrition on live regeneration function in cirrhotic rats with partial hepatectomy[J].Chin J Gener Surg,2007,16(3):258-260.(in Chinese)
郭跃华,于小舫,于会群.围手术期肠内免疫营养对肝硬化肝切除大鼠肝再生的影响[J].中国普通外科杂志,2007,16(3):258-260.
[20]Wu XR,Lv MH,Wang Q,et al.The plasma levels of transforming growth factorβ1 and the protein expressions of a-SMA,urokinase plasminogen activator and plasmlnogen activator inhibitor-1 in liver of patients with different grades of hepaticfibrosis[J].Chin J Hepatol,2004,12(7):400-402.(in Chinese)
武希润,吕敏和,王琦等.α-平滑肌肌动蛋白表达及血浆转化生长因子β1变化在肝纤维化发生发展中的作用[J].中华肝脏病杂志,2004,12(7):400-402.

