宫颈细胞学检查为意义不明确的非典型鳞状细胞患者的分流处理探讨
张宏珍,张巧玉,成争先,温 娜,陈小燕
(中国人民解放军第三○九医院妇产科,北京 100091)
宫颈癌是发展中国家最常见的妇科恶性肿瘤。2007年发达国家宫颈癌为87466例,而发展中国家为473430例[1]。细胞学检查作为癌前病变或早期宫颈癌筛查的最有效手段[2]。细胞学检查结果为意义不明确的非典型鳞状细胞(ASCUS)宫颈病理检查结果差异很大,可以是正常的宫颈组织或宫颈浸润癌,细胞学检查的敏感性低于50%,可能遗漏宫颈上皮内瘤变(CIN)Ⅲ或癌[3]。因此,对ASCUS正确的进一步处理策略非常重要。已经公认的是人乳头状瘤病毒(HPV-DNA)感染可以导致宫颈癌,80%以上的宫颈癌是可以预防的,高危型人乳头状瘤病毒检测已经成为美国非典型鳞状上皮细胞(ASCUS)患者的常规检查,并成为许多阴道镜检查后和临床处理后独立的随访项目[4-6]。美国宫颈癌筛查指南建议对30岁以上女性进行巴氏试验及高危型HPV的检测,并且对二者均为阴性者每隔3年筛查1次[4-7]。本文对218例ASCUS患者采用高危型HPV-DNA检测和电子阴道镜检查,同时对HPV-DNA阳性者在阴道镜下进行活组织检查。本研究旨在探讨高危型HPV-DNA检测在ASCUS患者的进一步处理中的价值。
1 资料与方法
1.1 一般资料 对2008年7月至2010年11月在本院妇产科门诊因宫颈疾病就诊的患者行液基薄层细胞学检查(TCT)结果为ASCUS者,且进行高危型人乳头瘤病毒DNA(HPVDNA)检测及阴道镜下宫颈活检的218例患者作为研究对象,孕妇不纳入研究。218例ASCUS患者平均年龄为38.7岁(18~63岁),初次性生活的平均年龄为20.4岁(14~28岁),性伴侣的平均数量为1.6个,有白带增多或接触性出血者161例,无症状者57例。
1.2 方法
1.2.1 宫颈细胞学检查 患者检查前3d不做阴道冲洗或阴道给药,24h内禁止性生活。采用TCT进行检测,采用宫颈刷收集子宫颈外口、宫颈管脱落细胞,并立即洗入装有保存液的样本保存瓶中,经过美国新柏氏公司提供的TinPrep2000处理仪对样品进行检测。细胞学诊断标准采用TBS分类法。
1.2.2 HPV-DNA检测 采用美国Digene公司提供的HC2-HPV-DNA检测技术,可同时检测出13种高危型 HPV。≥5000拷贝为阳性。按试剂盒操作步骤进行检测。阈值设定:取3~10个循环的荧光信号;阈值设定原则以阈值线恰好超过正常阴性对照品扩增曲线的最高点,且CT值=0.0为准。结果判定:样品CT值显示为Undet判定为阴性;样品CT≤32,判定为阳性;若32<CT<35的样本建议重做,重做CT<35者为阳性,否则为阴性。
1.2.3 阴道检查和宫颈活检 对宫颈先后施以生理盐水、3%~5%醋酸及鲁格液染色,并在光电一体数码成像系统指引下,观察宫颈有无黏膜白斑、异型血管、醋酸白上皮、镶嵌及碘染色阳性区域,对可疑病灶进行定位活检,若镜下未发现异常病灶,在宫颈3、6、9、12点取活检或宫颈搔刮取宫颈管组织。阴道镜检查及宫颈活检等由妇产科专职医生完成。所有病理检查均由本院具有丰富经验的专职病理科医生完成。
1.3 统计学处理 采用SPSS11.0统计软件进行数据分析,率的比较采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 ASCUS与组织学的相关性 218例TCT诊断为ASCUS,阴道镜下定位活检组织病理学结果显示,正常宫颈组织或良性病变47.71%,CINⅠ为37.16%,CINⅡ为9.17%,CINⅢ为5.05%,见表1。
2.2 高危型HPV与组织学的相关性 218例ASCUS患者中高危型HPV阳性113例(51.85%),其中阴道镜下宫颈活检病理检查结果为正常宫颈5例,炎症11例,CINⅠ66例,CINⅡ18例,CINⅢ11例,浸润癌中2例,组织学结果为CIN以上97例,检出率为85.84%。高危型HPV与阴道镜定位下活检的组织病理学结果的相关性见表1。高危型HPV-DNA阳性组CIN检出率为85.84%,明显高于阴性组的16.19%,差异有统计学意义(P<0.05)。33例高级别CIN中有31例高危型HPV-DNA阳性。
2.3 阴道镜下评估与组织学的相关性 218例ASCUS患者阴道镜检查,拟诊为CIN以上94例,其中CINⅠ65例,CINⅡ17例,CINⅢ10例,浸润癌2例。与宫颈组织学病理检查结果相符68例(CINⅠ50例,CINⅡ8例,CINⅢ8例,浸润癌2例),阴道镜评估与病理诊断符合率为59.65%,见表2。
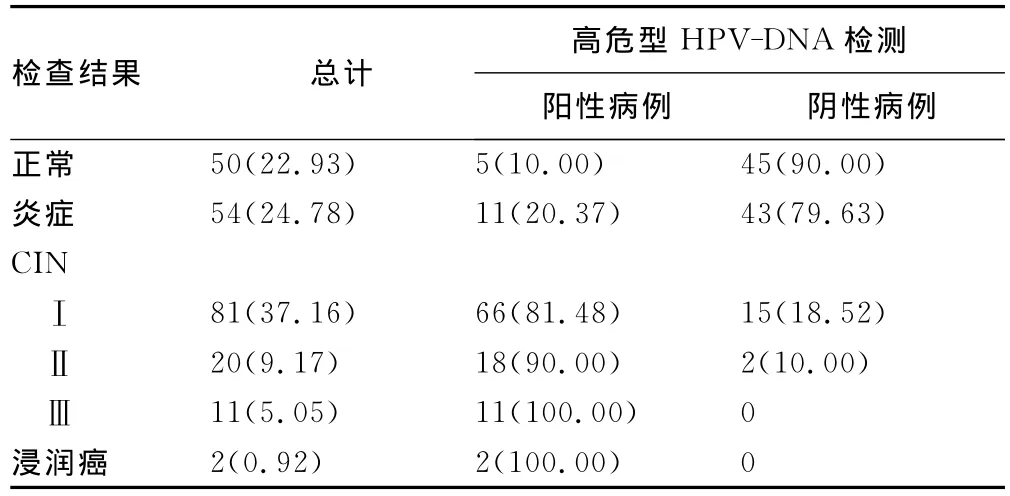
表1 高危型HPV-DNA检测与阴道镜下宫颈活检病理检查结果的关系[n(%)]
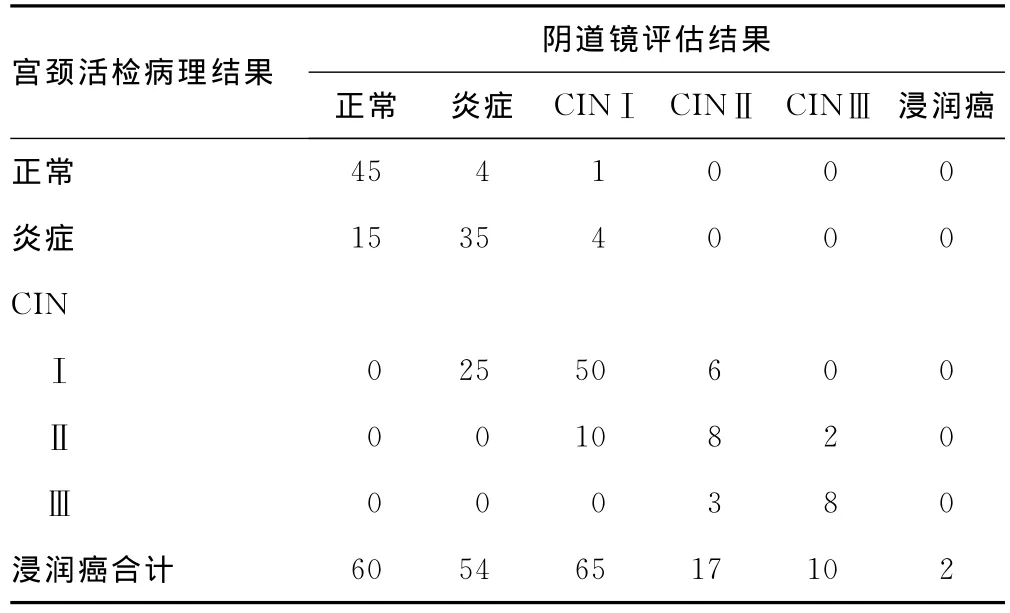
表2 阴道镜评估与活检病理结果的相关性(n)
3 讨 论
细胞学检查是目前宫颈癌筛查中应用最广、最有效的检查手段。细胞学筛查结果异常通常与病理学结果有关。大量研究结果显示,ASCUS可能是反应性变化,也可能隐藏着CIN,甚至癌变,宫颈活检病理结果可以是正常,也可能为宫颈浸润癌。作者对218例TCT诊断为ASCUS并进行了阴道镜下定位活检组织病理学结果显示:阴道镜评估与病理诊断符合率为59.65%,与宋淑芳等[8]报道的结果相近。文献报道在阴道镜下评估中20%~60%的ASCUS与CIN有关。因此,对这类患者的处理策略是要将高级别的宫颈癌前病变鉴别出来。目前对ASCUS患者的处理流程仍没有统一认识,对ASCUS的处理在既往常局限于阴道镜随访和重复细胞学检查。大量文献证实,这种诊断缺乏重复性,细胞学检测存在较高的变异性和存在遗漏少量但明确宫颈癌前的病变(CINⅡ~Ⅲ)的风险。3~6个月随访1次细胞学检查,可能存在延误诊断和随访缺失的问题。而立即在阴道镜下行宫颈活检,这对发现癌前高度病变(HSIL)具有较高的敏感性、特异性,还可减少随访中断,但并不是所有的ASCUS患者都需要做阴道镜检查。同时患者在等待复查的过程中承受着较大焦虑和精神压力,故对细胞学诊断为ASCUS的患者行进一步分流检查十分重要。
高危型HPV是引起子宫颈癌及其癌前病变的必要因素。虽然高危型HPV感染可在一般人群中流行,但通常是短暂的,很少引起临床症状,只有持续感染HPV的妇女,才成为子宫颈癌的高危人群。目前已有基于HPV相关疫苗用于预防宫颈癌的报道[9]。持续 HPV16感染的ASCUS患者中CINⅢ发生率明显高于没有持续HPV16感染的ASCUS患者(P<0.01)[10]。细胞学异常的HPV阴性患者中很少发展为宫颈癌前病变[11]。Atkins等[12]对ASCUS患者2年的随访结果显示,1796例HPV阴性的女性在2年内没有1例发生癌变,然而,HPV阳性者中有7例发生了癌变。同样在另一项研究显示,1591例HPV阴性的ASCUS患者中仅22例(1.4%)发展为CINⅢ或癌症,而HPV阳性的1767例ASCUS患者中则有269(15.2%)发展成CINⅢ或癌(P<0.001),HPV试验的特异性明显高于细胞学检查(P<0.001)[13]。细胞学检查、HPV检测或联合细胞学、HPV检测试验对CINⅢ或宫颈癌的阳性预测值分别为2.6%、2.3%和2.2%,但阴性预测值分别为99.7%、99.8%、100%,提示HPV检测对宫颈癌癌前病变或宫颈癌具有较高的阴性预测值,使HPV检测成为ASCUS处理策略中非常有生机的选择[14]。这些研究均提示,高危型HPV具有较高的阴性预测值,为了避免不必要的阴道镜检查,高危型HPV检测是评估患者是否真的面临宫颈癌风险的理想选择。本院采用的高危型 HPV-DNAⅡ代杂交捕获实验(HC2)能够同时检测出与宫颈癌密切相关的13种高危型HPV。HC2是目前惟一被美国FDA批准用于宫颈癌筛查的HPV检测法,是一个放大的酶标板技术。本研究218例ASCUS患者中,高危型 HPV-DNA阳性组CIN检出率为85.84%,明显高于阴性组的16.19%,CINⅢ及浸润癌均为高危型 HPV-DNA阳性。高危型 HPV感染在炎症组为20.37%,CINⅠ组为81.48%,CINⅡ组为90%,CINⅢ组为100%,宫颈癌组为100%,提示高危型HPV阳性率随着病理学病变程度的加重而增加,与陈宝莲[15]的研究结果类似。
综上所述,高危型HPV-DNA检测对ASCUS具有分流作用,高危型HPV阴性者可于6~12个月复查重复细胞学检查,阳性者则应及时作阴道镜检查,从而可以降低阴道镜检查率而仍有较高的宫颈病变检出率,减轻患者负担,节约医疗资源。
[1]Garcia M,Jemal A,Ward EM,et al.Global cancer facts and figures 2007[M].Atlanta,GA:American Cancer Society,2009:3072-3075.
[2]梁爽,王彬.液基薄层细胞检查在宫颈癌及癌前病变筛查中的应用 [J].重庆医学,2009,38(24):3072-3075.
[3]American College of Obstetricians and Gynecologists.Management of abnormal cervical cytology and histology.ACOG practice bulletin no.99[J].Obstet Gynecol,2008,112(6):1419-1444.
[4]American College of Obstetricians and Gynecologists.ACOG Practice Bulletin.Clinical management guidelines for obstetrician gynecologists[J].Obstet Gynecol,2005,105(4):905-918.
[5]Wright TC Jr,Massad LS,Dunton CJ,et al.2006consensus guidelines for the management of women with abnormal cervical cancer screening tests[J].Am J Obstet Gynecol,2007,197(4):346-355.
[6]Safaeian M,Solomon D,Wacholder S,et al.Risk of precancer and follow-up management strategies for women with human papillomavirus-negative atypical squamous cells of undetermined significance[J].Obstet Gynecol,2007,109(6):1325-1331.
[7]Saslow D,Runowicz CD,Solomon D,et al.American Cancer Society guideline for the early detection of cervical neoplasia and cancer[J].CA Cancer J Clin,2002,52(6):342-362.
[8]宋淑芳,尹利荣,宋静慧.阴道镜检查在宫颈细胞学ASCUS分流管理中的应用[J].中国实用妇科与产科杂志,2010,26(2):129-131.
[9]Paavonen J,Jenkins D,Bosch FX.Efficacy of a prophylactic adjuvanted bivalent L1virus-like-particle vaccine against infection with human papillomavirus types 16and 18in young women[J].Lancet,2007,396(9580):2161-2170.
[10]Gage JC,Schiffman M,Solomon D,et al.Comparison of measurements of human papillomavirus persistence for postcolposcopic surveillance for cervical precancerous lesions[J].Cancer Epidemiol Biomarkers Prev,2010,19(7):1668-1674.
[11]Castle PE,Cox JT,Jose J,et al.An Analysis of High-Risk Human Papillomavirus DNA-Negative Cervical Precancers in the ASCUS-LSIL Triage Study(ALTS)[J].Obstet Gynecol,2008,111(4):847-856.
[12]Atkins KA,Jeronimo J,Stoler MH,et al.Description of patients with squamous cell carcinoma in the atypical squamous cells of undetermined significance/low-grade squamous intraepithelial lesion triage study[J].Cancer,2006,108(4):212-221.
[13]Mahboobeh S,Diane S,Sholom W,et al.Risk of precancer and follow-up management strategies for women with human papillomavirus-negative atypical squamous cells of undetermined significance[J].Obstet Gynecol,2007,109(6):1325-1331.
[14]Kiatpongsan S,Niruthisard S,Mutirangura A,et al.Role of human papillomavirus DNA testing in management of women with atypical squamous cells of undetermined significance[J].Int J Gynecol Cancer,2006,16(1):262-265.
[15]陈宝莲.HPV-DNA检测筛查宫颈癌价值探讨[J].重庆医学,2009,38(7):854-855.

