促甲状腺素受体基因D727E多态性与甲状腺相关性眼病的相关性研究
尹晓艳 闫春芳 孙斌
甲状腺相关性眼病(thyroid-associated ophthalmopathy,TAO)是一种与多种因素相关的常见的眼眶疾病[1],是以眼球后及眶周组织的浸润性病变为特征的自身免疫性疾病,是引起成人眼球突出的最常见原因。近些年来,许多国内外的专家学者对TAO进行了研究,在发病机制和诊断方法上,取得了一定的进展,但是由于样本大小、研究人群以及地域的不同,各研究结论不同。目前普遍认为是遗传因素、免疫学因素及外界环境共同作用产生。国内外研究表明,基因的多态性可能与TAO的发病有关。由于TAO常伴随GD发生,很多患者血清促甲状腺素受体抗体(anti-thyrotropin receptor antibody,TRAb)含量增高[2],因此促甲状腺素受体(TSHR)成为TAO自身抗原的研究首选。然而,TSHR与TAO的作用机制还不是很明确。目前国内外尚未见TAO和TSHR多态性关系的文献报道。本研究旨在探讨TSHR基因与TAO的关系,并采用PCR-RFLP方法研究TSHR基因D727E多态性与TAO的关系,为TAO的预防及治疗提供重要的实验依据。
1 资料与方法
1.1 一般资料 TAO组:51例,男20例,女31例;年龄9~65岁,平均(39.98±14.84)岁。病程1月~19年,平均(1.69±3.19)年,样本均来自山西医科大学第一及第三医院眼科确诊的患者,纳入标准为1979年美国甲状腺协会(American Thyroid Association,ATA)制定的诊断及分级标准[3],患者均经甲状腺功能测定、眼部B超或CT检查排除了其他疾病所导致的突眼,并且有专人测量其双眼突出度[4];GD组:55例,男24例,女31例;年龄13~78岁,平均(34.33±9.501)岁。病程1月~11年,平均(2.83±4.21)年,纳入标准为《内科学》第7版Graves病[5]。CON组:60例,男24例,女36例,年龄12~76岁,平均(41.67±10.36)岁,为山西医科大学第一医院健康体检中心筛选的无自身免疫性及感染性疾病的健康人群,年龄、性别与病例组相匹配。所有患者及健康对照者均为山西地区汉族人,并签署了知情同意书。
1.2 临床检查 一般检查:包括详细询问病史及全身体检。
眼部常规检查:包括视力、外眼、屈光系统、眼底和眼球运动。眼球突出度检查采用Hertel突眼计检查。根据我国正常人眼球突出度标准:双眼球或单眼球突出度>14mm,或双眼球突出度相差≥2mm者,为眼球突出(除外生理性或假性突出)。用复视图检查分析眼外肌功能。部分患者行眼眶CT、B超检查,分析眼外肌、视神经及眶内病变状况,以协助诊断。
1.3 TSHR D727E多态性研究方法 (1)基因提取 抽取空腹静脉血2ml,EDTA-K2抗凝,用饱和酚-氯仿三步法提取外周血DNA。(2)引物合成 引物由上海生工生物工程技术服务公司合成。上游引物:5’-CCATTCCTCTATGCTATTTTCAC-3’;下游引物:5’-CCGTTTGCATATACTCTTCTG-3’[6]。(3)PCR扩增反应 反应体系40ul,由8ul基因组DNA,4ul 10×Buffer,0.8ul 10×dNTP,3.2ul 25mmol/L MgCl2,0.06ul上游引物,0.06ul下游引物,0.32ulTaq酶,24ul去离子水组成。循环参数:94℃预变性5min,94℃变性45s,61.6℃退火45s,72℃延伸45s,循环35次,72℃终末延伸10 min。目的基因片段长度为265bp。(4)酶切:扩增产物经限制性内切酶NlaⅢ酶切后经聚丙烯酰胺凝胶电泳分离,在紫外透射仪下观察条带。
1.4 统计学方法 运用Hardy-Weinberg平衡法则检验样本的群体代表性。用SPSS19.0统计软件分析各组等位基因和基因型频率,组间比较用χ2检验,显著性检验水准а=0.05。
2 结果
2.1 TSHR D727E位点酶切产物电泳结果 TSHR D727E位点野生型(CC)片段为160bp、84bp和21bp 3个片段;纯合变异型(GG)片段为181bp和84bp 2个片段;杂合变异型(GC)片段为181bp、160bp、21bp和84bp 4个片段,如图1。

图1 TSHR D727E位点酶切产物电泳结果。M:marker;4、5、6、7野生型CC;3纯合变异型GG;1、2、8、9杂合变异型GC。
2.2 TSHR D727E位点等位基因频率与基因型的分布 G等位基因频率:TAO组(28.4%)GD组(15.5%)CON组(5.8%),χ2=21.020,а=0.000<0.05,表明G等位基因频率三组之间有差异。两两比较,TAO组与GD组,χ2=5.246,а=0.022<0.05;TAO组与CON组,χ2=20.723,а=0.000<0.05;GD组与CON组,χ2=5.684,а=0.017<0.05。表明此三组两两之间G等位基因频率差异均有统计学意义,TAO组G等位基因频率(28.4%)明显高于GD组(15.5%)及正常对照组(5.8%);GD组G等位基因频率(15.5%)明显高于正常对照组(5.8%)。
GG+GC基因型频率:TAO组(47.1%)GD组(25.5%)CON组(10.0%),χ2=19.482,а=0.000<0.05,表明GG+GC基因型频率三组之间有差异。两两比较,TAO组与GD组,χ2=5.371,а=0.020<0.05;TAO组与CON组,χ2=19.196,а=0.000<0.05;GD组与CON组,χ2=4.771,а=0.029<0.05。表明此三组两两之间GG+GC基因型频率差异均有统计学意义,TAO组GG+GC基因型频率(47.1%)明显高于GD组(25.5%)及正常对照组(10.0%);GD组GG+GC基因型频率(25.5%)明显高于正常对照组(10.0%),如表1。
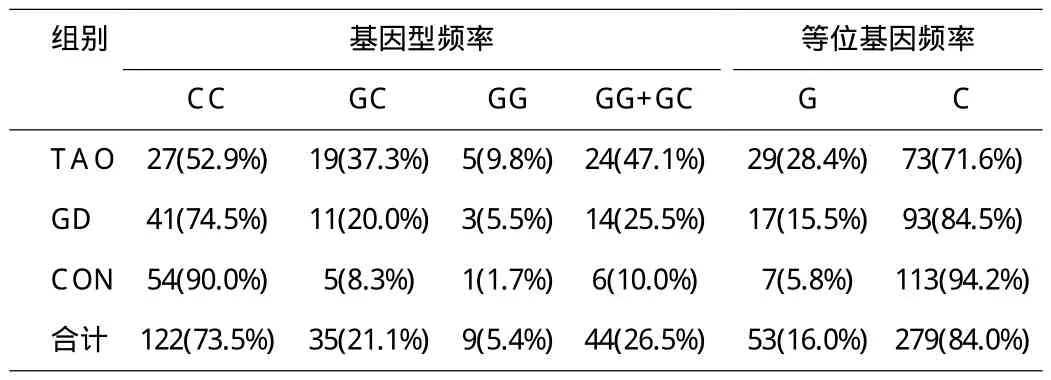
表1 TSHR D727E基因型及等位基因频率分布
3 讨论
TSHR是一种跨膜性蛋白,属于G蛋白偶联受体,体内主要分布在甲状腺滤泡细胞膜上[7]。研究表明TSHR是许多自身免疫性甲状腺疾病(auto immune thyrod disease,AITD)主要的自身抗原之一。在生理状态下,促甲状腺素(TSH)通过TSHR而影响甲状腺细胞的生长、分化和功能的发挥。病理状况下,TSHR又是TRAb攻击的靶,是引起甲状腺机能亢进(甲亢)的自身抗原[8]。TSHR的主要功能为与TSH结合,通过腺苷酸环化酶- cAMP途径发挥生理作用。若编码TSHR的序列发生了变异,可引起TSHR蛋白结构和免疫源性改变,导致自身抗体产生,包括针对甲状腺刺激性(TSAb)或阻断性(TBAb)等抗体。在GD时,TSAb可抑制Fas在TEC的表达,从而抑制Fas/FasL引起的TEC凋亡,参与GD甲状腺肿的形成[9]。但TBAb的产生是否与TSHR基因突变有关的问题颇有争议,仍需要进一步的研究[10]。
编码人TSHR的基因位于14号染色体长臂(14q13),全长超过60kb,约含58000碱基对,有10个外显子,9个内含子。第1至第9外显子编码TSHR的细胞外功能区,而跨膜区及细胞内区则由单个巨大的始基型第10个外显子编码[11]。到目前为止,已发现TSHR基因上膜内区的D727E(Asp-Glu)的改变与GD相关,但各家报道的结论相去甚远。目前国内外尚未见TAO和TSHR多态性关系的文献报道。
本研究以TSHR为候选基因,采用PCR-RFLP方法探讨TSHR基因D727E多态性与山西地区部分汉族人TAO易感性的关系。其结果显示:G等位基因频率及GG+GC基因型频率三组之间有差异,此三组两两之间差异均有统计学意义,TAO组G等位基因频率及GG+GC基因型频率明显高于GD组及正常对照组;GD组G等位基因频率及GG+GC基因型频率明显高于正常对照组。表明TSHR基因D727E位点的G等位基因与TAO及GD的发生相关。由此,从基因学的角度我们支持TSHR是甲状腺和眼眶受累组织共同抗原的学说。此结果与梁军等人研究结论不一致[12],他们认为汉族人TSHR受体基因与GD无相关性。
目前不同研究中存在的许多不一致现象,可能是由于遗传易感因素的异质性造成的。通过对不同群体的基因型-表现型相关性分析,可揭示遗传异质性在疾病发生、发展中的作用。因此有很多的问题尚需我们进一步探讨、研究和改进。
[1]Terwee CB,Dekker FW,Mourits MP,et al.Interpretation and validity of changes in scores on the Graves’ophthalmopathy quality of life questionnaire after different treatment[J].Clin Endo,2001,54(3):391-398.
[2]孙斌,李重文,宋补昌,等.Graves病与Graves眼病的FT3、FT4、STSH、TGAb、TMAb、TRAb检测及临床意义[J].中国实用眼科杂志,2005,23(5):537-539.
[3]李风鸣.眼科全书[M].北京:人民卫生出版社,1996:1232-1233.
[4]原惠萍.眼科测量的正常值[A]//惠延年.眼科学[M].6版.北京:人民卫生出版社,2004:278-280.
[5]陆再英,钟南山.内科学[M].7版.北京:人民卫生出版社,2008:717-718.
[6]Chou HT,Shi YR,Chang CT,et a1.The Polymorphisms ofCodon 727 and 52 of Thyroid-Stimulating Hormone Receptor Gene arc not Associated with Mitml Valve Prolapse Syndrome in Taiwan Chinese[J].Jpn Heart J,2002,43(6):655-666.
[7]Rocchi R.Clinical utility of autoantibodies directed against TSHR[J].Medical Laboratory Observer,2005,37(4):10-11,14-15,16-17.
[8]Burman KD,Baker JR.Immune mechanisms in Graves’disease[J].Endocr Rev,1985,6(2):183-232.
[9]Abe Y.A poptosis in the pathogenesis of autoimmune thyroid disease[J].N ippon R insho,1999,57(5):1717-1722.
[10]杨兰,曾建业,李山.Graves病相关易感因素的研究进展[J].内科,2009,4(1):78-80。
[11]何剑峰,吴中耀,杨华胜,等.TSHr在Graves眼病患者眼眶脂肪细胞中的表达[J].中国实用眼科杂志,2005,23(11):1173-1175.
[12]梁军,高聆,盛燕,等.TSHR基因上新发现SNP及其在GD致病中的评价[J].医学研究杂志,2007,36(5):30-33.