牛睾丸原代细胞的培养技术与大容量批量冻存试验
向 敏,陈志华,高其双,黄海军,陶弼菲,占才耀,王连芳,李 杰
(湖北省武汉市畜牧兽医科学研究所,湖北 武汉 430065)
牛睾丸原代细胞是目前生产细胞型猪瘟弱毒疫苗的最主要细胞源。全国每年用于生产猪瘟弱毒疫苗的牛睾丸约为70万对,但牛的产仔具有相对严格的季节性,且同一个牛场每天的睾丸产量是极其有限的。这给疫苗生产厂家批量收集睾丸以及调剂生产周期等方面带来了困难。另外,经常不断的从外界送入生鲜睾丸组织,增加了药品生产质量管理规范(GMP)车间的污染频率,因此,进入GMP车间用于生产猪瘟疫苗的牛睾丸细胞最好是经检测无污染并能产出高效价病毒的合格细胞。但是,牛睾丸细胞传代次数是有限的。统计数据表明,牛睾丸细胞接种猪瘟病毒只适合传5代次[1]。很明显,以现有的冻存管冻存技术冻存牛睾丸细胞等待检测结果,再将其解冻用于大容量转瓶培养是不可能的,只有采取大容量批量冻存技术建立可靠的健康牛睾丸原代细胞贮备库才可以做到这一点,目前,国内外尚无类似的成熟技术。本试验从传统制作方法的改进,胰酶的消化以及大容量批量冻存等方面改进牛睾丸细胞的原代培养技术,为研究猪瘟细胞型弱毒疫苗的规范化生产,提供技术参考。
1 材料与方法
1.1 试验试剂 Hank′s液:按标准配方自配。DMEM高糖培养基原液,购自北京清大天一科技有限公司,原液按使用说明书配制,另加入10%血清即成为DMEM高糖工作液。细胞冻存液由45%DMEM原液、45%新生牛血清、10%DMSO混合均匀制得。分别装入200mL血清袋中,8KGY剂量下辐照5h,-20℃冻存备用。
1.2 牛睾丸的采集 刚出生的奶公牛,运入洁净手术室,按照常规操作快速将阴囊皮肤环切,同时切断皮下筋膜、附睾、血管等组织,用一根细绳在术者两手手指尖离切口约1cm处结扎,用浸满碘酊的棉花条沿切口向后将整个阴囊包裹,装入采样袋中,放入装有冰袋的泡沫箱内存放备用。
1.3 原代细胞制作
1.3.1 试验设计 选择3对牛睾丸作为试验对象,分别用含有Hank′s液的2.5%胰蛋白酶+0.02%EDTA,5.0%胰蛋白酶+0.02%EDTA以及2.5%胰蛋白酶三种不同消化方法分离牛睾丸细胞。
1.3.2 操作方法 从样品袋中取出阴囊,在超净工作台内无菌操作,用眼科镊子夹住露于阴囊切口外的附睾或睾丸系膜组织,将睾丸放入盛有 Hank′s液的平皿中,用含有双抗的Hank′s液反复洗涤,再将睾丸放入另一干燥平皿内,用眼科剪剪去睾丸表皮,继续用含双抗的Hank′s液洗涤1~2次,将洗好的去皮睾丸称重,然后将睾丸组织剪成厚约0.2 cm的碎片,转入一个装有玻璃珠并经高温灭菌处理的抽滤瓶中,继续向抽滤瓶中加入细胞消化液直至浸没全部玻璃珠及其上放置的睾丸组织,放置于37℃水浴锅中消化30min,在超净工作台内慢慢将消化液倒出,再向瓶中加入DMEM工作液进行中和,倒去培养基,强烈振摇,使消化后的睾丸细胞充分从组织块上分离出来,再用培养基冲洗玻璃珠,洗液即成为细胞悬液,倒入细胞瓶中,放入37℃二氧化碳培养箱培养。
1.4 冻存与解冻操作 当睾丸细胞分离后,按照每3.5g睾丸组织加入200mL冻存液的标准制成细胞悬液,分装入冻存袋中,每袋200mL,将其分别放入一适当大小的泡沫箱内和铁盒内,并放入-80℃的冰箱中让其自然冻结。另取少量细胞悬液放入若干个冻存管,按照常规冻存方法作检测备用样品。
分别在细胞冻存后的第30、120、360天取部分细胞进行解冻。将泡沫箱内的细胞袋和铁盒中的细胞袋解冻离心后轻轻移入超净工作台内倒出上清液,用DMEM工作液重悬细胞,取样计数,将重悬细胞液导入10000mL的转瓶中,补加培养基至1000mL,于37℃下转瓶培养。对照组按传统方法进行解冻培养。
1.5 细胞存活率检测 细胞悬液和台盼蓝染液按1∶1(V∶V)的比例混合,染色2~3min后在倒置显微镜下用血球计数板进行细胞计数,并区分出活细胞和死细胞以计算细胞活力。
1.6 细胞贴壁率检测及细胞形态学观察 转瓶培养8h后,在转瓶显微镜下观察细胞形态并取少量培养液样品,血球计数板计数。
2 结果与分析
2.1 原代细胞 见表1。
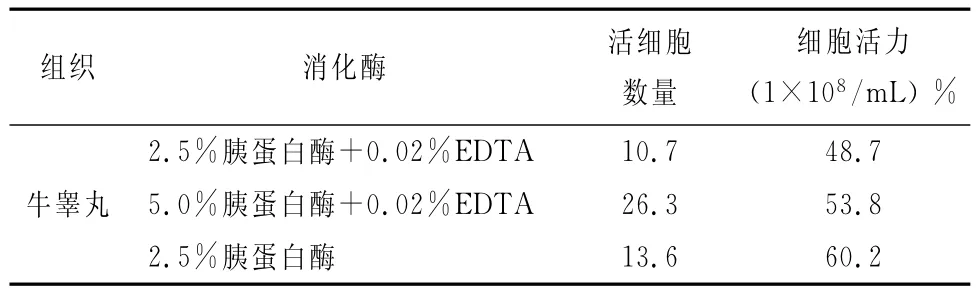
表1 牛睾丸细胞特征
从表1中可以看出,牛睾丸细胞经2.5%胰蛋白酶消化的细胞活力最高。
2.2 细胞冻存与复苏 见表2。
从表2中,我们可以看出,改良后的冻存方法特别是泡沫盒冻存和传统的冻存方法细胞复苏活力差别不大,但是,由于牛睾丸细胞传代次数的限制性,我们最终选用泡沫箱冻存。
2.3 细胞生长 细胞经转瓶培养8h后,均已贴壁完好,部分细胞已开始拉伸变长,24h后,细胞已全部变成成纤维细胞样,个别未分散的细胞团则呈岛状生长,向周边呈放射状生长出纤维样细胞。48h后,细胞间已基本无间隙,细胞长满瓶壁(见图1),可用于传代。
从表3中可以看出,改良后的冻存方法特别是泡沫盒冻存的细胞在转瓶培养上细胞贴壁率最高,而用传统的方法和铁盒冻存细胞在转瓶培养贴壁率上明显降低。
3 讨论

图1 复苏细胞培养48h牛睾丸细胞形态
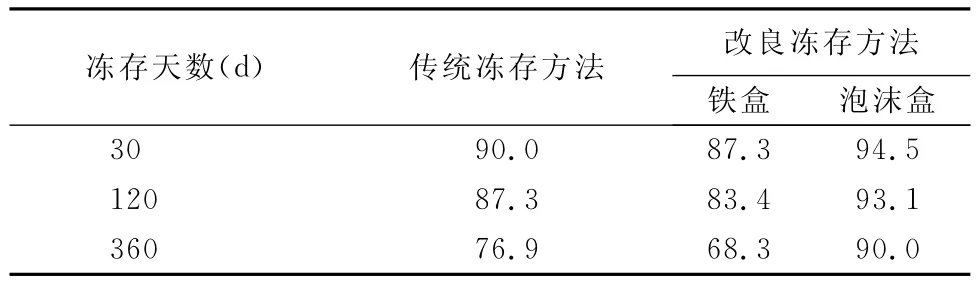
表3 复苏后细胞贴壁8 h生长率 (%)
牛睾丸原代细胞是猪瘟弱毒细胞性疫苗生产的主要细胞源,目前国内普遍采用生鲜牛睾丸,不仅采集成本高,而且对GMP车间污染的可能性以及筛选合格的睾丸组织所造成的生产资源浪费都较大,本试验将牛睾丸原代细胞进行大容量批量冻存,其解冻存活率与生鲜原代细胞无显著差异,这为建立专业化牛睾丸原代细胞贮备库提供了技术参考。
猪瘟弱毒病毒的培养采用的是牛睾丸原代细胞带毒培养技术,其最优收毒代次为3~5代,这要求细胞的起始培养单位不能太小[1],以免细胞达到工厂化生产培养单位所需的扩增代次太多。目前国内普遍采用转瓶培养技术,将原代细胞分离后直接上转瓶,因此冻存细胞每个冻存单位的细胞量必须达到一个转瓶培养所需的细胞量。本试验证明,用常规接种一个转瓶培养所需的细胞总量冻存在一个冻存容量(200mL冻存袋)中,解冻后细胞存活率、贴壁率、生长行为无显著变化[6-8],这就实现了细胞冻存与工厂化培养的直接对接。
本项试验中,牛睾丸细胞最长冻存期限仅为360d,其极限冻存时限有待进一步研究。细胞冻存温度为-80℃,而不是常规的液氮冻存,这是因为:所用的细胞冻存袋为聚乙烯类塑料,该材质在低温下易于老化,在液氮温度下,该材质还容易炸裂,因此在细胞冻存的包装材料上尚需进一步研究。
[1]沈铭强,许士杰,沈青,等.猪瘟牛睾丸细胞疫苗生产经验点滴[J].中国兽药杂志,2003,37(48):4-8.
[2]Sandeep G,Mayako F,Kazuo T,et al.Multipotential ability of primitive germ cells from neonatal pig testis cultured in vitro[J].Fertility and Development,2009,21:696-708.
[3]马志宏,党 岩,苟想珍,等.羊肾原代细胞的冷冻保存试验[J].甘肃畜牧兽医,2009,39(6):64-68.
[4]张东辉,许永华,钟近洁,等.体外培养小鼠,大鼠,猪和人原代细胞的方法[J].中国比较医学杂志,2006,16(9):78-82.
[5]付勇,潘松,刘强,等.胚胎大鼠神经干细胞的冷冻及复苏[J].临床耳鼻咽喉头颈外科杂志,2010,24(7):45-49.
[6]Kubota H,Avrbekm R,Brinsterr L.Growth factors essential for self-renewal and expansion of mouse spermatogonial stem cells[J].Proc Natl Acad Sci USA,2004,101:16489-16494.
[7]Baust J M ,Voel M J,Van B R,et al.A moleeular basis of crpopreservation failure and its modulation to impm le cell survival[J].Cell Transplant,2001,10(7):561-571.
[8]肖小君,秦沽,李碧春,等.鸡胚成纤维细胞的冷冻保存[J].甘肃畜牧兽医,2003,33(5):5-7.

