猪A组轮状病毒pW425et-Vp4基因工程乳酸菌的构建及表达
叶丽萍,王春玲,王春凤
(1.吉林农业大学动物科学技术学院,吉林 长春 130118;2.吉林省永吉县畜牧局黄榆乡畜牧站,吉林 永吉 132223)
乳酸菌为人及动物体内正常菌群的重要成员,主要定植在黏膜表面,刺激机体的免疫系统对调整菌群平衡起重要作用。乳酸菌能刺激机体SIgA的细胞增殖,使SIgA水平上升,从而使机体对RV产生免疫应答,缓和RV引起的腹泻。乳酸菌已作为一种新型表达系统成功表达了多种外源基因,但由于乳酸菌属革兰阳性菌,应用氯化钙转化法所获得的转化子较少,转化效率较低,而用电转化方法可使细菌转化效率达到109~1010转化子/μg闭环DNA[1]。本文以嗜酸乳杆菌作为受体菌株,将猪源A组轮状病毒pW425et-Vp4重组质粒电转化入嗜酸乳杆菌,对影响电转化效率的各因素进行研究,确立提高转化效率的最佳条件,并对pW425et-Vp4乳酸菌进行反应原性分析,为猪源A组轮状病毒Vp4基因工程乳酸菌疫苗的大量制备及应用奠定基础。
1 材料与方法
1.1 菌株和质粒 嗜酸乳杆菌,为本实验室保存;猪源A组轮状病毒pW425et-Vp4重组质粒,为大肠杆菌-乳酸菌穿梭质粒由本人构建。
1.2 试剂 MRS液体培养基用冰醋酸调pH值至6.0~6.2,115℃高压灭菌20min;取100mL MRS液体培养基加入2%~3%琼脂粉,115℃高压灭菌20min制备 MRS固体培养基;PBS缓冲液用HCl调pH值至7.4,加水定容至1L,高压灭菌20min,室温保存;PEB电击缓冲液115℃高压灭菌保存。轮状病毒兔抗猪多克隆抗体由吉林农业大学预防兽医学实验室研制保存;辣根过氧化物酶标记羊抗兔IgG,购自宝生物工程(大连)有限公司;SalⅠ、KpnⅠ、核酸分子量标准为TaKaRa公司产品;琼脂糖为Spanish公司产品;PVDF转移膜为Gleman公司产品。
1.3 感受态细胞的制备 MRS培养平板上挑取单个嗜酸乳杆菌菌落接种于5mL MRS液体培养基中,37℃静置厌氧过夜培养;过夜培养物以2%接种量接入20mL MRS培养液中,同时分别加入1%甘氨酸或0.3mol/L蔗糖或1%甘氨酸+0.3mol/L蔗糖;37℃静置厌氧培养4h左右,摸索乳酸菌不同生长时期及培养基成分对电转化效率的影响;将生长到最佳时期的乳酸菌,0℃~/min离心10min收集沉淀;冰冷的PEB电击缓冲液悬浮沉淀,0℃~/min离心5min洗细胞2次;沉淀悬浮于500 μL冰冷的电击缓冲液中,备用。
1.4 pW425et-Vp4基因工程乳酸菌的构建 取5~10μL pW425et-Vp4重组质粒加入到200μL冰冷的乳酸菌感受态中混匀,冰浴5min,移入预冷的电击杯中(内径0.2cm),冰上静止5min,优化电场强度及脉冲时间。根据最适条件释放脉冲,电击。将电击混合物移入新的预冷的Eppendorf管中,冰浴5min,加入500μL含0.3mol/mL蔗糖的MRS培养基,37℃静置厌氧培养3~4h,取50μL培养物涂布含有红霉素的MRS平板,37℃静置厌氧培养48h,计数转化子数目,每项条件优化做3次重复试验。
1.5 乳酸菌重组质粒的鉴定与表达 电转化后的重组质粒单菌落接种入5mL含红霉素的MRS液体培养基中,37℃静置厌氧培养12h,按O′Sullivan等[2]的方法进行乳酸菌重组质粒的提取。经PCR、酶切鉴定的阳性质粒的单菌落接种入100mL含红霉素(100μg/mL)的 MRS液体培养基中,37℃静置厌氧培养至OD600为0.60~0.80,每隔1h取1次菌液,取至7h。以同样的方法诱导含空载体pW425et的乳酸菌作对照。将各个时间诱导收获的菌液OD600均调至0.60~0.80,取菌液1.4mL,1200r/min离心5min,弃上清。沉淀中加入50 μL电泳液,1×SDS上样缓冲液50μL(其中含1/10的DTT),沸水煮10min,25℃12000r/min离心10min,按《分子克隆实验指南》第2版方法进行8%SDS-PAGE凝胶电泳及Western-blot分析。
2 结果
2.1 pW425et-Vp4基因工程乳酸菌构建条件的优化
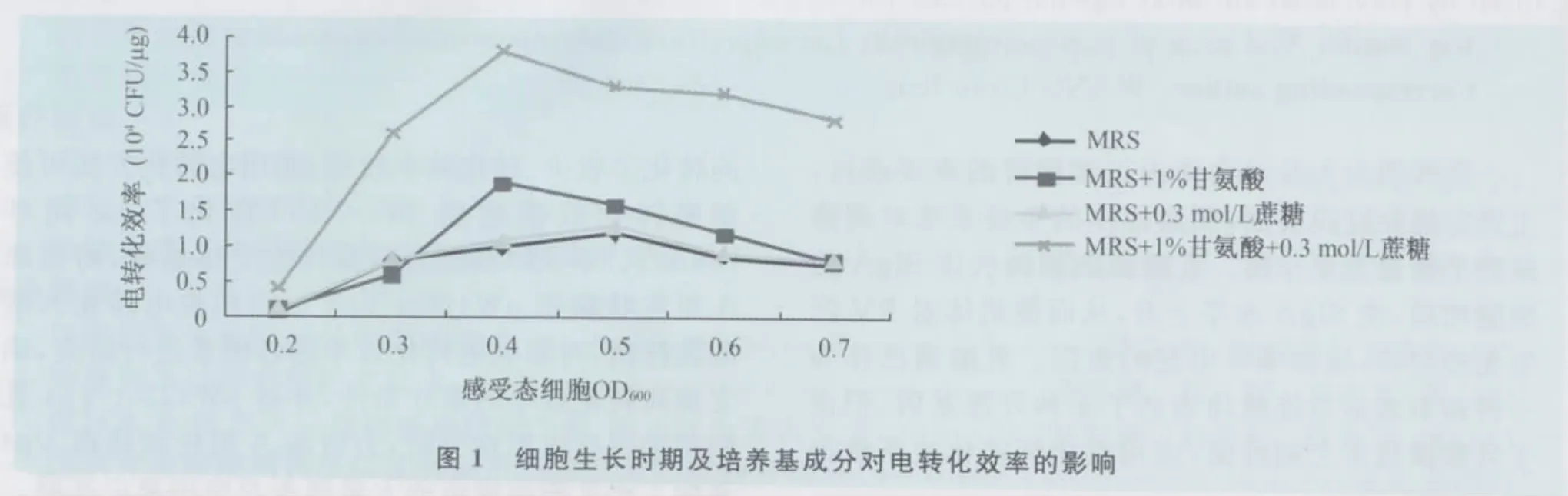
2.1.1 细胞生长时期及培养基成分对转化效率的影响 固定电场强度为11kV/cm,脉冲时间为3.8 ms,细胞的不同生长时期,培养基的不同成分对重组质粒电转化效率的影响结果如图1所示。当感受态细胞的OD600值为0.4时,各试验组的转化效率均达到了最高值,之后有所下降,所以感受态的最佳生长时期为0.4。在MRS培养基中加入1%甘氨酸组及加入1%甘氨酸+0.3mol/L蔗糖组的转化效率较MRS组有所提高,且后者更有利于提高电转化效率,达3.8×104CFU/μg DNA,但加入0.3 mol/L蔗糖组转化效率较MRS组无明显变化。
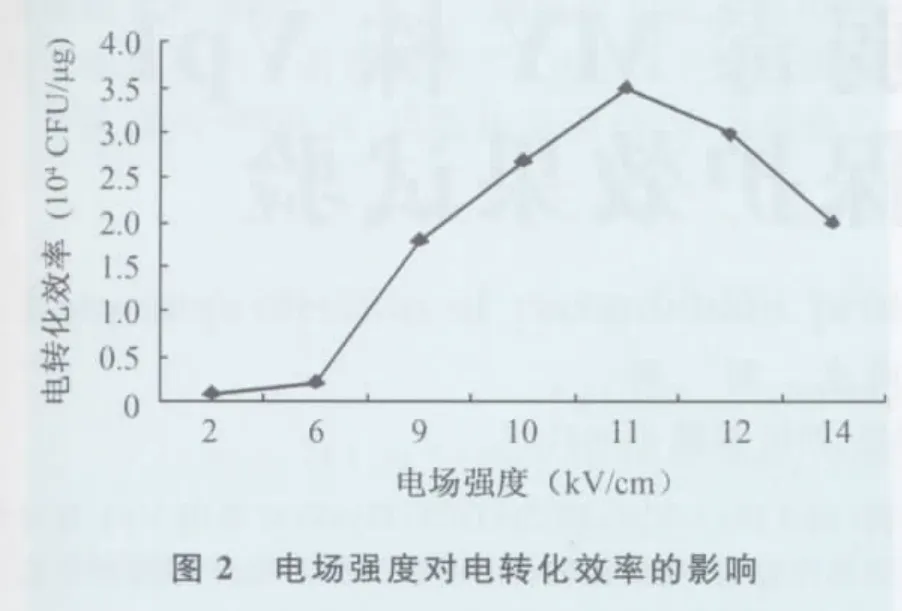
2.1.2 电场强度对转化效率的影响 固定脉冲时间为3.8ms,改变电场强度进行重组质粒电转化,转化效率随电场强度的增加而增加,于11kV/cm时达到最大,随后随着电场强度的增加转化效率下降(图2)。
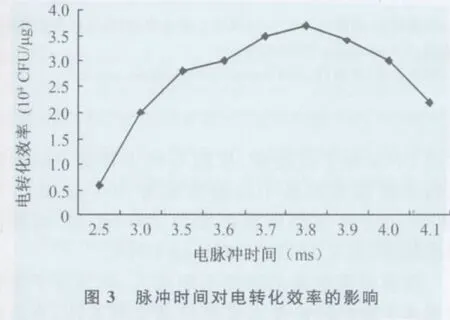
2.3 脉冲时间对转化效率的影响 脉冲时间的长短直接影响电转化效率,脉冲时间太短不能使DNA分子有效进入细胞,而脉冲时间过长,细胞生存率又降低[3]。固定电场强度为11kV/cm,脉冲时间在3.5~3.9ms区间转化效率较高,且于3.8ms时达到最高,随后有所下降(图3)。
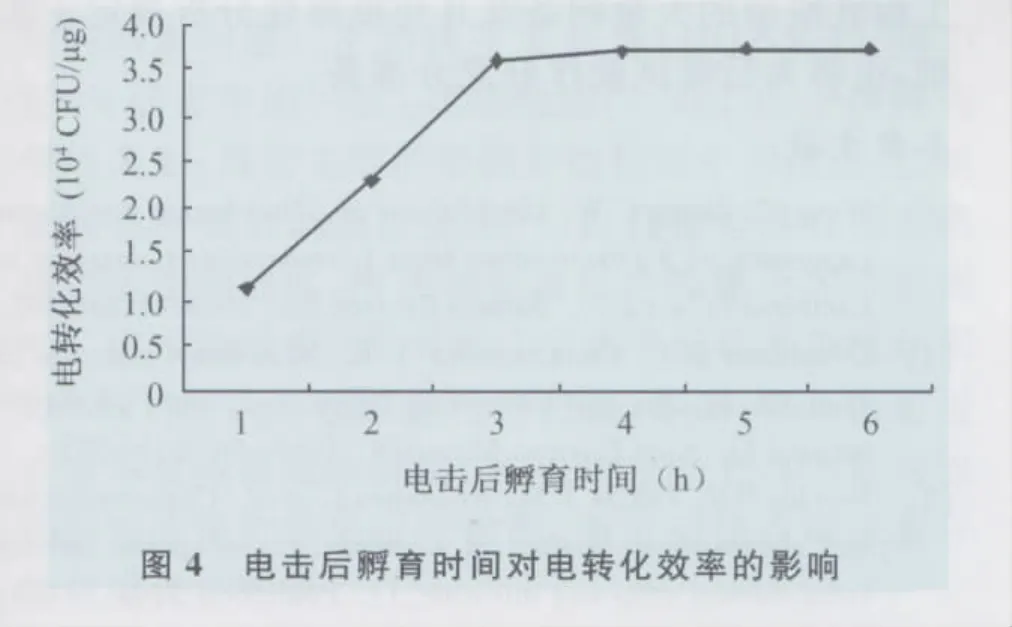
2.4 电击后孵育时间对转化效率的影响 电击使细胞膜产生孔洞,所以电击后细胞要进行一段时间的复苏使孔洞复原。固定电场强度为11kV/cm,脉冲时间为3.8ms,进行重组质粒的电转化。电击后不同的孵育时间对转化效率的影响结果如图4所示,细胞复苏3~4h,才能有较好的转化效率,4h以后转化效率提高不明显。所以试验选择复苏3~4h。
2.5 pW425et-Vp4基因工程乳酸菌的鉴定与表达
2.5.1 乳酸菌重组质粒的酶切鉴定 将乳酸菌重组质粒提取鉴定疑似含有目的片段的1号菌质粒进行SalⅠ和KpnⅠ酶切鉴定。结果获得两条片段,大片段约为~bp,小片段约为~bp,表明疑似菌株中的重组质粒中含有外源基因Vp4,为阳性克隆,见图5。
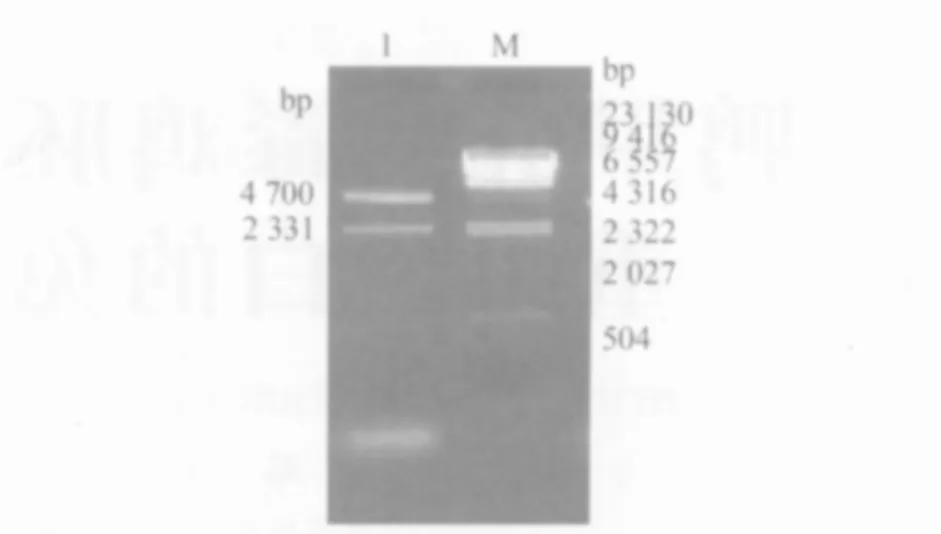
图5 重组质粒酶切鉴定
2.5.2 乳酸菌重组质粒的PCR鉴定 以1号菌的质粒为模板,进行PCR鉴定,扩出与预期大小相符的目的条带,见图6。
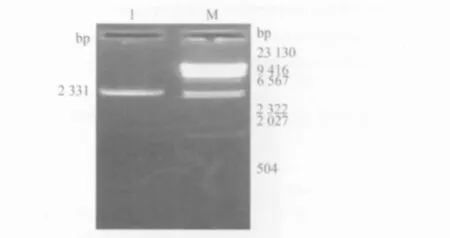
图6 重组质粒PCR鉴定
2.5.3 SDS-PAGE分析 分析上述经过鉴定为阳性的克隆菌株1各时间的表达情况。由图7可见Vp4基因获得了表达,蛋白质的相对分子量约为87 ku的融合蛋白,与预期Vp4蛋白的分子量一致,而空载体pW425et在乳酸菌受体菌株中则未见该蛋白质表达。
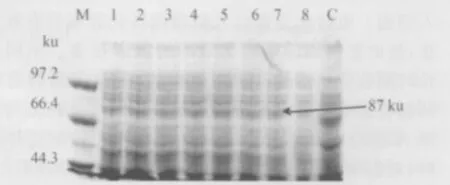
图7 SDS-PAGE电泳检测Vp4基因在乳酸菌中的表达产物
2.5.4 Western-blot分析 表达产物经SDSPAGE后,电转移至PVDF转移膜上,进行蛋白印迹分析,其结果见图8。从图中可见87.0ku处有一条明显的蛋白印迹带,说明pW425et-Vp4乳酸菌重组质粒表达蛋白可与猪轮状病毒多克隆抗体反应。

图8 重组质粒pW425et-Vp4乳酸菌表达产物的Western-blot分析
3 讨论
电转化(Electro-transformation)是利用瞬间高压打击细胞膜,使之形成孔洞,使DNA分子得以进入细胞。电转化是提高乳酸菌的转化效率的有效方法,然而影响细菌电转化效率的因素很多。不同生长时期收获的细胞、电压、脉冲时间、电击后孵育时间都将影响电转化效率的高低。以嗜酸乳杆菌为猪源A组轮状病毒pW425et-Vp4重组质粒的受体菌株,对影响电转化的因素进行了研究,结果表明,当感受态细胞的OD600值于0.4时,在MRS培养基中加入1%甘氨酸+0.3mol/L蔗糖,电场强度为11kV/cm,脉冲时间为3.8ms,电击后细胞复苏3~4h时,得到较高的转化效率,最高可达3.8×104CFU/μg DNA。此外,抗生素浓度、质粒DNA浓度、不同的缓冲液的高低也影响电转化效率。抗生素浓度过低不能保证转化子的可靠性起不到筛选作用,而浓度过高则会抑制转化子的生长。DNA分子太少不足以产生高转化效率,而浓度过高,细胞能吸收的DNA分子过饱和,反而不利于转化。试验结果确定红霉素的最小抑制浓度为100μg/mL,当pW425et-Vp4重组质粒浓度为200ng/μL时转化效率最高,达3.1×104CFU/μg DNA。
随着对乳酸菌的研究不断深入,作为分子生物学基本手段的转化技术也将日益受到关注,目前已经在某些乳酸菌中成功表达了一系列的外源蛋白[4-5]。可以说以乳酸菌作为表达外源保护性抗原基因的受体菌株,就可以将乳酸菌的生物学功能和外源功能抗原基因的特异性免疫相结合,所以应用乳酸菌携带外源基因作为黏膜免疫的口服疫苗将具有良好的应用前景。pW425et-Vp4乳酸菌阳性克隆经Western-blot分析表明,其蛋白具有与轮状病毒多克隆抗体的反应原性,这为pW425et-Vp4基因工程乳酸菌的大量制备及其免疫原性分析奠定了基础,也将为后续试验作好充分准备。
[1]Wang C,Zhang C W,Liu H C,et al.Non-fusion and fusion expression ofβ-galactosidase from Lactobacillus bulgaricus in Lactococcus lactis[J].Biomed Environ Sci,2008,21:389-397.
[2]O’sullivan D J,Klaenhammer T R.Mini-Prop Isolation of High-Quality Plasmid DNA from Lactococcus and Lactobacillus spp[J].Appl Environ Microbiol,1993,59:2730-2733.
[3]Beasldy S S,Takala T M,Reunanen J,et al.Characterization and electrotransformation of Lactobacillus crispatus isolated from chicken crop and intestine[J].Poult Sci,2004,83(1):45-48.
[4]Martin M,Gutierrez J,Criado R,et al.Cloning,production and expression of the bacteriocin enterocin a produced by Enterococcus faecium PLBC21in Lactococcus lactis[J].Appl Microbiol Biotechnol,2007,76:667-675.
[5]Kim Y H,Han K S,Oh S,et al.Optimization of technical conditions for the transformation of Lactobacillus acidophilus strains by electroporation[J].J Appl Microbiol,2005,99:167-174.

