FISH痰脱落细胞检查诊断肺癌的价值
王 飞,孟 涛,杨 佳,穆朝东
(新疆医科大学附属肿瘤医院,乌鲁木齐830011)
胸片、CT及痰细胞学检查为目前肺癌早期的主要筛查手段,但特异性及敏感性均较低[1~3],早期漏诊率高;而大部分肺癌患者就诊时病情已发展到晚期,病死率高[4]。荧光原位杂交(Fluorescence in situ hybridization,FISH)是近年发展起来的一项新技术,其可迅速检测出中期分裂相/间期核细胞中染色体数目等异常变化,为肺癌的遗传学研究提供了新方法[5]。近期国内已有将FISH技术应用于肺癌检测的相关报道,但多数是利用支气管镜取样,而用于痰脱落细胞的报道较少。2009年4月~2011年10月,我们采用双色FISH技术检测了60例初诊疑似肺癌患者痰液中脱落细胞3、7、17染色体和9号染色体P16位点异常情况,并以组织病理确诊为肺癌为金标准,探讨FISH技术在肺癌诊断中的应用价值。
1 资料与方法
1.1 临床资料 60例初诊疑似肺癌患者,男42例,女18例;年龄46~76岁,中位年龄63岁。长期吸烟35例,有慢性咳嗽咳痰病史47例。经病理或细胞学检查诊断证实为肺癌43例(肺癌组),其中鳞癌26例、小细胞肺癌6例、腺癌11例;TNM分期Ⅰ~Ⅱ期(早期)18例,Ⅲ~Ⅳ期(晚期)25例。肺良性病变17例(良性组),其中结核10例,肺炎7例。另选取同期20例体检健康者为对照组,年龄41~80岁,中位年龄61岁。
1.2 痰脱落细胞检查 收集三组新鲜痰液标本(取清晨漱口后深部第2、3口痰,连续3 d,留置于无菌瓶中),每例收集约20 mL,分为两等分各10 mL,分别用于FISH检测和常规痰脱落细胞学检查(常规方法)。
1.2.1 FISH检测 10 mL中痰液加入5~10 mL的痰液消化液,摇匀,放置10~20 min,1 500 r/min离心10 min后去上清,加入5 mL在37℃预热的胶原酶B,37℃水浴35 min,期间吹打悬浮细胞5~6次。1 500 r/min离心10 min后去上清,加入5 mL 37℃预热的0.075 mol/L的KCl低渗液,重新吹打悬浮细胞,37℃水浴低渗30 min,期间吹打5~6次。加入固定液2 mL(甲醇∶冰醋酸为3∶1),混匀,1 500 r/min离心10 min后去上清。室温下缓慢加入5 mL新的固定液重新悬浮细胞,室温下放置10 min,1 500 r/min离心悬液10 min后去上清到原来体积的1/20~1/50(留0.5~1 mL)。将悬液静置10 min,用移液枪滴加15~25μL细胞悬液至3~4片玻片上,自然晾干。56℃环境中老化玻片30 min或室温下过夜老化玻片。将样本片子放入2×标准柠檬酸盐溶液(SSC)溶液中漂洗2次,每次5 min。0.1 mol/L HCl溶液中浸泡10 min;将片子放入已经预热至37℃的胃蛋白酶工作液中,消化10 min。2×SSC室温下清洗2次,每次5 min。将片子放入快速固定液(39 mL的2×SSC,1 mL的甲醛)室温中,固定10 min。将片子依次置于70%、85%、100%的乙醇各脱水2 min。取出后,自然干燥玻片。干燥后的玻片加热至56℃。在片子上将10μL的混合探针加到一个反应区,将盖玻片立刻覆盖反应区,使探针溶液弥漫整个覆盖区。用树胶封固,将封好的片子放入预热的湿盒中,于76℃水浴箱中高温变性5.5 min,取出后放入提前温育在42℃的杂交盒中,过夜放置。将杂交后的玻片取出,揭掉表面的封口胶,将玻片放入2×SSC溶液中反复清洗,洗去盖片后开始玻片洗涤。将玻片放入40 mL 67℃ 0.3%NP-40/0.4×SSC溶液中洗涤2 min。室温下在40 mL 0.1%NP-40/2×SSC溶液中洗涤30 s。玻片置于室温的70%乙醇中洗涤3 min。取出后在暗处风干,烤片机上56℃烤片3~5 min,滴加15μL DAPI于样本区,盖上盖片,避光保存15~20 min。
1.2.2 对照组痰脱落细胞染色体数目畸变的阈值(畸变率)检测 应用日本OLYMPUS2BX51型荧光显微镜,图像分析系统采用俄罗斯Video Test公司FISH2.0分析软件。对采集的20例正常人痰液每组探针组合分析100个细胞。统计出现不同异常情况的百分比,阈值=平均数(M)+3×标准差(SD),3、7、17号染色体探针各需要建立2个阈值(1个点、≥3个点),9p16探针需要建立3个阈值(0、1、≥3个点)。任意≥2个位点出现异常,如3号和17号染色体出现非整倍增加,可判断为阳性;一个位点有≥2种异常,如9p16有0信号点异常和3信号点异常,也可判断为阳性。若只有一个位点出现一种异常,扩大计数细胞后再重新判断。统计信号种类及与之相对应细胞数目百分比并录入图像分析仪。在镜下观察杂交效果,以细胞杂交率>80%为有效标本。细胞核膜须完整,在细胞核内可见清晰明亮的橘红色或黄绿色荧光信号,如出现2个或3个荧光点,两个位点之间距离大于单个信号的直径以上,且荧光强度相近,计为含有2条或3条染色体。如果两个信号之间的距离<1个信号的直径则计数为1条染色体。
1.2.3 疑似肺癌患者染色体畸变 以20例正常人痰脱落细胞染色体数目畸变的阈值(畸变率)为标准,判定疑似肺癌患者染色体畸变数。每组探针均组合分析100个细胞,计算异常率,判断阳性个数。
1.2.4 常规方法检测 取10 mL痰液标本行常规方法检查,由固定的2名细胞学专家按照常规操作并判定结果。以病理检查结果为金标准,对FISH、常规方法及二者联合检查诊断肺癌的价值进行分析。
1.3 统计学方法 采用SPSS12.0统计软件,实验数据以百分比表示,采用独立样本t检验、χ2检验,P≤0.05为差异有统计学意义。
2 结果
2.1 20例正常人痰脱落细胞染色体数目畸变的阈值(畸变率) 见表1。
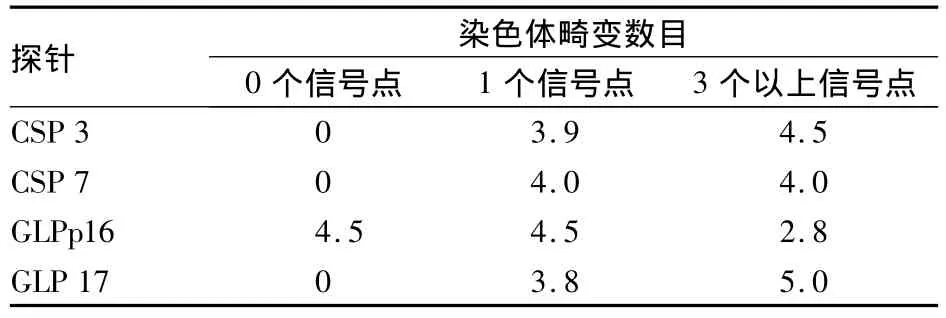
表1 20例正常人痰脱落细胞染色体数目畸变率(%)
2.2 诊断价值 FISH与常规方法诊断的敏感性分别为 65.1%(28/43)、32.5%(14/43),P=0.003;特异性分别为 76.5%(13/17)、100%(17/17),P=1;联合检测的敏感性与特异性分别为72.1%(31/43)、100%(17/17),与常规方法比较,P分别 =0、1。FISH、常规方法判断TNM分期为Ⅰ~Ⅱ期的敏感性分别为55.6%(10/18)、22.2%(4/18),P=0.040;Ⅲ~Ⅳ期敏感性分别为72%(18/25)、40%(10/25),P=0.025;联合检测判断Ⅰ~Ⅱ期、Ⅲ~Ⅳ期的敏感性分别为66.7%(12/18)、76%(19/25),与常规方法比较,P 分别 =0.007、0.010;三种方法判断不同分期患者的特异性无统计学差异。
3 讨论
FISH是一种细胞遗传学与分子生物学相结合的新技术,其采用荧光素直接标记遗传物质DNA制备探针,与染色体或实体肿瘤及脱落细胞间期核进行杂交,通过荧光显微镜观察肿瘤细胞内有无染色体数目和结构的改变;可直接用于检测肺癌患者脱落细胞间期核染色体变化[6]。已有相关文献报道,利用支气管镜检刷取标本进行FISH检测可明显提高早期肺癌检出的敏感性[7,8];但支气管镜具有一定创伤性。用FISH技术对痰标本行肺癌高危人群筛查,以期对肺癌的发生进行早期干预是目前研究的热点。近年来国内外关于FISH检测痰脱落细胞诊断肺癌的报道较少,且结论差异较大[9,10]。本研究FISH结果显示,3,7,17号染色体和9号染色体p16在肺癌组与良性组均发生一定数目的畸变,说明染色体畸变在肺癌发生、发展过程中起重要作用。
本研究结果显示,FISH联合常规方法检测诊断肺癌的敏感性为72.1%,明显高于常规方法,但特异性无统计学差异。Voss等[11]报道,通过支气管镜检查疑似肺癌患者得到刷检样本,FISH及联合方法诊断肺癌的敏感性明显高于常规方法,特异性无统计学差异,与本研究结果一致。Varella-Garcia等[12]报道,多色荧光原位杂交技术联合常规方法检测诊断肺癌的敏感性明显高于常规方法。而痰液标本取材容易,无创伤性,有助于推动FISH技术的临床应用。
综上所述,FISH行痰脱落细胞检测诊断肺癌的敏感性高,与常规方法联合应用能显著提高准确率。但FISH检测费用较昂贵,操作相对复杂,目前尚不能取代常规方法。
[1]Markowitz SB,Miller A,Miller J,et al.Ability of low-dose helical CT to distinguish between benign and malignant noncalcified lung nodules[J].Chest,2007,131(4):1028-1034.
[2]Midthun DE,Jett JR.Update on screening for lung cancer[J].Semin Respir Crit Care Med,2008,29(3):233-240.
[3]Bach PB,Kelley MJ,Ramsey CT,et al.Screening for lung cancer:a review of the current literature[J].Chest,2003,123(1suppl):72S-82S.
[4]Jemal A,Siegel R,Ward E,et al.Cancer statistics[J].CA Cancer JClin,2009,59(4):225-249.
[5]Varella-Garcia M,Kittelson J,Schulte AP,et al.Multi-target interphase fluorescence in situ hybridization assay increases sensitivity of sputum cytology as a predictor of lung cancer[J].Cancer Detect Prev,2004,28(4):244-251.
[6]Halling KC,Kipp BR.Fluorescence in situ hybridization in diagnostic cytology[J].Hum Pathol,2007,38(8):1137-1144.
[7]Halling KC,Rickman OB,Kipp BR,et al.A comparison of cytology and fluorescence in situ hybridization for the detection of lung cancer in bronchoscopic specimens[J].Chest,2006,130(3):694-701.
[8]Voss JS,Kipp BR,Halling KC,et al.Fluorescence in situ hybridization testing algorithm improves lung cancer detection in bronchial brushing specimens[J].Am J Respir Crit Care Med,2010,181(5):478-485.
[9]Kennedy TC,Miller Y,Prindiville S.Screening for lung cancer revisited and the role of sputum cytology and fluorescence bronchoscopy in a high-risk group[J].Chest,2000,117(4 Suppl 1):72S-79S.
[10]贾东辉,张智慧,刘树范,等.荧光原位杂交技术在肺癌痰细胞学诊断中的应用[J].中华肿瘤杂志,2000,22(6):477-480.
[11]Voss JS,Kipp BR,Halling KC,et al.Fluorescence in situ hybridization testing algorithm improves lung cancer detection in bronchial brushing specimens[J].Am J Respir Crit Care Med,2010,181(5):478-485.
[12]Varella-Garcia M,Kittelson J,Schulte AP,et al.Multi-target interphase fluorescence in situ hybridization assay increases sensitivity of sputum cytology as a predictor of lung cancer[J].Cancer Detect Prev,2004,28(4):244-251.

