新的杂合肽抗肿瘤血管生成的作用机制
孙 波 周 悦 刘红建 周庆伟 (吉林大学药学院,吉林 长春 3002)
目前对肿瘤患者常见的化疗和放疗手段往往导致严重的副作用,因此寻找高效、低毒的抗肿瘤新药是近几年来研究的热点之一。小分子多肽广泛存在自然界,并可通过人工方法合成,由于其具有分子量小、活性高、毒性低等特点〔1〕。这些肿瘤抑制肽主要是通过直接抑制肿瘤生长作用、抑制肿瘤新生血管生成、激活机体免疫系统,从而发挥抗肿瘤作用〔3~5〕,在肿瘤的临床治疗上有重要价值。本研究基于目前国内外研究进展,设计、合成新的杂合肽是由血小板反应蛋白-1和血管抑素的血管生成抑制同源区域以串联方式连接而成的。通过体内外实验观察,证实了新的杂合肽具有明显抑制Lewis肿瘤细胞的增殖、迁移,在体内能够抑制碱烧伤后兔角膜新生血管以及对C57BL/6N纯系小鼠肿瘤血管生成的抑制作用,并在细胞水平和整体水平上研究结果具有一定相关性。
1 材料与方法
1.1 材料 C57BL/6N及新西兰大白兔雌雄各半(由吉林大学白求恩医学院动物实验中心提供);细胞株(上海细胞研究所提供),IMDM培养基、新生胎牛血清(美国GIBCO公司);细胞株(上海细胞研究所);IMDM培养基、新生胎牛血清(美国GIBCO公司);多肽合成仪ACT90(日本ACT公司);Flash中压纯化系统(Biotaga SPI,美国);制备型高效液相色谱仪(Waters Delta Prep400,美国Waters公司);质谱仪电喷雾质谱(FINNIGANMATLCQ,美国 FINNIGAN公司);冷冻干燥机(德国CHRIST公司);裂隙灯、二氧化碳孵箱(日本SANYO公司)。
1.2 方法
1.2.1 体外抗肿瘤细胞增殖活性测试 Lewis肿瘤细胞接种在96孔板上,每孔接种1×104个细胞,在培养4~5 h后,细胞更换1%HS培养基,培养24 h,并且在同一培养基上用各自的待测样品(VEGF、SMP)培养孵育,药物浓度分别为0.45 μmol/L、0.9 μmol/L、1.8 μmol/L,对照组加入磷酸盐缓冲液(PBS),血管内皮生长因子(VEGF)终浓度为1 ng/ml,作用时间为24、48、72 h,通过比色试验测定细胞数,求出IC50值。
1.2.2 体外抗肿瘤细胞迁移活性测试 Lewis肿瘤细胞接种在直径35 mm Petri培养皿上,细胞生长聚集。在培养24 h后,使用细胞刮板作一个矩形缺损,细胞用无血清培养基冲洗3次,并且用各自的待测样品(VEGF、SMP)培养孵育,药物浓度分别为 0.45 μmol/L、0.9 μmol/L、1.8 μmol/L,对照组加入PBS,VEGF终浓度为1 ng/ml。在细胞迁移48 h后,在缺损边缘任意选择三个区域,使用10倍倒置显微镜计数细胞数。
1.2.3 兔角膜碱烧伤模型制备 将24只大白兔用浓度为3%戊巴比妥钠进行兔耳外缘侧静脉注射(1 ml/kg),将浸润1 min的1 mol/L氢氧化钠滤纸片(直径0.3 mm)置于兔左眼角膜中央10 s后取下滤纸片,然后立即用20 ml生理盐水冲洗烧伤区及结膜1 min。然后,随机分为实验(Ⅰ、Ⅱ、Ⅲ)组.角膜烧伤12 h后、对照组滴生理盐水,实验组滴不同的浓度药液20 μl,药物浓度分别为 30 μmol/次、60 μmol/次 120 μmol/次,所有兔右眼均滴生理盐水作阴性对照。3次/d,连续21 d后,用裂隙灯观察并摄影,并计算角膜新生血管生长面积(A),按公式A=C/12 ×3.1416〔r2-(r-L)2〕。
1.2.4 C57BL/6N纯系小鼠肿瘤模型制备 选用6 w龄的C57BL/6N雄性小鼠40只,体重18~22 g,每鼠在左腹股沟皮下接种0.2 ml,细胞数为5×106后。随机分为对照组、实验(Ⅰ、Ⅱ、Ⅲ)组,每组10只,接种瘤细胞后第二天开始在鼠腹股沟皮下注射给药,药物浓度分别为 30 μmol/L、60 μmol/L、120 μmol/L,每日一次,连续21 d,末次给药后24 h处死动物,取瘤块并称重,计算抑瘤率=〔1-给药组平均瘤重(T)/对照组平均瘤重(C)〕×100﹪。
1.3 统计方法方法 应用SPSS16.0统计软件进行分析,资料数据以±s表示,两样本均数比较用t检验,P<0.01为差异有显著性。
2 结果
2.1 体外抗肿瘤细胞增殖活性 在培养24 h后依浓度观察,浓度在0.45~1.8 μmol/L,衰老标记蛋白(SMP)对Lewis细胞抑制能力开始上升,到培养48 h时达到最高抑制效果,与正常对照组比较其差异有统计学显著意义(P<0.05),然后,在72 h开始下降,可见小分子杂合肽浓度与增殖抑制作用之间具有一定的时-效关系。见表1。
表1 小分子杂合肽对Lewis肿瘤细胞增殖的影响( ± s,n=5)
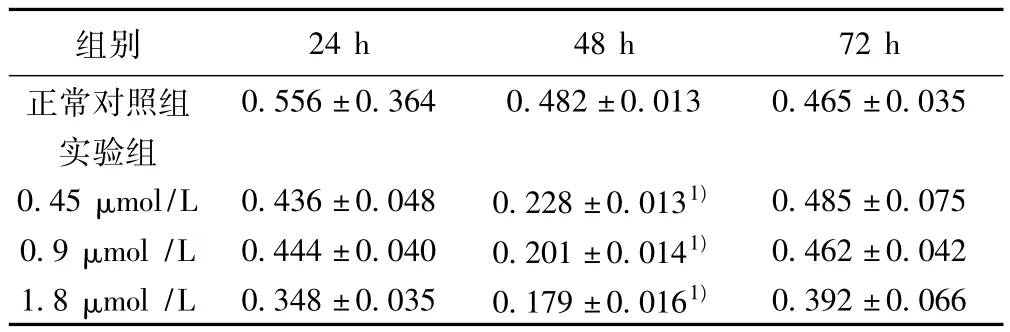
表1 小分子杂合肽对Lewis肿瘤细胞增殖的影响( ± s,n=5)
与正常对照组比较:1)P<0.01;下表同
0.556±0.364 0.482±0.013 0.465±0.035实验组0.45 μmol/L 0.436±0.048 0.228±0.0131) 0.485±0.0750.9 μmol/L 0.444±0.040 0.201±0.0141) 0.462±0.0421.8 μmol/L 0.348 ±0.035 0.179 ±0.0161)24 h 48 h 72 h正常对照组组别0.392±0.066
2.2 体外抑制肿瘤细胞迁移活性 小分子杂合肽在不同药物浓度下,能够较明显抑制Lewis肿瘤细胞迁移,并在浓度在(1.8 μmol/L)时,培养48 h抑制作用最为明显,与正常对照组比较(P﹤0.01),可见抑制细胞迁移数具有一定的剂量-依赖关系。见表2。
表2 小分子杂合肽对Lewis肿瘤细胞迁移的影响( ± s,n=3)

表2 小分子杂合肽对Lewis肿瘤细胞迁移的影响( ± s,n=3)
99.65±4.33实验组0.45 μmol/L 76.26 ±1.861)0.9 μmol/L 58.13 ±2.121)1.8 μmol/L 24.67 ±1.221)组别 细胞迁移数正常对照组
2.3 杂合肽对碱烧伤后兔角膜新生血管生成作用的影响 杂合肽药物在不同浓度剂量下,连续眼内滴药7 d,药物浓度分别在60~120 μmol/L次时,都具有较明显的抑制兔角膜新生血管作用,与正常对照组比较差异有显著性(P<0.05),并具有一定的量-效关系,但在第16天、第21天时,作用效果最为明显,与正常对照组比较有显著性差异(P<0.01)。镜下观察,角膜水肿减轻,新生血管细小、稀疏,多集中于上、下角膜缘,呈缓慢性生长,其作用靶点可能为血管内皮细胞。从而抑制兔角膜新生血管。见表3。
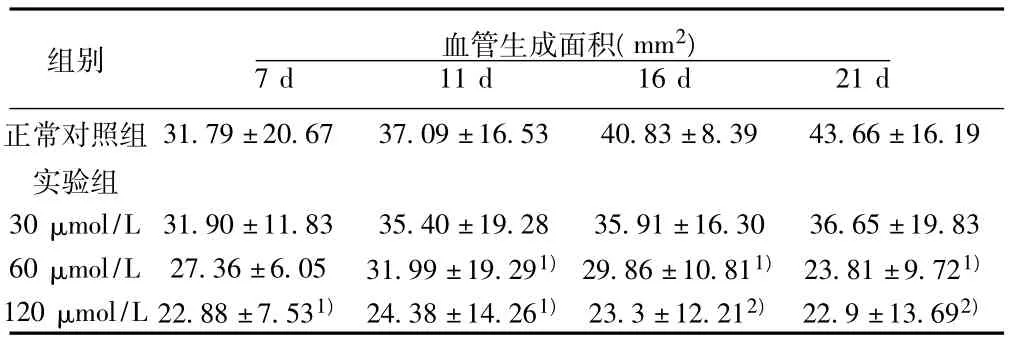
表3 不同时间小分子杂合肽对碱烧伤后兔角膜新生血管生成的影响(x ±s,n=6,mm2)
2.4 小分子杂合肽对C57BL/6N荷瘤鼠肿瘤抑制作用 在肿瘤小鼠瘤边处连续注射给药21 d,药物浓度为60~120 μmol/L时,杂合肽抑瘤效果特别明显,与正常对照组比较差异有显著性意义(P<0.01),其抑制率为73.5%,其直接作用靶点可能为新生血管内皮细胞,使实体瘤无法获得足够的营养,从而抑制肿瘤的生长。见表4。
表4 小分子杂合肽对C57BL/6N肿瘤小鼠的抑制作用( ± s,n=10)
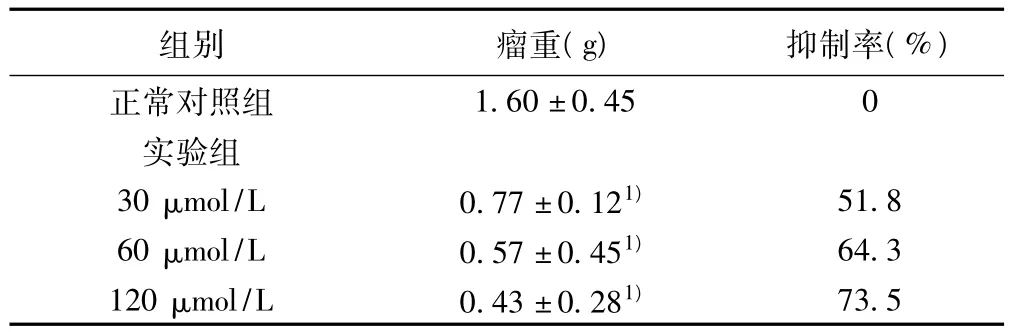
表4 小分子杂合肽对C57BL/6N肿瘤小鼠的抑制作用( ± s,n=10)
组别 瘤重(g) 抑制率(%)1.60±0.45 0实验组30 μmol/L 0.77 ±0.121) 51.860 μmol/L 0.57 ±0.451) 64.3120 μmol/L 0.43 ±0.281)正常对照组73.5
3 讨论
在肿瘤治疗中,尽管传统的放、化疗已取得了很大进展,但由于其在杀伤肿瘤细胞同时,也对人体产生不同程度的不良反应,其中主要是骨髓抑制、免疫功能低下和肿瘤多药耐药。天然生物活性肽是一类存在动物、植物、微生物等生物体内经特殊提取分离工艺能直接得到的一类生物活性肽其中有一些在体内或体外实验中具有显著抗肿瘤作用〔5〕。近年来,国内外研究者试图从天然物质中获取具有单一活性抗肿瘤多肽,已克服现有药物不良反应及肿瘤耐药性。与传统的化疗和放疗相比,天然抗肿瘤活性多肽最大优点在于分子量小、活性高、不良反应小、易于多途径吸收、不易产生耐药性。它们可针对肿瘤细胞发生、发展的不同环节,特异性杀伤、抑制肿瘤细胞,显示出极好的应用前景。基于目前血管生成肽研究进展,本研究设计并合成的小分子杂合肽通过建立Lewis肺癌皮下移植瘤及碱烧伤后兔角膜新生血管模型来探讨小分子肽对新生血管的抑制作用。研究显示,在瘤体边缘每天注射小分子杂合肽及兔角膜眼内滴药浓度在120 μmol/L,并连续给药21 d,能明显抑制碱烧伤后兔角膜及肿瘤新生血管生成,使瘤体明显缩小,抑制率为73.5%,与对照组比较有显著性差异(P<0.05),抑瘤效应随着药物剂量的增加抑制率逐渐增大,结果证实了新的杂合肽抑制肿瘤血管退化同时,可以引起瘤体的消退,使肿瘤体积明显缩小,体重外周血白细胞数量及未见明显变化,无异常反应及死亡。结果提示,新的杂合肽是一种安全、有效、无毒副作用的血管生成抑制剂。
有研究表明,大部分治疗肿瘤药物的作用靶点为肿瘤细胞,一个突出的问题既产生耐药性。而内皮细胞具有一套正常的、完整的染色体,具有稳定的遗传性,因而通过血管生成抑制因子治疗肿瘤不易产生耐药性〔6〕。内皮细胞是血管形成的首要步骤,抑制内皮细胞增殖,也就有效的抑制血管的形成。针对血管内皮细胞这一特点,本文通过体外实验进一步研究新的杂合肽对血管内皮细胞增殖及迁移活性的影响,结果表明,新的杂合肽能明显抑制Lewis肿瘤细胞的增殖及迁移,当浓度为1.8 μmol/L并作用48 h时,肿瘤细胞增殖、迁移明显被抑制,与正常对照组比较有显著性差异(P<0.01),此结果证实了新的杂合肽可能直接作用与运动的及增殖的血管内皮细胞,在48 h作用最明显。体外实验结果对此已证实。并且,在细胞水平和整体水平上,实验结果上具有一定相关性,其作用机制可能直接作用靶点为新生血管内皮细胞。使实体瘤无法获得足够的氧和营养物质,来抑制肿瘤血管生成,使肿瘤处于无血管期,从而抑制肿瘤的生长。本文中新的杂合肽有望成为一种高效、低毒,易得的抗肿瘤血管生成抑制剂。
1 陈贯虹,迟建国,邱维忠,等.多肽药物研究进展〔J〕.山东科学,2008;21(3):42-8.
2 巢警役,张 岚,杜 娟.生物活性肽的研究进展〔J〕.吉林医药学院学报,2010;31(6):359-62.
3 Simmons TL,Andrianasolo E,McPhail K,et al.Marinenatural products as anticancer drugs〔J〕.Mol Cancer Ther,2005;4(2):333-42.
4 徐桂华,毕力夫,苏秀兰.抗肿瘤生物活性肽研究进展〔J〕.中国医药生物技术,2007;2(2):130-2.
5 王晓兰,王建刚.天然抗肿瘤活性多肽作用机制研究现状〔J〕.医学综述,2009;15(8):1180-4.
6 沈先荣,贾福星,王 玲,等.鲨鱼软骨制剂抑制血管生成的研究〔J〕.生物化学与生物物理进展,1997;24(2):155-9.

