急性脑梗死患者血清肿瘤坏死因子-α、白细胞介素-8和瘦素水平变化
张艳红 陈丽丽 王海英 吕艳华 曹亦宾 (唐山市工人医院神经内二科,河北 唐山 063000)
随着我国老龄化的不断加剧,急性脑梗死(ACI)在老年患者中的发病率逐年增高,主要诱发因素有体重超重、糖尿病、冠心病、高血压等。脑梗死过程中多伴有炎症反应,研究表明,血清肿瘤坏死因子-α(TNF-α)、白细胞介素-8(IL-8)、瘦素(LP)相关的炎症反应是发生ACI后脑神经细胞损伤、死亡的主要原因。LP是脂肪组织分泌的一种肽类激素,具有调节糖、脂肪及能量代谢,减少机体摄食,抑制脂肪合成等作用。本研究通过对老年ACI患者血清TNF-α、IL-8和LP含量水平的研究,旨在探讨血清TNF-α、IL-8和LP水平变化情况对老年ACI患者的临床意义。
1 资料与方法
1.1 临床资料 选取2009年5月至2010年11月于我院住院治疗的老年 ACI患者 48例作为观察组,其中男 31例(64.58%),女17例(35.42%),年龄 60~80〔平均(71.47±6.33)〕岁,所有患者病程小于24 h。患者诊断参照急性脑梗死诊断标准(全国第四届脑血管病会议修正)〔1〕,且经颅脑CT证实。排除标准:①发病前1 w有感染病史;②周围血管栓塞;③心肌梗死;④血液系统疾病;⑤心、脑、肾功能不全。选择于我院体检健康人48例作为对照组,其中男29例(60.42%),女19(39.58%),平均年龄(69.31±4.79)岁。
1.2 方法 分别于ACI患者入院后第1、3、7天早6:00~8:00空腹采集静脉血5 ml送检,对照组采集空腹静脉血5 ml送检,采用放射免疫法测定血清TNF-α、IL-8和LP含量。
1.3 评价标准 患者入院后第1、3、7天分别进行ESS评分。神经功能缺损(ESS)是脑血管病神经功能损失评价的常用方法,包括14项指标,满分100分,评价分数越低说明病情越重。1.4 统计学方法 应用SPSS15.0软件,资料数据以±s表示,组间比较采用t检验。
2 结果
2.1 两组血清TNF-α、IL-8和LP含量比较 观察组患者血清TNF-α、IL-8和LP含量明显高于对照组(P<0.05)。观察组患者血清TNF-α、IL-8和LP在第1、3、7天的含量具有动态变化,三者含量在7 d内达到高峰的时间各不相同,其中TNF-α、LP含量在发病后第3天达到高峰,随后出现下降趋势,IL-8含量在发病后随时间的推移呈现增长趋势。见表1。
表1 两组患者各检测指标比较( ± s,ng/ml)
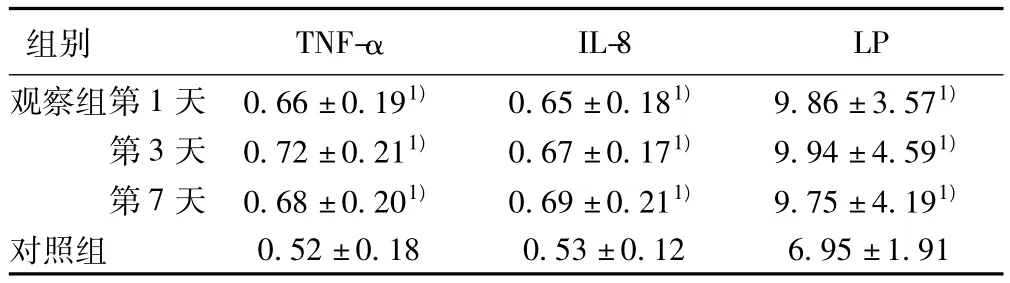
表1 两组患者各检测指标比较( ± s,ng/ml)
与对照组比较:1)P<0.05
IL-8 LP观察组第1天 0.66±0.191) 0.65±0.181) 9.86±3.571)组别 TNF-α第3天 0.72±0.211) 0.67±0.171) 9.94±4.591)第7天 0.68±0.201) 0.69±0.211) 9.75±4.191)对照组0.52±0.18 0.53±0.12 6.95±1.91
2.2 观察组ESS评分结果 观察组患者发病第3天ESS评分最低(64.84±21.36),与第 1天(71.43±19.75)、第 7天(69.39±20.49)ESS评分结果比较,有显著性差异(P<0.05)。
3 讨论
TNF-α是一种直接参与人体正常免疫反应的促炎细胞因子,主要由巨噬细胞和单核细胞分泌〔2〕,在恶性肿瘤、心脏衰竭和炎性反应性疾病病理状态下可出现增多现象,是机体最早出现和起核心作用的炎性介质。IL-8又称趋化因子,主要由巨噬细胞和上皮细胞分泌,具有最强的趋化中性粒细胞作用,能增加对中性粒细胞的吸引,使其聚集在病变部位,进而作用于脑缺血的再灌注时期,调节炎症反应和促进血管生成。ACI病变的根本原因是脑动脉粥样硬化,导致脂质斑块形成和血管内皮细胞损伤。TNF-α直接参与动脉硬化和脂质斑块的形成,并可能导致脂质斑块稳定性破坏,使脂质斑块不断扩大。有研究发现〔3〕,ACI发作后7 d内,血清TNF-α含量与LP含量变化关系密切。LP是脂肪组织分泌的一种肽类激素,具有调节糖、脂肪及能量代谢,减少机体摄食,抑制脂肪合成,从而减轻体重的作用。有实验指出,LP能抑制人体胰岛素的分泌,破坏人体内分泌系统,导致高密度脂蛋白含量降低和甘油三酯含量升高〔4〕。ACI患者发病时可导致下丘脑-垂体-肾上腺皮质系统的功能紊乱,致使下丘脑调节作用失常和脑组织受损,破坏LP对下丘脑受体的作用,形成LP拮抗,从而使LP的作用不能发挥,刺激内分泌系统导致LP分泌量增加。本研究发现,患者血清LP含量亦明显增高,说明LP在ACI发病过程中起着重要作用。近年来,许多实验证明有大量细胞因子参与了ACI的发病过程,其中血清TNF-α、IL-8和LP最为重要,通过对血管内膜造成直接损害进而改变血管壁的通透性,增加血细胞与血管内皮细胞的黏附,产生自由基,促进凝血反应和血管收缩〔5〕,进而加重病情。本研究发现,ACI患者血清TNF-α、IL-8和LP含量明显高于对照组,说明血清TNF-α、IL-8和 LP参与了ACI的发病过程。本实验也发现血清TNF-α、IL-8和LP含量具有波动性,其中TNF-α、LP含量在发病后第3天达到高峰,随后出现下降趋势,发病后TNF-α含量的变化趋势与患者脑组织损伤、炎症反应的变化具有一致性。虽然在恢复期其水平随病程的加长、炎症反应改善而有所下降,但仍高于正常水平,说明ACI的发病过程中存在TNF-α所介导的炎症反应。由于高血压、冠心病等造成的动脉硬化在 ACI的恢复过程中始终存在〔6〕,使血清TNF-α含量在恢复期仍高于正常水平〔7〕。本研究发现,ACI发作后LP含量持续升高,在发生脑梗死的栓塞状态下,体内TNF-α与LP等因子相互作用,所以使其保持在较高的水平。LP含量的升高激活交感神经,从而抑制胰岛素分泌水平,使血脂水平发生变化,在一定程度上加重了ACI患者的病情〔8〕;IL-8含量在发病后随时间的推移呈现增长趋势,多数ACI患者表达IL-8的单核细胞mRNA有所增加,使血清IL-8含量增加,促使白细胞向缺血部位聚集。
综上所述,本研究发现ACI发病过程中体内存在明显炎症反应,且有诸多炎性因子的参与。但在研究过程中发现,在发病第7天时ESS评分与血清IL-8具有相关性,与TNF-α、LP含量无明显关系,所以仍需更多的研究对其相关因素进行分析。
1 中华神经科学会,中华神经外科学会.各类脑血管病诊断要点〔J〕.中华神经科杂志,1996;29(6):379-80.
2 毛小平,彭 蕾,李 翔.老年急性脑梗死患者血清肿瘤因子-α测定的临床意义〔J〕.中华老年医学杂志,2001;20(6):454-4.
3 Johansson A,Ahren B,Nasman B,et al.Cortisol axis abnormalities early after stroke-relationships to cytokines and leptin〔J〕.J Intern Med,2000;247(2):179-87.
4 周亚茹.TNF-a在胰岛素抵抗发生机制中的作用〔J〕.国外医学·免疫学分册,2002;25(5):276-8.
5 Mahmud A,Feely J.Arterial stiffness is retated to systemic inflammation in essential hypertension〔J〕.Hypertension,2005;46(5):1118-22.
6 王小燕,蓝春勇,钟维章,等.彩色多普勒超声检测急性脑梗死患者颈动脉硬化病变的价值探讨〔J〕.中国超声医学杂志,2009;25(3):236-9.
7 Grau AJ,Reis A,Buggle F,et al.Monocyte function and plasma levels of interleukin-8 in acute ischemic stroke〔J〕.J Neurol Sci,2001;192(1-2):41-7.
8 陈桂兰.急性脑梗死患者血清肿瘤坏死因子α的变化及其与胰岛素抵抗的关系〔J〕.广西医科大学学报,2003;20(6):921-2.

