采用PCR法对乙型肝炎病毒基因型检测的临床观察与分析
夏献颗 郭佐华
(湘潭县人民医院检验科,湖南 湘潭 411228)
目前乙型肝炎病毒临床基因分型为A~H共8个基因型,并且还可能同人类感染乙型肝炎病毒途径、疾病进展、药物抗病毒治疗效果存在一定关系,但是乙型肝炎病毒基因型还存在地区分布差异性,检测方法也存在多样,致使研究结论各有差异,本研究采用分型准确率高、操作相对简单的基因型特异性引物聚合酶链反应法(以下简称PCR法)对我院2010年6月至2011年5月收治的部分乙型肝炎病毒感染者血清实施了基因型检测、分析,现将其报告如下。
1 资料与方法
从我院2010年6月至2011年5月收治的乙型肝炎病毒感染者中将存在甲、丙、戊等其他肝炎病毒感染及其他可引发肝脏病变疾病的患者排除,选取430例患者血清进行乙型肝炎病毒基因型检测、分析,其中男性372例,女性58例,年龄2至65岁,平均(33.2±14.85)岁,病程1~40年,平均(9.84±11.01)年。所有患者入院诊断均符合《病毒性肝炎防治方案》(2000年全国病毒性肝炎西安学术会议所制订),其中乙型肝炎病毒携带者91例、慢性乙型肝炎206例、急性乙型肝炎10例、肝炎肝硬化110例、原发性肝癌13例。血清采集后在-70℃下保存。
1.2 仪器和试剂
采用美国Promega公司的核酸提取试剂盒,上海生工生物技术公司的Taq DNA和dNTP聚合酶,上海华美生物工程公司的HBeAg检测试剂盒、琼脂糖、phiX174 DNA/HaeⅢDNA分子量标志物。德国台式高速离心机、PCR凝胶成像仪、热循环仪。
1.3 基因分型检测
将待检血清50μL加入60μL裂解液中并使其混匀,行10min 37℃水浴后,分别加入49∶1的氯仿/异戊醇和Tris饱和酚各30μL并充分混匀,再行10min的14000r/min离心,取上清液。将醋酸钠溶液10μL和等体积异丙醇加入所取上清液中并在-20℃下沉淀2h,再行15min的14000r/min离心,将上清液弃去,加入500μL75%的预冷乙醇,再行10min的14000r/min离心,弃去上清液,在50℃下将沉淀干燥后,用DEPC水20μL溶解、20℃保存,作为PCR反应模板。
采用巢式PCR和多对引物法采用40μL反应体系实施两轮扩增,两次扩增反应体系不同,其中第一次包括10×4μL缓冲液、4μLdNTP、2.4MgCl2、0.8μLPl、0.8μLS4R、10μLHBV DNA模板、0.2μLTaq酶、17.8μLH2O;第二次包括10×4μL缓冲液、4μLdNTP、2.4MgCl2、0.8μLB2、0.8μLBA1R、0.8μLBB1R、0.8μLBC1R或者0.8μLB2R、0.8μLBD1、0.8μLBE1、0.8μLBF1、5μL第一轮产物、0.4μLTaq酶、21μLH2O。
第一次扩增反应在10min的95℃预变后20s94℃、20s55℃、1min72℃的40个循环,然后行10min72℃延伸,取第一轮产物,作为第二轮扩增模板。第二次反应是10min的95℃预变后20s94℃、20s65℃、30s72℃的40个循环,然后行7min72℃延伸,得第二轮产物。
取第二轮扩增产物10μL,用琼脂糖凝胶20g/L将其在100V电压下电脉20min,然后采用凝胶成像仪对生成的电脉条带大小进行观察,以确定基因分型,其中68bp为A型、281bp为B型、122bp为C型、119bp为D型、167bp为E型、97bp为F型。
1.4 统计学分析
采用统计学软件SPSS12.0进行数据统计分析,χ2检验,P<0.05表示具有统计学意义上的差异。
2 结 果
2.1 基因型分型结果
依据电泳带确定乙型肝炎病毒基因型(见图),430例血清中B基因型262例,占60.93%;C基因型51例,占11.86%;BC基因型117例占27.21%;未检测到其他基因型的存在。见图1。
2.2 基因型分布状况
各类乙型肝炎病毒感染中,B基因型在病毒携带者以及急性乙型肝炎、慢性乙型肝炎、原发性肝癌患者中分布占绝对优势,C基因型在各类乙型肝炎病毒感染的分布不具有统计学意义上差异(P>0.05),BC基因型多见于肝炎肝硬化患者,差异具有显著性(P<0.05),见表1。

表2 各基因型临床特征
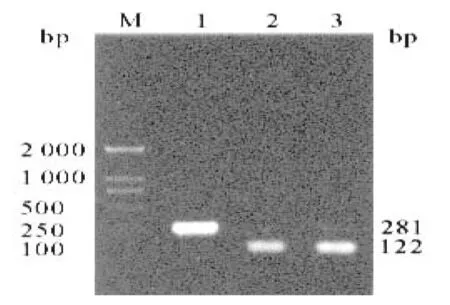
图1 基因型分型结果

表1 乙型肝炎病毒基因型在各类型感染中的分布(n,%)
2.3 各基因型临床特征
本研究中430例感染患者中,各基因型于不同年龄不存在明显相关性,同性别中分布不具有显著性差异(P>0.05);BC基因型血清ALT水平较高,但不存在显著性差异(P>0.05);不同基因型患者血清内乙型肝炎病毒基因含量差异不具有显著性(P>0.05)。见表2。
3 讨 论
感染病毒基因类别与疾病进展及感染谱可能存在一定的关联性,会对疾病转归造成一定影响,乙型肝炎病毒基因型的研究以及准确分型对乙型肝炎的治疗、病情进展以及预后评价具有一定的价值[1]。
3.1 乙型肝炎病毒基因型分布
乙型肝炎病毒基因型具有明显的地理性差异,是乙型肝炎病毒进化的体现,表现出乙型肝炎病毒自然感染史在世界各地的变异特点,其中A型主要分布在西欧、北欧、印度、非洲中部及美国;B、C型主要分布在太平洋地区及亚洲东、南部国家,如中国、印度尼西亚、越南、日本等;E型则仅限于非洲地区;F型主要分布在美洲中、南部的土著以及美国、波利尼西亚等地;G型主要分布在法国、美国、墨西哥、德国;H型是从F型转化出来的,目前主要美国中部的印第安人中[2],墨西哥、尼加拉瓜等地也有发现。
我国主要的乙型肝炎病毒基因型B、C基因型在国内分布也具有地理区域性特征,从南到北,B型逐渐增多、C型则呈减少趋势,另外部分地区如广东、宁夏、香港存在D型感染,罕见A型[3],其他E、F、G、H基因型目前还未在国内发现。本研究中采用基因型特异性引物聚合酶链反应法对430例乙型肝炎病毒感染者血清进行了病毒基因型检测,430例血清中B基因型262例,占60.93%;C基因型51例,占11.86%;BC基因型117例占27.21%;未检测到其他基因型,结果与国内相关报道基本一致。
3.2 乙型肝炎病毒感染基因型临床观察
乙型肝炎病毒感染基因型与患者感染类型、肝功能的关系,目前还未有明确定论,本研究中各类乙型肝炎病毒感染中,B基因型在病毒携带者以及急性乙型肝炎、慢性乙型肝炎、原发性肝癌患者中分布占绝对优势,C基因型分布不具显著差异(P>0.05),BC基因型多见于肝炎肝硬化患者,差异具有显著性(P<0.05),BC基因型血清ALT水平较高,但不存在显著性差异(P>0.05),显示BC基因型与疾病进展可能存在一定关联性;而各基因型于不同基因型患者血清内乙型肝炎病毒基因含量差异不具有显著性(P>0.05),提示肝脏病毒复制和炎症与病毒基因型可能不存在相关性。
[1]李彩东,吴斌,田鹏飞,等.某地区乙型肝炎病毒基因型检测及其与患者肝功能的关系分析[J].国际检验医学杂志,2011,32(13):1490-1492.
[2]刘兴,唐红,何芳.乙型肝炎病毒基因型研究新进展[J].世界华人消化杂志,2006,14(22):2211-2216.
[3]吴赞,孙余婕.乙型肝炎病毒基因型的国内研究进展[J].国际检验医学杂志,2010,31(7):703-704.

