艾灸预处理对阿尔茨海默病模型大鼠海马CA1区BDNF及其受体TrkB的影响
李 熙 孙国杰 王述菊 马 骏 王彦春 张春丽 (湖北中医药大学,湖北 武汉 430061)
阿尔茨海默病(AD)治疗方法仅能缓解症状,不能改变疾病病程〔1〕,且治疗和护理费用昂贵。找寻防治AD的有效方法迫在眉睫,对AD研究的侧重点也开始转向早期诊断和早期干预〔2〕。本研究观察艾灸预处理对AD模型大鼠海马区脑源性神经营养因子(BDNF)及其受体酪氨酸激酶(Trk)B含量的影响,探讨艾灸防治AD的可能作用机制。
1 材料与方法
1.1 实验动物及分组 健康雄性SD大鼠(15月龄)50只,体重350~480 g,由华中科技大学同济医学院实验动物中心提供(许可证号:SCXK(鄂)2004-0007)。所有大鼠提前1 w运到实验室适应性喂养,安静清洁环境下正常饮食饮水。然后进行Y型水迷宫筛选,淘汰反应过于迟钝或特别敏感的大鼠,将合格大鼠按随机数字表法分为4组,正常组、假手术组、模型组、预艾灸组,每组10只。
1.2 主要试剂及仪器 Aβ25~35(美国 Sigma公司),兔抗鼠BDNF多克隆一抗(武汉博士德生物工程有限公司),兔抗鼠TrkB多克隆一抗(武汉博士德生物工程有限公司),免疫组化SP-9001试剂盒(北京中杉金桥生物技术有限公司),DW-5脑立体定位仪(成都泰盟科技有限公司),台式牙钻机(成都康发医疗器械有限公司);ES-2100S电子天平(长沙湘平科技发展有限公司),Sartorius分析天平(北京赛多利斯天平有限公司),轮转式石蜡切片机(德国Leitz公司),PHY-Ⅲ病理组织漂洪处理仪(常州中威电子仪器厂),BMJ-Ⅲ型病理组织包埋冷冻台(常州中威电子仪器厂),BX50光学显微镜(日本OLMPUS公司),HPIAS-1000高清晰度彩色病理图文分析系统(同济医科大学千屏影像公司)。
1.3 AD模型制作
1.3.1 Aβ25~35孵育 用无菌生理盐水将 Aβ25~35稀释成5 μg/μl,密封后置于37℃培养箱中孵育1 w,使其变为聚集状态的 Aβ25~35。
1.3.2 造模方法 在脑立体定位仪下,大鼠双侧海马一次性注射聚集态Aβ25~35制作AD模型〔3〕。大鼠给予10%水合氯醛(35 mg/100 g体重)腹腔注射麻醉后,将鼠头固定于脑立体定位仪上保持前后囟在同一水平,剪开头皮,暴露前囟,定位海马区〔4〕(前囟后3.5 mm,中线旁开2.0 mm,硬脑膜下2.7 mm),台式牙钻机钻一小孔 (直径1 mm),垂直插入微量进样器,将Aβ25~35聚集液缓慢注入,左右侧各注射1 μl(5 μg/μl),注射速度 0.2 μl/min,注射完毕后留针 5 min,使Aβ25~35充分浸润局部组织,按1.0 mm/min速度缓慢拔针。完成后马上缝合头皮,术后每天肌肉注射青霉素10万U/只,连续5 d。
1.4 各组处理方法 ①预艾灸组,对正常大鼠先施于艾灸刺激。艾灸方法:采用自制的直径约8 mm艾条,参照华兴邦等制定的《大鼠穴位图谱的研制》〔5〕,于正常大鼠“百会”(顶骨正中)、“肾俞”(第2腰椎下两旁)、“足三里”(膝关节后外侧,腓骨小头下约5 mm处)穴上方2~3 cm处悬灸(“肾俞”、“足三里”左右隔日交替使用),每穴持续5 min,每日1次,6 d为1疗程,疗程间休息1 d,共3个疗程。施灸结束当日即开始给大鼠双侧海马区注射Aβ25~35建立AD模型,造模后次日继续艾灸治疗1疗程。②模型组:正常喂养3 w后,按前述方法造模。造模后喂养1 w,检测指标。③假手术组:双侧海马区注射等量生理盐水,余同模型组。④正常组:同步喂养,不做任何处理。
1.5 组织取材及处理 用10%水合氯醛 (35 mg/100 g体重)腹腔注射麻醉大鼠,剖开腹腔和胸腔,暴露心脏。用灌胃针从心尖部位插进左心室,穿入主动脉,然后将右心耳剪口以使血液和灌注液流出。先用生理盐水快速灌注,冲洗至右心耳流出液体变为无色及内脏颜色变成浅白,再用4%多聚甲醛灌注固定至动物全身僵硬。断头快速取脑,在视交叉平面前后4 mm处将脑冠状切开,留取中间部分置于4%多聚甲醛磷酸缓冲液中固定过夜,常规石蜡包埋,连续切片,片厚4 μm。
1.6 指标检测 免疫组化SP法检测BDNF、TrkB:石蜡切片,常规脱蜡至水;高温下EDTA液抗原修复;3%过氧化氢液37℃下孵育10 min;蒸馏水冲洗,PBS浸泡5 min;正常山羊血清室温下孵育10 min;一抗4℃孵育过夜;PBS冲洗,3 min×3次;生物素标记的二抗37℃下孵育10 min;PBS冲洗,3 min×3次;辣根酶标记链酶卵白素工作液37℃下孵育10 min;PBS冲洗,3 min×3次;DAB显色,自来水冲洗终止反应;苏木精复染,脱水,透明,封片。PBS代替一抗做阴性对照,其他步骤相同。
1.7 图像分析及统计学处理 OLMPUS BX50光学显微镜下观察海马CA1区并摄像。用HPIAS-1000高清晰度彩色病理图文分析系统测定免疫反应阳性产物的平均灰度值,每组每张切片海马CA1区随机选取4个视野,取平均值。数据以±s表示,组间比较采用t检验,运用SPSS13.0软件统计。
2 结果
免疫组化切片以细胞胞质内呈现棕黄色为阳性。平均灰度值与免疫阳性产物含量成反比,灰度值低,说明透光度低,染色强度高。与正常组及假手术组比较,模型组大鼠海马CA1区BDNF及TrkB的表达明显下降,表现为阳性神经元平均灰度值明显上升 (P<0.01);与模型组比较,预艾灸组大鼠海马CA1区BDNF及TrkB的表达明显增加,表现为阳性神经元平均灰度值明显降低 (P<0.01)。见表1。
表1 各组大鼠海马CA1区BDNF及其受体TrkB阳性神经元平均灰度值(±s)
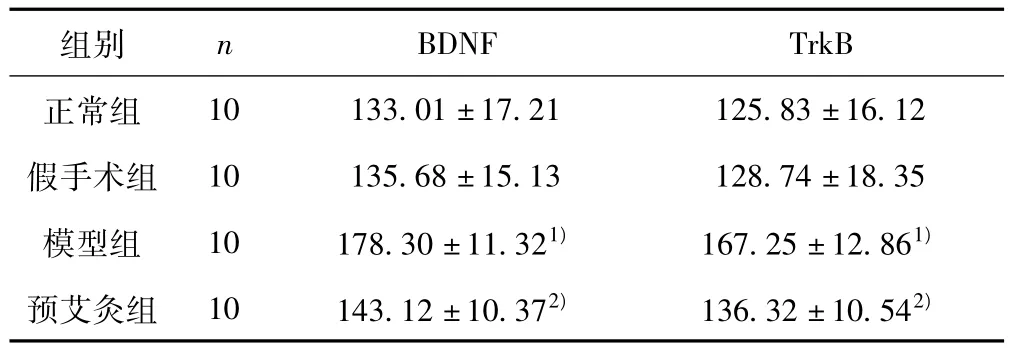
表1 各组大鼠海马CA1区BDNF及其受体TrkB阳性神经元平均灰度值(±s)
与正常组及假手术组比较:1)P<0.01;与模型组比较:2)P<0.01
组别 n BDNF TrkB正常组10 133.01±17.21 125.83±16.12假手术组 10 135.68±15.13 128.74±18.35模型组 10 178.30±11.321) 167.25±12.861)预艾灸组 10 143.12±10.372) 136.32±10.542)
3 讨论
中医学认为,AD的病位在脑,其发病与五脏功能密切相关,其中与肾、肝、心、脾四脏关系最为密切。肾精亏虚为AD的基本病机,痰浊瘀血既是AD患者体内的病理产物,又是AD的致病因素,其病理性质为本虚标实。肾精虚衰,髓海空虚为病之本。血瘀、痰浊内阻,浊阴不降,上蒙清窍为病之标〔7,8〕。依据AD“本虚标实”的病理性质及其病因,病机,病位和临床症状等特点,我们制定了“益肾精、健脾胃、补脑髓”的治疗法则,选取“百会”、“肾俞”、“足三里”穴艾灸进行防治。百会位居头之巅顶,又名三阳五会,是督脉与足太阳、手少阳、足少阳、足厥阴等经脉交会处,是治疗脑病的首选穴位,具有通调督脉气血,补脑益智之功。肾俞位于背部,是膀胱经之腧穴、肾之背俞穴,可补益肾精,且其所属经脉“入络脑”。足三里是足阳明胃经的合穴,胃腑下合穴,可调理脾胃,助脾胃运化水湿,蠲化痰浊;又可补益气血,填精益髓,使髓海充足,神清窍利。百会、肾俞、足三里三穴同用,可使脑髓得气血荣养而改善健忘、痴呆之症。
BDNF是NTFs家族重要的成员之一,广泛分布于中枢神经系统,能调节神经元的发生、发育和存活,维持成熟神经元的功能〔8〕,在改善认知功能方面也起着重要作用〔9〕。酪氨酸激酶(Trk)A,TrkB和TrkC是NTFs的受体,其中,TrkB为BDNF的特异性受体〔10〕,具有酪氨酸激酶活性。BDNF与TrkB结合可调节神经营养信号。研究发现,BDNF的表达与学习和记忆过程关系密切。动物经水迷宫学习训练后,脑内BDNF mRNA表达增加〔11〕,而BDNF缺乏的动物空间学习和记忆则出现明显障碍〔12〕。
1 任汝静,陈生弟.阿尔茨海默病的治疗现状和展望〔J〕.中国现代神经疾病杂志,2005;5(3):147-51.
2 Sramek JJ,Veroff AE,Cutler NR.Mild cognitive impairment:emerging therapeutics〔J〕.Ann Pharmacother,2000;34(10):1179-88.
3 李 芳,李光荣,满玉清.Aβ25~35双侧海马内注射痴呆模型大鼠空间学习记忆的改变〔J〕.药物生物技术,2005;12(3):190-2.
4 Morimoto K,Yoshimi K,Tonohiro T,et al.Coinjection of β-amyloid with ibotenic acid induces synergistic loss of rat hippocampal neurons〔J〕.Neuroscience,1998;84(2):479-87.
5 华兴邦,李辞荣,周浩良,等.大鼠穴位图谱的研制〔J〕.实验动物与动物实验,1991;19(1):1-5.
6 朱建华.老年性痴呆〔J〕.江苏中医药杂志,2004;25(10):12-4.
7 崔德芝,张恭新,朱振铎.老年性痴呆的中医理论探讨〔J〕.山东中医杂志,2006;25(10):655-7.
8 Mctigue DM,Horner PJ,Stokes BT,et al.Neurotrophic-3 and brain-derived neurotrophic factor induce oligodendrocyte proliferation and myelination of regenerating axons in the contused adult rat spinal cord〔J〕.J Neurosci,1998;18(14):5354-65.
9 Mu JS,Li WP,Yao ZB,et al.Deprivation of endogenous brain derived neurotrophic factor results in impairment of spatial learning and memory in adult rats〔J〕.Brain Res,1999;835(2):259-65.
10 Merlio JP,Ernfors P,Kokaia Z,et al.Increased production of the TrkB protein tyrosine kinase receptor after brain insults〔J〕.Neuron,1993;10(2):151-64.
11 Kesslak JP,So V,Choi J,et al.Learning upregulates brain-derived neurotrophic factor messenger ribonucleic acid:a mechanism to facilitate encoding and circuit maintenance〔J〕.Behav Neurosci,1998;112(4):1012-9.
12 Linnarsson S,Bjorklund A,Ernfors P.Learning deficit in BDNF mutant mice〔J〕.Eur J Neurosci,1997;9(12):2581-7.

