4T42肽腺病毒载体的构建包装及抗SKBR3乳腺癌细胞的效果
祁冬冬 陈英利 郭建壮 朱贵明 张 涛 姜 爽 王宇卓
(佳木斯大学基础医学院生化与分子生物教研室,黑龙江 佳木斯 154000)
与传统的肿瘤治疗方法相比,抑制新生血管生成疗法作用于遗传稳定不易变异的血管内皮细胞,不易产生耐药性;而且内源性血管生成抑制因子具有抑制瘤床内皮细胞增殖的高度选择性〔1〕,因而成为肿瘤治疗的一个新策略。肿瘤抑素(Tumstatin)是近年发现的一种活性最强的内源性肿瘤血管生成抑制因子,可抑制血管内皮细胞蛋白的合成,诱导内皮细胞凋亡,进而抑制血管生成;同时还可以抑制肿瘤细胞增殖并促进其凋亡,从而抑制肿瘤生长,但不影响生理性血管的生成〔2〕。肿瘤抑素相关活性肽T42肽具有显著的抗肿瘤细胞活性,可明显抑制人肝癌细胞HepG2的生长增殖,并促进其凋亡〔3〕。本实验通过人工合成T42肽基因,构建pAd-EGFP-T42腺病毒表达载体,并转染Hek293细胞,观察其对MCF-7乳腺癌细胞的凋亡和生长的影响。
1 材料与方法
1.1 细胞和主要试剂 Hek293细胞、pEC3.1(+)-EGFP质粒、DH5a 大肠杆菌;pAd-BL-Dest菌液、LR Clonase Ⅱ、Lipofectamin 2000试剂盒、氨苄青霉素、卡那霉素及蛋白酶K(Invitrogen公司);Pac I等限制性内切酶(Neb公司)、质粒中提试剂盒和DNA回收凝胶试剂盒(长沙爱科博生物科技有限公司);细胞培养用的 DMEM、胰酶、胎牛血清、细胞培养板等(Gibco 公 司)。T42 引 物:前 向:5′-ATGCCGTTCTTATTCTGCAATG-3′;反向:5′-GGAGTTTGAGTAGTAGTTGCAC -3′。EGFP引物:前向:5′-TTTGAATTCATGGTGAGCAAGGGC-3′;反向:5′-TGGCTCGAGTTACTTGTACAGCTC-3′。引物由上海 Invitrogen公司合成。
1.2 方法
1.2.1 T42基因的获得及四倍体T42肽(4T42)的构建 人工合成 T42肽基因(序列参考文献〔4〕),5′端加上 BamH I酶切位点,3′端加上Bgl II-EcoR I酶切位点,由南京金斯瑞生物科技有限公司完成并克隆到pUC57载体(命名为pUC57-T42)。之后分别对pUC57-T42用BamH I/EcoR I双酶切回收T42片段和BglⅡ/EcoR I双酶切回收载体。用T4连接酶对T42片段和载体片段进行连接,鉴定阳性克隆后重复酶切连接一次,鉴定阳性的克隆就为 pUC57-4T42。
1.2.2 pEC3.1(+)-4T42重组质粒的构建 用 BamH I和EcoR I分别双酶切pUC57-4T42 PCR产物和pEC3.1(+)载体,回收T42片段和pEC3.1(+)载体片段,用T4 Ligase 16℃过夜连接。次日将连接产物转化DH5-alpha感受态,挑取单菌落摇菌,提取质粒,进行双酶切鉴定。
1.2.3 pEC3.1(+)-EGFP-4T42重组质粒的构建 通过PCR扩增EGFP片段,EcoR I和Xho I分别双酶切 PCR产物和pEC3.1(+)-EGFP-4T42 质粒,回收后用 T4 Ligase 16℃ 过夜连接。次日将连接产物转化DH5-alpha感受态,挑取单菌落,摇菌,提取质粒,进行EcoR I和Xho I双酶切鉴定。
1.2.4 构建pAd-EGFP-T42质粒 通过LR体外同源重组将EGFP-4T42表达框转移至 pAd-BL-Dest腺病毒表达载体上构建pAd-EGFP -T42 质粒。pEC3.1(+)-4T42-EGFP 3 μl,pAd-BLDest 1 μl,LR Clonase Ⅱ (Invitrogen)2 μl,补加 pH8.0 的 TE Buffer到总体积10 μl。放置到25℃水浴反应 3 h。加入1 μl蛋白酶K到上步反应体系中,37℃反应15 min。将5 μl上步反应产物转化DH5а感受态细胞,均匀涂布于含Amp抗性(终浓度为100 μg/ml)的LB平板上,37℃恒温箱培养过夜。从培养皿上挑取单克隆菌落接种于5 ml含 Amp抗性(终浓度为100 μg/ml)的LB培养液中,37℃,250 r/min培养过夜。用中提试剂盒提取质粒,对提取的pAd-EGFP-4T42质粒进行PCR鉴定:加入 10 倍 PCR Buffer 2.5 μl,rTaq(Takara)0.25 μl,dNTP(2.5 mmol/L)1 μl,T42 F(10 μmol/L)0.25 μl,T42R 0.25 μl,pAd-EGFP-T42 1 μl,补加 ddH2O 到总体积 25 μl。然后通过94℃ 5 min;94℃ 30 s,56℃ 40 s,72℃ 50 s(共 30 个循环);72℃10 min延伸后进行琼脂糖凝胶电泳鉴定条带大小。对提取的 pAd-EGFP-4T42 质粒进行酶切鉴定:取 pAd-EGFP-4T42 2 μl,Pac I Buffer 2 μl,Pac I 1 μl,补加水到 20 μl;放置到 37℃水浴3 h进行反应后,进行琼脂糖凝胶电泳鉴定。
1.2.5 pAd-EGFP-4T42转染Hek293细胞 用含10%胎牛血清、10 U/ml氨卞青霉素和10 U/ml链霉素的DMEM培养基,6 cm细胞培养板,将细胞培养至密度为约50% ~70%,更换新鲜的不含血清的DMEM培养基;取4 μg重组鉴定正确的pAd-EGFP-4T42质粒用 Pac I单酶切线性化后,加入培养基至250 μl,混匀为 A;将12 μl Lipo 2000 脂质体加入238 μl培养基中,混匀为B;室温5 min后,将A缓慢加入B中,室温避光静置20 min为C;慢慢将C加入细胞密度50% ~70%的Hek 293细胞培养皿中,37℃,5%CO2培养24 h后,荧光显微镜下观察绿色荧光信号判断rAd-EGFP-4T42是否包装成功。
1.2.6 rAd-EGFP-4T42腺病毒的收集和扩增 继续培养上步转染成功的Hek293细胞,待出现明显CPE,且有>50%细胞脱壁时,即可收集细胞,离心加1 ml PBS并在-80℃和37℃水浴中反复冻融3次,每次冻融后,旋转离心管1次,以使细胞悬液充分冻融,室温下,12 000×g离心10 min,沉淀细胞碎屑,将上清液(主要成分为病毒原液)移入新的离心管中于-80℃。
将Hek23细胞接种于6孔板上,使每孔内细胞数达到约7×105。吸去培养液,然后加入1 ml新鲜培养液,同时加入200 μl病毒原液混匀,37℃孵育2 h,再加入2 ml培养液继续孵育。每日用荧光显微镜观察情况。当有病毒产生后即按上述方法收集病毒液。
1.2.7 rAd-EGFP-4T42腺病毒的鉴定 采用 RT-PCR方法鉴定。转染后48 h,用Trizol抽提各孔细胞的总 RNA,以 Oligo(dT)为引物合成cDNA。然后以cDNA为模板,用T42F/R上下游引物行PCR检测。
1.2.8 rAd-EGFP-4T42病毒滴度测定(荧光显微镜计数) 滴度测定前,以0.5×105浓度种细胞Hek293于24孔板,每孔1 ml细胞培养基,过夜(12 h)培养使细胞在板底部形成单层,此时细胞密度大约为1.0×105;取10 μl病毒液 +90 μl培养基,依次稀释得到10-1~10-5病毒稀释液。24孔板依次加入梯度稀释的待测病毒样品20 μl,留一孔作为对照不加病毒,培养2 d;荧光计数:荧光显微镜下计数带有荧光的细胞数目;计算病毒滴度:荧光细胞数目×稀释倍数(10,102…105)/接种病毒量。
1.2.9 重组rAd-EGFP-4T42质粒转染MCF-7乳腺癌细胞及其MTT 分析 实验共设3 组:重组 rAd-EGFP-4T42 质粒组、rAd-EGFP对照质粒组、空白对照组。转染前24 h取指数生长期的MCF-7乳腺癌细胞以4×105个细胞/孔分别接种到6孔板中。次日弃去原培养基,用PBS轻轻洗2遍,加入1 ml 2%FBS的培养基,并用Lipo2000转染各组质粒到细胞中,6 h后换液并置于37℃、5%CO2培养箱中培养18 h,荧光显微镜下观察转染效果,并分别取各组细胞2×104个/孔到96孔板中。分别于12、24、36、48 h对各组细胞进行MTT实验。并计算各时间点质粒转染组相对于对照组的生长抑制率。
1.2.10 重组rAd-EGFP-4T42腺病毒感染SKBR3乳腺癌细胞及其流式细胞仪分析 实验共设3组:重组腺病毒rAd-EGFP-4T42感染组、rAd-EGFP对照腺病毒感染组、空白对照组。根据文献〔5〕的方法确定 MOI的值,将重组腺病毒 rAd-EGFP-4T42的最适MOI定为100。感染前24 h取指数生长期的SKBR3乳腺癌细胞细胞以4×105个细胞/孔,分别接种到各组的6孔板中。次日弃去原培养基,用PBS轻轻洗2遍,加入1 ml 2%FBS的培养基,并加入100 MOI重组腺病毒或rAd-EGFP对照腺病毒,置于37℃、5%CO2培养箱中培养4 h,更换为新鲜完全培养基,培养48 h后胰酶消化收集各孔细胞。
在双变量流式细胞仪分析各组细胞,结果判断方法如下:左下象限显示活细胞,为(FITC-/PI-);右上象限是晚期凋亡细胞和坏死细胞,为(FITC+/PI+);而右下象限为早期凋亡细胞,呈现(FITC+/PI-),左上象限代表细胞收集过程中出现的损伤细胞(FITC-/PI+)。
1.3 统计学方法 组间比较行χ2检验。
2 结果
2.1 pUC57-4T42四倍体的琼脂糖凝胶电泳结果 将提取的pUC57-2T42、pUC57-4T42 质粒用 BamH I/EcoR I双酶切鉴定,得到大小分别为3 000、256、3 000、512 bp的片段,分别与载体和2T42(4T42)的大小相符。
2.2 pEC3.1(+)-EGFP-4T42双酶切结果 将提取的pEC3.1(+)-EGFP-4T42 质粒用 EcoR I/Xho I双酶切鉴定,得到大小为5 046 bp和820 bp的片段,分别与pEC3.1(+)-4T42和EGFP的大小相符,说明结果正确。
2.3 pAd-EGFP-4T42 双酶切鉴定结果 提取 pAd-EGFP-4T42质粒用Pac I单酶切,得到大小约3 000 bp和大于15 kb的片段,说明质粒为 pAd-BL-dest,即 pAd-EGFP-4T42 完全正确。
2.4 转染rAd-EGFP-4T42的Hek293细胞荧光显微镜观察结果 通过Lipo2000介导转染rAd-EGFP-4T42的Hek293细胞转染24 h后,在倒置荧光显微镜下观察的结果见图1,说明转染成功。
2.5 Hek293细胞中RT-PCR结果 琼脂糖凝胶电泳结果显示在128 bp处有清晰条带。
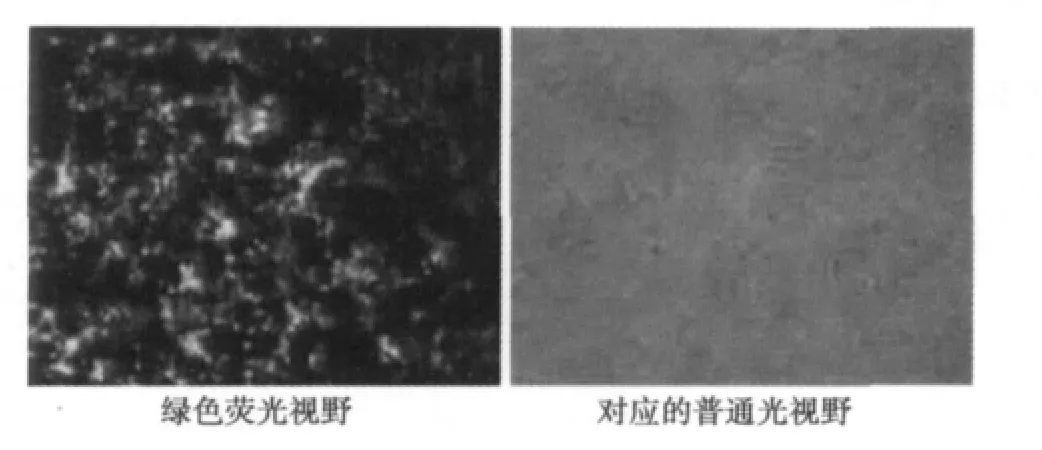
图1 质粒rAd-EGFP-4T42转染Hek293细胞的结果
2.6 Hek293细胞中的病毒物理滴度检测结果 Hek293细胞中的病毒物理滴度检测,以稀释5次方的孔计算,每孔GFP阳性细胞共为82,则病毒滴度=4×108DRP/ml。
2.7 质粒转染组和对照组肿瘤细胞的MTT实验结果 见图2。rAd-EGFP-4T42质粒转染组与对照组相比差异显著(P<0.05),而rAd-EGFP质粒转染组与对照组相比差异不显著。
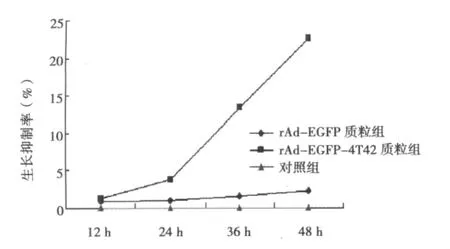
图2 质粒转染组与对照组相比的生长抑制率
2.8 流式细胞仪检测SKBR3乳腺癌细胞凋亡率 空白对照组、对照腺病毒 rAd-EGFP感染组和重组腺病毒 rAd-EGFP-4T42感染组的凋亡率分别为11.6% ±2.2%、15.5% ±4.3%和38.9% ±4.4%。感染重组腺病毒rAd-EGFP-4T42的T24细胞较对照腺病毒感染细胞和未转染空白组细胞凋亡率高,其差异有统计学意义(P<0.05)。
3 讨论
从肺-肾出血综合征(Goodpasture)自身抗原发现Tumstatin有两个功能位点:一个是C-末端的185~203位氨基酸组成的19肽,具有直接抑制肿瘤细胞增殖〔6〕,促进肿瘤细胞凋亡的作用〔7,8〕;另一个是接近N端的54~132位氨基酸组成的78肽,即tum-5片段,具有抗血管生成作用〔9〕。进一步研究证明,抗肿瘤血管生成活性区定位于74~98位氨基酸〔10〕,被称为T7片段。目前利用-GG-柔性Linker将19肽和T7片段这两个最小活性片段连接重组为T42肽,使其具有抗血管活性和抗肿瘤活性双重作用的肿瘤抑素活性肽〔3〕。本文在构建含4T42基因的腺病毒过程中,在荧光蛋白的指示下,能充分观察到含目的基因的腺病毒基因组转染 Hek293细胞的情况,在第7天观察到大量Hek293细胞脱落、崩解,与文献报道的一致〔11〕。与没有荧光蛋白指示的转染靠主观判断来决定病毒产生时间相比,充分保证了最高滴度病毒的获取。荧光显微镜观察具有绿色荧光说明EGFP片段进入Hek293细胞,RT-PCR结果说明了有4T42质粒进入Hek293细胞,培养后检测结果显示具有荧光说明成功包装出腺病毒,且该腺病毒具有感染能力。rAd-EGFP-4T42腺病毒的成功构建和包装以及功能研究的初步结果显示,该腺病毒具有促进癌细胞凋亡的功能,且作用效果明显。但其作用机制尚待进一步研究。
1 贺 欣,赵启仁.肿瘤抑素T7肽及其衍生物T7-NGR载体构建及表达〔J〕. 生物医学工程与临床,2008;12(3):240-4.
2 Hamano Y,Zeisberg M,Sugimoto H,et al.Physiological levels of tumstatin,a fragment of collagen,alpha 3 chain,are generated by MMP-9 proteolysis and suppress angiogenesis via alpha V beta 3 integrin〔J〕.Cancer Cell,2003;3(6):589-601.
3 苏晓杰,武风君,袁丽杰,林雪松.肿瘤抑素相关肽T42肽的纯化及抗肝癌细胞Hepg2活性的测定〔J〕.吉林大学学报(医学版),2010;36(1):86-9.
4 Li Y,Liu XH,Lin XS,et al.Inhibitory effect of tumstatin related peptide T42 on human umbilical ein endothelial cells and human gastric adenocarcinoma〔J〕.Clin Rehab Tissue Engineer Res,2007;11(10):1837-40.
5 Maeshima Y,Colorado PC,Torre A,et al.Distinct antitumor properties of type Ⅳ collagen domain derived from basement membrane〔J〕.Biol Chem,2000;275(28):21340-8.
6 Maeshima Y,Yerramalla UL,Dhanabal M,et al.Extracellular matrix derived peptide binds to alpha(v)beta(3integrin and inhibits angiogenesis〔J〕.Biol Chem,2001;276(34):31959-68.
7 Hamano Y,Kalluri R.Tumstatin the NC1 domain of alpha3 chain of typ IV collagen is an endogenous inhibit of pathological angiogenesis and sup presses tumor growth〔J〕.Biochem Biophys Res Commun,2005;333(2):292-8.
8 袁丽杰,赵恒宇,苏晓杰.小分子肽-肿瘤抑素19肽纯化及抗肿瘤活性研究〔J〕. 现代生物医学进展,2007;7(5):674-6.
9 Maeshima Y,Sudhakar A,Lively JC,et al.Tumstatin,an endothelial cellspecific inhibitor of protein synthesis〔J〕.Science,2002;295(5552):140-3.
10 付 雪,王淑静,林雪松.肿瘤抑素抗血管活性相关肽的表达及活性研究〔J〕. 医学分子生物学杂志,2005;2(3):157-61.
11 He TC,Zhou SB,Luis T,et al.A simplified system for generating recombinant adenoviruses〔J〕.Pro Natl Acad Sci,1998;5(4):2509-14.

