周期性张应力对骨性关节炎软骨细胞p38 MAPK表达及其磷酸化的影响*
刘兴漠,项禹诚,孙 青,潘 滔,黄 帅,王德春
(中山大学附属第六医院骨科,广东 广州 510655)
骨性关节炎(osteoarthritis,OA)是关节疾病中最常见的类型之一,其病理过程以软骨细胞的凋亡和软骨基质的破坏为特征。研究证实异常的应力刺激会造成软骨细胞功能下降、失调,使基质合成减少,从而导致关节退变的启动及发展[1]。丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)途径是真核细胞转导细胞外信号(包括力学信号)到细胞内,引起细胞内反应的一类重要信号系统。目前研究最多的主要集中在其家族的3个成员上:细胞外信号调节激酶1/2(ERK1/2)、c-Jun N末端激酶(JNK)以及p38 MAPK。我们前期研究已证实,在关节软骨缺损和OA的动物模型中,软骨细胞过度表达基质金属蛋白酶类(matrix metalloproteinases MMPs)[2]。本次实验利用 Flexercell-4000 型力学加载系统对OA软骨细胞加载强度不同的周期性张应力(cyclic tensile strain,CTS),观察 OA软骨细胞在 MMPs途径上游事件中p38 MAPK及其磷酸化产物的活化和表达的变化,揭示软骨在细胞分子水平上与力学环境的相互作用特点。
材料和方法
1 动物、试剂及仪器
6周龄新西兰白兔5只,体重2.0~2.5 kg,雌雄不限,由中山大学实验动物中心提供。实验过程中动物处置符合动物伦理学标准。反转录-聚合酶链反应(RT-PCR)试剂盒(上海飞捷生物技术有限公司);BioFlex6孔培养板(Flexcell);Flexercell-4000型力学加载系统(Flexcell);ABI PRISM® 7500 Sequence Detection System(上海硕盟生物科技有限公司);Bio Photometer Plus核酸蛋白测定仪(艾本德中国有限公司);ECL化学发光试剂盒(Amersham);Polytron PT 10-35组织扩散仪(Kinematica)。
2 OA动物造模
根据文献[3],5只新西兰白兔用10 mg/kg戊巴比妥钠行耳缘静脉麻醉,随机逐层切开一侧膝部皮肤至关节囊,将髌骨推向外侧,暴露关节腔,直视下尖刀切断前交叉韧带(辅助检查前抽屉试验阳性),髌骨回位,仔细止血,逐层闭合关节囊和皮肤。术后肌内注射5×105U青霉素,膝关节不固定,置笼内自由活动。
3 膝关节软骨细胞分离培养
术后10周空气栓塞处死动物,采用酶消化法分离获取软骨细胞。无菌条件下分别切取所有动物双侧膝关节表面软骨组织,一般以不渗血为度。切成约1 mm×1 mm×1 mm大小碎块,D-Hanks液冲洗,弃上清,称重。用0.4%链霉蛋白酶(12 mL/g软骨)37℃、5%CO2培养箱中消化90 min,600 r/min离心5 min。弃上清,用0.025%II型胶原酶(12 mL/g软骨)37℃、5%CO2培养箱中消化过夜,1200 r/min离心10 min。弃上清,D-Hanks液冲洗,吸取细胞悬液,经100 μm及40 μm细胞筛网过滤于无菌培养瓶内,加入原代软骨细胞培养液37℃、5%CO2培养箱中培养。
4 CTS加载
非手术侧膝关节软骨细胞为正常组,手术侧膝关节软骨细胞为造模成功的OA细胞,随机分为3组:OA+低应力组、OA+高应力组和OA对照组。各组细胞均按照1×105/cm2分别接种于6孔BioFlex培养板上,在培养箱内培养约60~72 h,当软骨细胞达到75% ~80%融合时,吸去原培养基,更换无血清培养液使细胞同步化,12 h后开始加载CTS:OA+低应力组为 sin10%、0.1 Hz、6 h/d,OA+ 高应力组为sin10%、1.0 Hz、6 h/d,正常组与 OA 对照组不予处理,见图1。首次加载CTS后24 h、1周和2周将各板细胞分装于Eppendorf管,-20℃冻存以备检测。
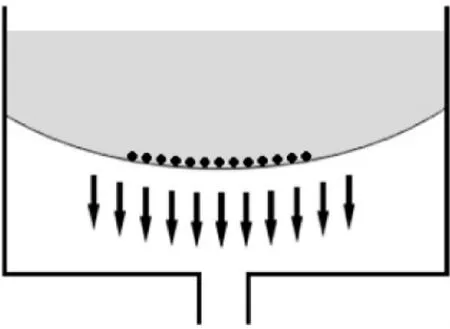
Figure 1.Schematic Flexercell-4000 system.Flexercell flexible hydrophilic cell culture plate surface can reach 200%of the basement membrane elongation and suction gas in the sealed cavity between the basement membrane and the base which resulting a negative pressure and substrate deformation.The gas suction rate through software could be controlled to adjust the bottom of the vertical elastic deformation and the ultimate strength of the force control cells.图1 Flexercell-4000型力学加载系统示意图
5 RT-PCR测定MMP13 mRNA及p38 MAPK表达
按试剂盒说明书操作,用Trizol试剂提取总RNA,取1 μL RNA样品50倍稀释,在Bio-Photometer Plus核酸蛋白测定仪上测定A值并与内参照(glyceraldehyde-3-phosphate dehydrogenase,GADPH)同时扩增。MMP-13引物序列正义链 5'-AGGAGCATGGCGACTTCTAC -3',反义链 5'-TAAAAACAGCTCCGCATCAA-3'。p38 MAPK引物序列正义链5'-GATCAGTTGAAGCTCATTTTAA -3',反义链 5'-CACTTGAATAATATTTGGAGAGT-3',片段长度479 bp。GAPDH 引物序列正义链5'-CAAGATTGTCAGCAACGCAT-3',反义链5'-ACAAAGTGGTCATTGAGGGC -3',片段长度 231 bp。扩增条件为:95 ℃1.5 min,55 ℃ 1 min,70 ℃ 1 min,40个循环。扩增完毕后检测p38 MAPK mRNA的表达:8 μL产物2%琼脂糖凝胶电泳,紫外线下摄像。以目的基因与内参照基因条带的积分吸光度比值检测基因的表达水平。
6 Western blotting法检测p38 MAPK磷酸化产物的表达
对上述提取mRNA的样品继续提取总蛋白并定量,经10%非变性SDS-PAGE,电转移至NC膜,特异性抗体杂交反应后ECL显色,将显影后所得条带经扫描保存为*.tiff文件后,采用Totallab 2.01图像分析软件对条带灰度进行分析和比较。
7 统计学处理
采用SPSS 13.0统计软件包进行统计学分析。数据以均数±标准差()表示,分别对各组检测结果的数据进行单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 大体观察
非手术侧膝关节无明显关节积液及滑膜增生,关节软骨面光滑,色泽明亮,而手术侧膝关节术后均肿胀变形,在第10周时关节软骨均失去原有光泽,颜色明显变暗,肉眼观有粗糙感,股骨内外髁部均有圆形软化灶,股骨双髁及胫骨内髁关节表面软骨有缺损,软骨下骨外露,见图2,关节液增多,关节囊、滑膜增生,血管翳形成明显。以上结果显示OA模型造模成功。
2 各组细胞MMP-13表达
加载CTS 24 h后,正常组和OA对照组之间的MMP-13的表达差异有统计学意义(P<0.05);加载CTS 2周后OA+低应力组和OA+高压力组之间差异有统计学意义(P<0.05);同时发现,OA+低应力组MMP-13的表达持续下降,加载CTS 24 h与2周之间的差异有统计学意义(P<0.05),见表1。
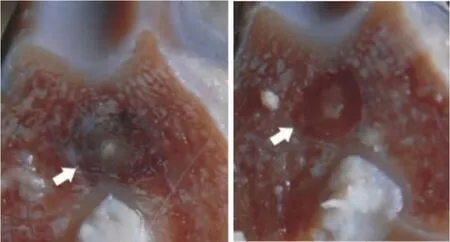
Figure 2.Model of rabbit osteoarthritis.Articular cartilage lost the original luster which was dark and with a rough sense.Round malacia and cartilage defects could be found on femoral bicondylar and tibial articular surface.图2 兔骨性关节炎模型
表1 不同时点各组MMP-13表达Table 1.Expression of MMP-13(.n=5)

表1 不同时点各组MMP-13表达Table 1.Expression of MMP-13(.n=5)
*P <0.05 vs normal;△P <0.05 vs OA+high CTS;#P <0.05 vs 24 h OA+low CTS.
Group 24h 1 week 2 weeks Normal 0.102±0.035 0.113±0.021 0.103±0.013 OA+low CTS 0.729±0.007 0.518±0.025 0.210±0.045△#OA+high CTS 0.953±0.036 1.007±0.031 1.002±0.006 OA control 0.712±0.017* 0.627±0.021 0.793±0.045△
3 各组软骨细胞p38 MAPK的表达
OA对照组p38 MAPK表达(1.013±0.012)与正常组相比差异有统计学意义(P<0.01);加载CTS 1周后OA+高应力组(1.092±0.003)和 OA+低应力组(0.882 ±0.012)的差异有统计学意义(P<0.05);加载CTS 2周后,p38 MAPK在OA+低应力组和OA对照组分别为0.672±0.011和1.077±0.012,两组之间有显著差异(P <0.01),见图3。

Figure 3.Expression of p38 MAPK..n=5.**P<0.01 vs normal;△P <0.05 vs OA+high CTS.▲▲P <0.01 vs OA control.图3 各组p38 MAPK的表达
4 各组软骨细胞p38 MAPK磷酸化产物的表达
p38 MAPK磷酸化产物在对照组和OA+高应力组持续表达,而在3个时点OA+低应力组的p38 MAPK磷酸化产物的表达呈下降趋势,见图4。
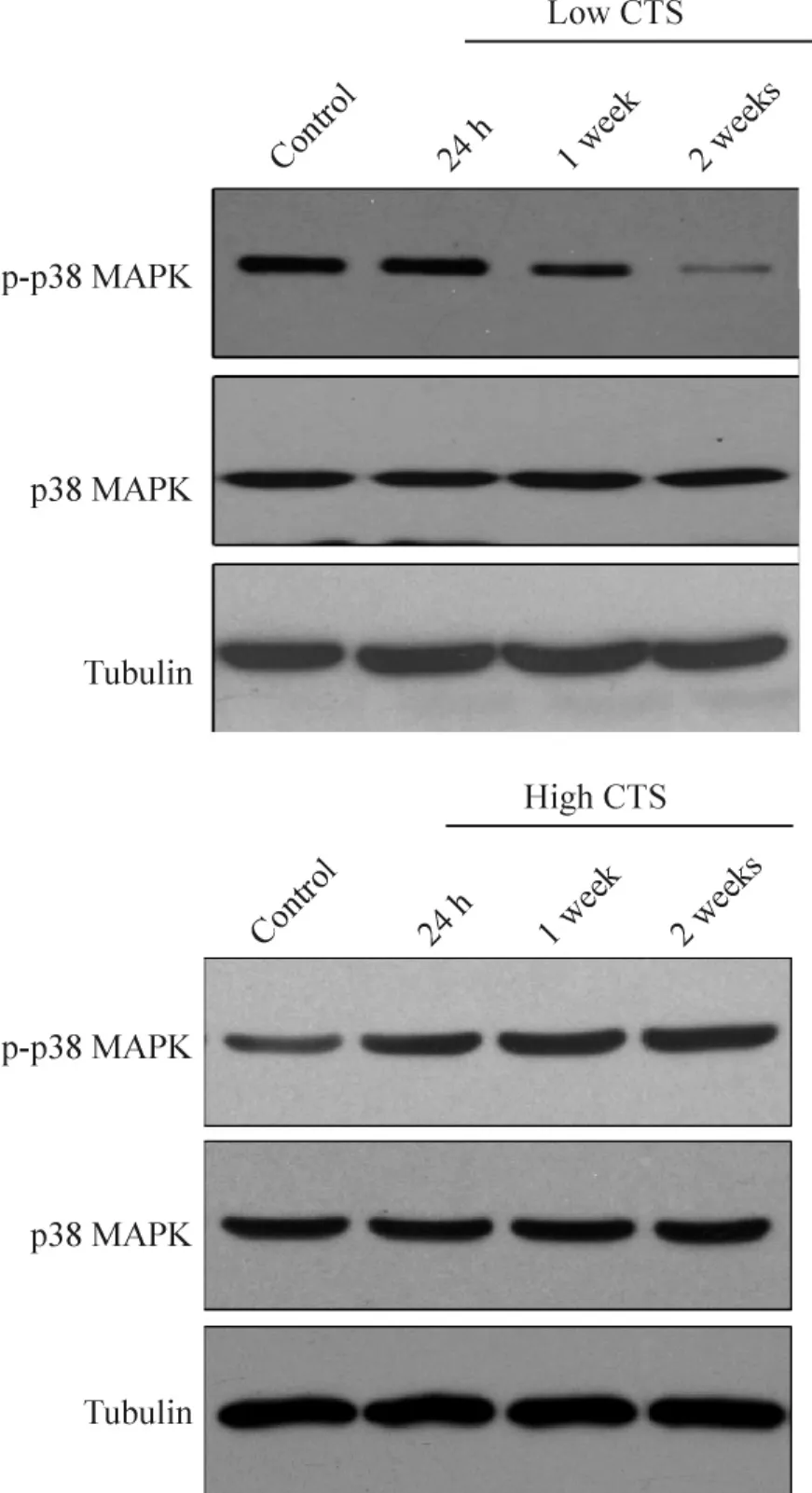
Figure 4.Expression of phospho-p38 MAPK.图4 磷酸化p38 MAPK的表达
5 p38 MAPK及其磷酸化产物的比值
当CTS载荷为1.0 Hz,3个时点p38 MAPK磷酸化产物与p38 MAPK的比例分别为1.083±0.003、1.069±0.006和1.051±0.011,而强度为 0.1Hz时,比例为 1.072±0.008、1.043±0.004和1.031±0.002。各时点两组数据之间的差异有统计学意义(均P<0.05),见图5。
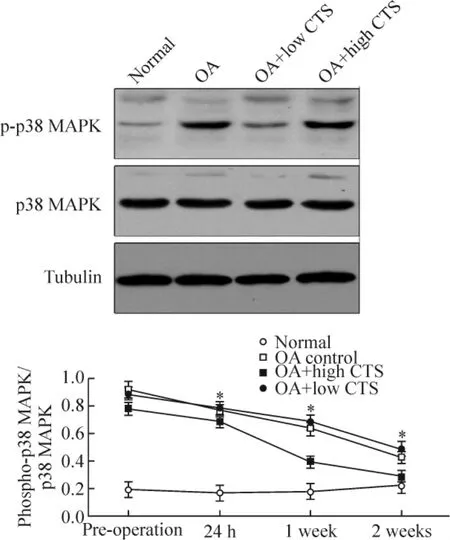
Figure 5.Ratio of p38 MAPK and phospho-p38 MAPK..n=5.*P <0.05 vs OA+high CTS.图5 p38 MAPK及其磷酸化产物的比值
讨 论
在骨性关节炎的发生和发展过程中,力学因素的作用不容忽视,一方面力学载荷使关节软骨基质中的黏多糖含量减少,硫酸软骨素丧失,纤维成分增加,而细胞外基质(extracellular matrix,ECM)各成分的失衡则进一步影响各层软骨细胞的活性,最终导致软骨细胞凋亡与基质崩解;另一方面,力学载荷可影响ECM和软骨细胞的合成,而同时ECM和软骨细胞也影响着力学载荷对细胞的代谢作用[4]。有研究发现在软骨分泌的基质分子组成的胶原网中,基质分子遵循有利于软骨力学功能的原则在胶原网结构中沉积[5],这说明当力学信号传导至软骨细胞表面时,其力学效应通过某种转导途径进入细胞核,再进一步调节各种基因表达从而对力学信号做出反馈,即力学信号-生物学信号-基因表达-生物学效应。
正常关节中MMPs与金属蛋白酶组织抑制因子(tissue inhibitor of metalloproteinase,TIMPs)的表达量极低。由于各种理化因素的影响,MMPs与TIMPs之间的动态平衡被打破,导致关节软骨ECM过度降解。大量研究证实,MMPs的过度表达可导致软骨逐渐出现炎症、溃疡、缺损等一系列退行性变[6]。p38 MAPK作为MAPK家族的重要成员,可以调节包括MMPs与TIMPs在内的多种转录因子及蛋白酶活性,调控细胞多种生理和病理过程[7]。当软骨细胞受到力学刺激后,细胞膜表面的力感受器整合素(integrin)通过FAK/SOS/Ras等通道,促使MAPKKK-MAPKK-MAPK的级联磷酸化。激活的p38 MAPK结合并进一步磷酸化作用底物,底物再与各自的特异性目标结合,引起不同的细胞病理生理反应[8]。MMPs已知有26种,根据其蛋白结构和作用底物的特异性可以分为5个亚型,其中MMP-13的水解底物均为纤维类胶原,并且是MMPs级联激活途径中的关键MMPs[5],我们在前期研究中发现,在关节软骨缺损和OA的动物模型中,关节滑膜中的MMPs mRNA含量较正常滑膜组织明显增高[2]。因此我们认为在此过程中,MAPK信号转导途径作为MMPs的上游事件起到了关键作用。本实验在不同时点进一步检测各组MMP-13表达时发现,术后24 h正常组与OA对照组差异有统计学意义(P<0.05),并且术后2周OA+低应力组与OA+高应力组表达也存在显著差异(P<0.05),更值得一提的是,MMP-13在OA+低应力组的表达随着时间的推移而逐渐降低,与此同时,OA软骨细胞p38 MAPK及其磷酸化产物的mRNA表达水平明显高于正常软骨细胞,两者差异有统计学意义(P<0.05),这可能与OA软骨细胞中由炎症介质(目前多认为是白细胞介素)介导的Janus激酶(JAK)通过磷酸化激活信号转导子和转录激活子(signal transducer and activator of transcription,STAT)有关[9],而在此过程中 JAK 激活后通过信号交联MAPK的级联激活过程,上调p38 MAPK与其磷酸化产物的表达,最终使MMP-13的表达增加。
此外,实验结果还表明不同强度的应力载荷对OA软骨细胞产生的生物学效应亦有差别(图4)。在应力的作用下,p38 MAPK逐步磷酸化,活化的激酶随后转移入胞核,通过活化转录因子调控特定基因的表达,从而将力学信号刺激从细胞外传到细胞核,并介导产生包括MMPs在内的多种炎症因子。本实验中加载CTS后磷酸化p38 MAPK与p38 MAPK的比值高应力组与低应力组之间的差异有统计学意义(P<0.05),表明当应力刺激增高时,p38 MAPK磷酸化产物增多,下游产物(MMP-13)的活化和表达随之增多,而炎症因子的过度表达又可以通过正反馈促进MAPK的级联磷酸化过程,进一步激活p38 MAPK,或者通过不同的信号转导通路调控特定的基因表达,如白细胞介素介导的JAK磷酸化,最终导致基质崩解与软骨细胞凋亡[10]。
综上所述,在软骨疾病和损伤发生、发展和修复的过程中,力学刺激始终扮演着重要角色。本实验通过研究软骨细胞在细胞分子水平上与力学环境的相互作用特点,初步阐明了力学信号-生物学信号-基因表达-生物学效应过程中OA与应力相互影响的“恶性循环”。本实验的缺点在于未能对应力强度做出定量的衡量,我们将在下一步研究中着重探讨。
[1]Drury JL,Mooney DJ.Hydrogels for tissue engineering:scaffold design variables and applications[J].Biomaterials,2003,24(24):4337 -4351.
[2]刘兴漠,项禹诚,麦海民,等.关节软骨-骨一体化修复体修复全层关节软骨缺损的实验研究[J].中华骨科杂志.2011,31(4):365-371.
[3]Kyriakis JM,Avruch J.Mammalian mitogen- activated protein kinase signal transduction pathways activated by stress and inflammation[J].Physiol Rev,2001,81(2):807-869.
[4]Cuenda A,Rousseau S.p38 MAP-kinases pathway regulation,function and role in human diseases[J].Biochim Biophys Acta,2007,1773(8):1358 -1375.
[5]Han J,Lee JD,Bibbs L,et al.A MAP kinase targeted by endotoxin and hyperosmolarity in mammalian cells[J].Science,1994,265(5173):808 -811.
[6]Lee JC,Laydon JT,McDonnell PC,et al.A protein kinase involved in the regulation of inflammatory cytokine biosynthesis[J].Nature,1994,372(6508):739 -746.
[7]Rouse J,Cohen P,Trigon S,et al.A novel kinase cascade triggered by stress and heat shock that stimulates MAPKAP kinase-2 and phosphorylation of the small heat shock proteins[J].Cell,1994,78(6):1027 - 1037.
[8]Freshney NW,Rawlinson L,Guesdon F,et al.Interleukin-1 activates a novel protein kinase cascade that results in the phosphorylation of Hsp27[J].Cell,1994,78(6):1039-1049.
[9]Wada Y,Shimada K,Sugimoto K,et al.Novel p38 mitogen-activated protein kinase inhibitor R2130823 protects cartilage by down-regulating matrix metalloproteinase-1,-13 and prostaglandin E2production in human chondrocytes[J].Int Immunopharmacol,2009,6(2):144 -155.
[10]Link DP,Strandberg JD,Virmani R,et al.Histopathologic appearance of arterial occlusions with hydrogel and polyvinyl alcohol embolic material in domestic swine[J].J Vasc Interv Radiol,2009,7(6):897 -905.

