高碱氧化铜矿堆浸过程中的化学沉淀与调控
吴爱祥,王少勇,尹升华,严佳龙
(北京科技大学 土木与环境工程学院,金属矿山高效开采与安全教育部重点实验室,北京,100083)
堆浸技术的成功与否主要取决于两个方面:一方面是溶浸液对有用矿物的溶解能力;另一方面是溶浸液在矿堆中的渗透效果。当溶浸液对矿石中有用物质的溶解能力一定时,决定堆浸效果好坏则取决于溶浸液在矿堆中的渗透效果。浸堆渗透性主要受物理堵塞与化学堵塞影响,物理堵塞[1]是指细颗粒或悬浮物随溶浸液的渗流发生迁移,拥挤附着在渗流通道,减小了渗流通道断面或者完全堵塞通道;化学堵塞[2-3]主要指溶于水中的某些化学物质,在条件改变时变成不溶解的固体沉淀物,附着在矿石表面,从而降低浸堆孔隙率。针对堆浸过程中物理堵塞机理,国内外学者都已做了大量的研究。吴爱祥等[4-5]分析了堆浸过程溶液渗流影响因素及堵塞机理,探讨了改善浸堆渗透性的途径。王贻明等[6]对堆浸过程中微细粒沉积机理进行了研究。Aberg[7-9]分析了矿物颗粒结构并将颗粒划分为松散颗粒和骨架颗粒2种,认为松散颗粒在浸出过程中发生运移堵塞骨架颗粒孔隙是造成物理堵塞的主要原因。化学堵塞对浸堆渗透性的影响越来越受到重视,其研究尚处于起步阶段。Watling等[10]通过QEMScan分析仪研究了矿石浸出以后表面的化学沉淀情况。Antonijevic等[11]通过X线衍射等手段研究了柱浸过程中矿石表面元素以及物质变化情况,研究发现浸过的矿石表面有硫酸钙沉淀。余润兰等[12]研究了铀矿堆浸中的沉淀物特性,其堆浸结垢矿物呈棕褐色,质地致密坚硬,渗透性差,通过X线衍射谱图表明:结垢工艺矿物主要为伊利石,含石膏、石英和长石。刘迎九等[13]研究认为,酸法地浸中的化学堵塞分为暂时性和永久性两种,暂时性堵塞由铁、铝、铀氢氧化物的沉淀引起的,受溶液 pH控制,而永久性堵塞由石膏沉淀引起的,主要表现为石膏堵塞,并且石膏在矿物颗粒表面生成一层薄膜,阻碍硫酸与矿物的反应自由进行。针对沉淀的处理与防治,Nicholas等[14]申请的专利在加压浸出过程中采用膦酸类防垢剂防止浸出容器壁上碳酸钙形成、沉淀和附着。田新军等[15]分析了铀矿地浸过程中化学堵塞成因,提出了用CO2调节溶浸剂pH来减少或避免化学沉淀堵塞的技术措施。薛臣等[16]申请的专利采用三聚磷酸钠作为除垢剂消除钙离子沉淀的影响。本文作者对云南某高碱氧化铜矿堆浸过程中的化学堵塞进行了研究,通过电镜扫描及X线衍射等分析手段,探明了化学沉淀成分及生成机理,并选用多种防垢剂对化学沉淀进行调控,取得了很好效果。对成功处理高碱氧化铜矿堆浸过程中的化学堵塞具有重要的指导意义。
1 实验
1.1 实验仪器
仪器有:扫描电镜、X线衍射仪、电子天平、空气浴振荡器、250 mL锥形瓶、有机玻璃柱等。
1.2 实验材料
矿样取自云南某铜矿堆场,进行全元素分析,其矿物成分如表 1所示。矿石中主要成分是 SiO2和Fe2O3,其次为 CaO 和 Al2O3,碱性脉石矿物成分Al2O3+CaO+MgO含量高达19.65%以上,为高碱氧化铜矿,是造成大量化学沉淀的主要原因之一。
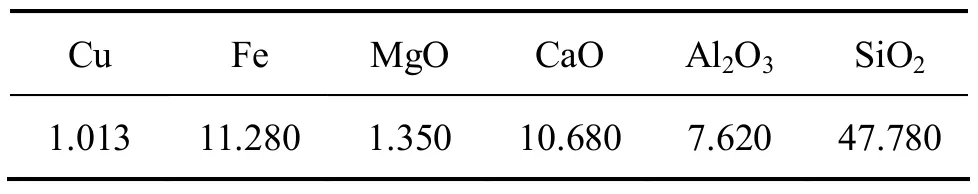
表1 矿石主要化学成分(质量分数)Table 1 Chemical composition of ore %
采用防垢剂可以一定程度上防止结垢产生,对于硫酸盐类结垢沉淀,随着人们对共聚物结构及阻垢机理的研究发现,共聚物结构与阻垢剂性能关系极为密切,共聚物中的羧酸官能团是阻CaCO3和CaSO4垢的主要官能团,而羟基、酰胺基等对阻Ca3(PO4)2垢有益,特别是磺酸基对Ca3(PO4)2垢有良好的抑制能力。在此基础上选取合适的防垢药剂进行试验,主要的防垢剂类型如表2所示。
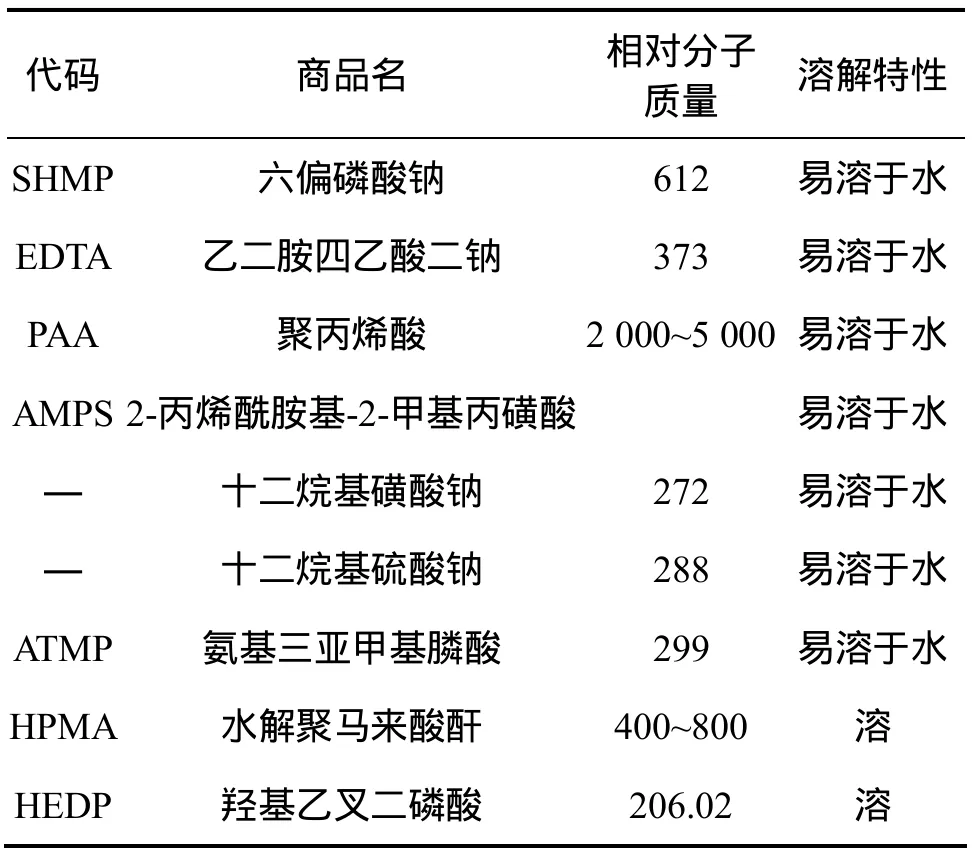
表2 防垢剂性质一览表Table 2 Characters of different kind anticrustator
1.3 实验方法
1.3.1 摇瓶实验
摇瓶实验是实验室常用的浸矿实验方法,它是研究矿石浸出最简单快速的方法。首先,将矿石破碎到74 μm的粒径,分成10份装入250 mL的锥形瓶中,采用液固比为4:1,酸质量浓度为16 g/L,保证浸出结束后溶液pH保持在4~5。其次,加入相同量不同种类的防垢剂后,放入摇床,在常温和150 r/min条件下浸出2 h后停止,滤干矿浆,采用离子色谱仪测试浸出液中Ca2+的含量,比较防垢剂对矿物中的钙的溶解能力,选择溶解能力最大的防垢剂。
1.3.2 柱浸实验
柱浸实验是地浸和堆浸的室内模拟重要实验方法,实验装置采用自制有机玻璃材质的柱子进行,其内径为60 mm,高为550 mm。为了消除边壁效应,一般取浸柱内径为矿石最大直径的4~6倍,内径为60 mm,高为550 mm。将矿石倒入浸矿柱中,装矿高度在浸柱的2/3高度处,每组装矿1 200 g,矿石表面铺上一层纱布,以便让溶浸液均匀流过矿石。配制20 g/L的溶浸液,使用的液固比约为5:1。打开上位箱的阀门,按20 L/(m2·h)的喷淋强度开始喷淋,每隔2~3 d取样一次,采用离子色谱仪化验浸出液中的Cu2+和Ca2+含量。运用 SEM 电镜扫描技术,观察添加防垢剂前后矿石表面形貌变化特征并分析其表面元素成分变化。
1.3.3 评价准则
参考水处理行业标准[17],评定防垢剂防垢性能的常用方法主要有:静态防垢法、动态模拟法、临界pH法、鼓泡法、极限碳酸盐硬度等。其中静态防垢法是目前广泛使用的方法,根据下式计算Ca2+浓缩倍数:

式中:r为浓缩倍数;ρr为添加防垢剂后溶液中 Ca2+质量浓度,mg/L;ρo为添加防垢剂前溶液中Ca2+质量浓度,mg/L。
以 Ca2+的浓缩倍数表示防垢效果的好坏。Ca2+浓缩倍数越高,说明浸堆内部沉淀越少,防垢剂的防垢效果就越好。
2 结果与讨论
2.1 沉淀成分分析
堆浸过程中有化学反应的发生,其中Ca,Mg和Fe等矿物与酸发生反应容易产生胶状物或不溶于水的沉淀,积聚在矿物表面,一是阻碍酸与有用矿物的接触,降低反应速率;第二是阻碍渗流通道,降低浸堆的渗透性。堆浸过程中化学沉淀主要包括二大类[18],第一类是脉石矿物与酸作用生成难溶物质,第二类是铁被浸出并形成胶体不稳定沉淀物。

当溶液pH较高时,Fe3+发生水解反应,会形成氢氧化铁胶体:

Fe(OH)3在溶液中不稳定,与溶液中的,Fe3+和NH4+发生反应,将生成铵黄钾铁钒沉淀。
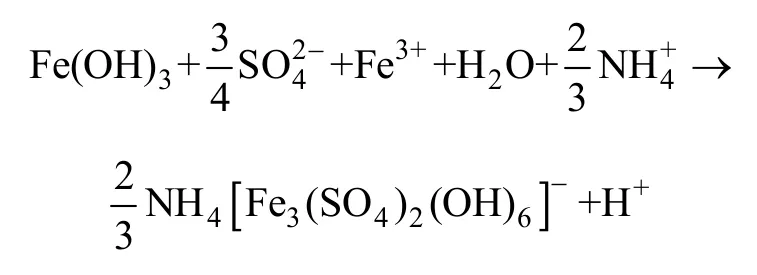
第一类化学沉淀物会随着溶液pH降低而加剧,酸度越大,脉石溶解程度较高,形成的沉淀量大。第二类化学沉淀物与第一类的变化规律相反,pH较低,铁的水解程度较低,形成的铁矾沉淀量小。应该特别说明,Fe(OH)3很容易形成草黄铁矾,一旦形成,则稀硫酸很难使其溶解。
图1所示为原矿与结垢矿石表面的形貌。可见:原矿表面光滑,浸出反应后结垢矿物表面出现大量柱状晶体,在浸出过程中产生大量覆盖层,表面较为粗糙;从图1(b)和(d)可以看出:元素分布的特征,结垢矿物表面Ca元素含量是原矿的5倍。Fe元素的含量与原矿基本一致,这与现场测试结果相吻合,通过对现场浸堆料液进行化验,其中 Fe3+,Fe2+质量浓度分别为1.46 g/L和0.94 g/L,含量为39.16%和60.84%,可见大部分Fe随着浸出液流出了矿堆, 矿石表面沉淀不明显。初步确定为CaSO4沉淀的发生。CaSO4有3 种形态:CaSO4·2H2O,CaSO4·0.5H2O 和无水 CaSO4,这3种晶形的溶解度都随温度的升高而降低,其中无水CaSO4的成核诱导期非常缓慢,而其余两种晶形却易于形成沉淀析出。
为了准确判断结垢物质的化学成分,采用X线衍射对矿石表面沉淀进行粉末衍射分析,衍射分析结果如图2所示。衍射矿物主要是SiO2,CaSO4·2H2O以及SiS2,SiO2主要是由于粉末衍射制样时将矿石基岩混入,原矿中CaSO4·2H2O含量极少,因此,可以判断矿石表面主要物质是CaSO4·2H2O。这与Pavlos等[19]和Antonijevic等[11]的研究结果相吻合,文献[19]的研究结果也表明,在25~80 ℃的温度段内,析出晶体的晶形为 CaSO4·2H2O。
2.2 CaSO4·2H2O 沉淀特性
2.2.1 CaSO4·2H2O沉淀与过饱和度的关系
定义硫酸钙溶液过饱和度s为:

式中:Ksp为 CaSO4·2H2O 在 25 ℃时的溶度积(Ksp=2.4×10-5)。
定义相对过饱和度δ为:

图1 浸出前后矿石表面形貌及能谱Fig.1 SEM images and energy spectra of ore surface before and after leaching

图2 矿石沉淀部位粉末X线衍射谱Fig.2 XRD pattern of precipitation on ore surface

图 3所示为不同过饱和度下析晶动力学实测曲线[20]。从图3可以看出:实验的前半阶段则表现为平台期,通常把这段时间称为临界时间,用τ表示。后半阶段表现为晶体析出的过程,取曲线中最陡的斜率计算沉淀速率Rp。初始过饱和度越高,临界时间越短,沉淀速率越快[20-22]。根据 Nielsen理论,在临界时间内晶体生长是单核生长控制,则临界时间与温度及过饱和度有如下近似关系[23]:
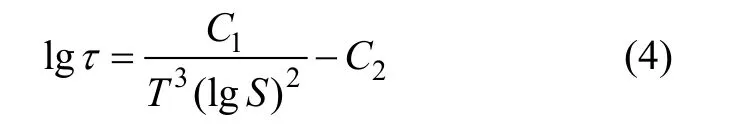
式中:C1和C2相对S是常数,其中C1由下式给出

式中:V为硫酸钙分子体积(7.632×10-29m3);σ为表面自由能;β为结构常数(球形结构用 16π/3);k为(Boltzmann)常数(1.38×10-23J/K);ν为硫酸钙离子个数(ν=2)。
2.2.2 晶体生长速率与过饱和度的关系
在晶体生长阶段,晶体生长速率Rp常用相对过饱和度δ的幂指数表示:
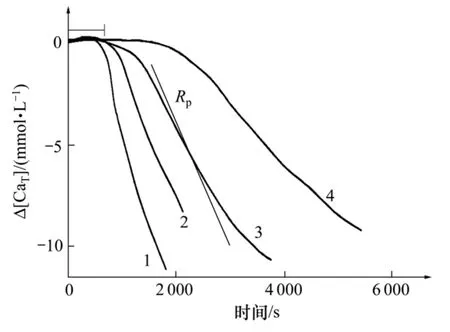
图3 不同过饱和度下析晶动力学实测曲线[20]Fig.3 Crystallization curves of different supersaturations[20]

式中:kp是速率常数。
2.2.3 硫酸钙晶体生长机制
晶体生长的机制可能由扩散控制、表面单核生长控制、表面多核生长控制。硫酸钙晶体的沉淀过程受何种机制控制,这是一个有争议的问题。Nielsen导出了这3种生长机制中相应的无量纲时间Id()α,Im()α和Ip()α的表达式,可以作为晶核生长机制的判据[23]
指标Id()α的计算式为:
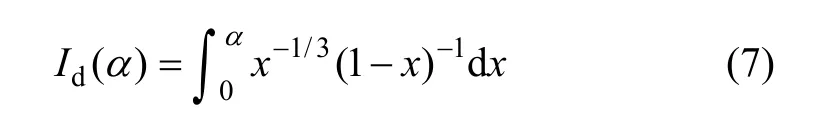
当晶体生长由扩散过程控制时,Id与时间 t呈线性关系。α为沉淀程度,定义为:

式中:[CaT]t, [C aT]0与[CaT]s分别表示时刻 t、初始时刻以及在平衡时(s=1)的总钙浓度。
对于时刻 t,计算了α(t),采用梯形近似求积法计算 Id。在α从 1%~20%广阔范围内,Id与 t显示了清晰的线性关系。说明在CaSO4的析晶过程中,扩散控制机制是晶核生长的主导机制。
2.3 沉淀调控实验
表3所示为防垢剂对CaSO4·2H2O沉淀溶蚀效果。从表3可以看出:添加防垢剂的实验组,Ca2+质量浓度要比不添加防垢剂的对照实验组1组的高,说明防垢剂起了重要的作用。溶液中Ca2+质量浓度是未添加防垢剂对照实验组的 1~12倍,其中添加水解聚马来酸酐的溶液中Ca2+质量浓度最高,达到5.327 g/L,浓缩倍数更是达 1 078.54%,是所选防垢剂作用效果最好的。
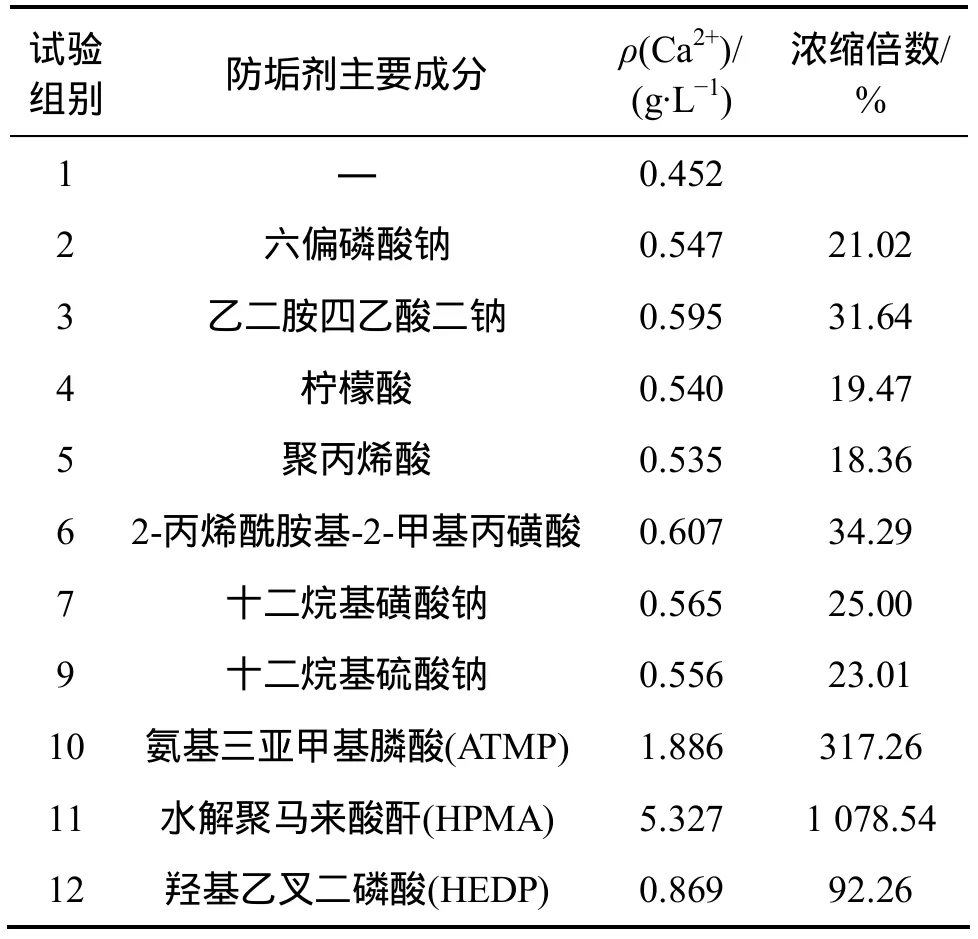
表3 防垢剂对CaSO4·2H2O沉淀溶蚀效果Table 3 Corrosion effect of anticrustator to CaSO4·2H2O
通过摇瓶实验得出:HEDP,ATMP和 HPMA 3种防垢剂的防垢效果较好,因此,将其用于溶浸柱中进行堆中浸出模拟实验。图4所示为防垢剂添加量与溶液中Ca2+浓度关系。从图4可以看出:随着防垢剂添加量的增加,溶液中Ca2+浓度呈指数趋势增加,其拟合指数方程见式(9),相关性系数在0.97以上。可以看出防垢剂HPMA作用效果最为明显,添加很少的量便可以迅速溶解 CaSO4·2H2O沉淀,其次是 ATMP,最后为HEDP。
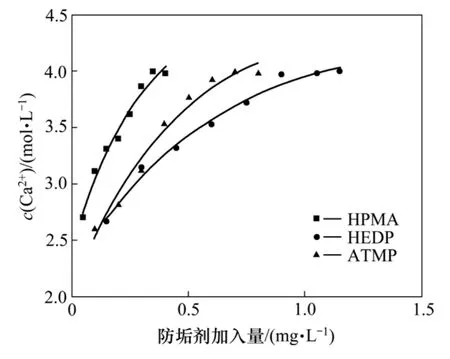
图4 防垢剂添加量与溶液中Ca2+浓度关系Fig.4 Relationship between anticrustator additive amount and Ca2+ concentration

2.4 表面形貌变化特征
分别从2个浸出柱中取样,对柱浸实验中的矿石进行电镜扫描,观察加入防垢剂前后矿石表面形貌变化特征。如图5所示,反应前矿石表面平滑,未出现结晶现象。开始反应后,未加防垢剂的矿石表面CaSO4结晶发育,呈典型的六面体晶体。加入防垢药剂以后晶体生长受到抑制,CaSO4垢的晶形变得不规则,呈团状,而且垢质相对疏松,这样生成的垢不是硬垢而是软垢,很容易随着浸出液流出浸堆。这是因为药剂螫合作用使按严格次序排列的 CaSO4·2H2O结晶不能再继续按正常规则增长了,产生的只是非结晶颗粒结垢晶体形成“坍塌”,从而有效防止沉淀大量结晶并附着在矿石表面进而形成堵塞。

图5 加入防垢剂前后矿石与未反应原矿表面形貌Fig.5 SEM images of ore surface before and after anticrustator added
3 结论
(1) 脉石矿物与酸反应生成的沉淀物及 Fe3+胶体是化学沉淀的主要来源,通过对浸出后矿石表面元素分析,发现Fe元素的含量浸出前后相差不大,而Ca元素含量是浸出前的5倍,且浸出矿物表面出现大量柱状晶体,断定 CaSO4·2H2O沉淀是堆浸过程中化学沉淀的主要成分。
(2) 扩散控制机制是 CaSO4晶核生长的主导机制,添加防垢剂对能很好的溶解浸堆中的 Ca沉淀,其中HPMA水解聚马来酸酐效果最优,Ca2+浓缩倍数最大可达1 078.54%,防垢剂添加量与CaSO4溶解量呈指数关系。
(3) 添加防垢剂以前,矿石表面易形成CaSO4·2H2O柱状结晶体,添加防垢剂能很好地促进矿石表面CaSO4·2H2O沉淀结晶体出现溶解“坍塌”,使沉淀变成可流动的微颗粒,随着浸出液流出浸出,降低了发生化学堵塞的几率。
[1]陈喜山. 论堆浸工艺中溶浸液的渗透问题[J]. 黄金, 1997,12(18): 37-40.CHEN Xi-shan. The infiltrating problem of leaching solution in heap leaching technology[J]. Gold, 1997, 12(18): 37-40.
[2]Rinck-Pfeiffer S, Ragusa S, Sztajnbok P, et al. Interrelationships between biological chemical and physical processes as an analog to clogging in aquifer storage and recovery (ASR) wells[J].Water Research, 2000, 34(7): 2110-2118.
[3]Pavelic P, Dillon P J, Barry K E, et al. Water quality effects on clogging rates during reclaimed water ASR in a carbonate aquifer[J]. Journal of Hydrology, 2007, 334(1/2): 1.
[4]吴爱祥, 李青松, 尹升华, 等. 改善高泥矿堆渗透性的机理研究[J]. 湘潭矿业学院学报, 2003, 18(2): 1-5.WU Ai-xiang, LI Qing-song, YIN Sheng-hua, et al. Study on the mechanism of improving the penetrability of the high-clay ore heaps[J]. Journal of Xiangtan Mine Inst, 2003, 18(2): 1-5.
[5]吴爱祥, 尹升华, 李建锋. 离子型稀土矿原地溶浸溶浸液渗流规律的影响因素[J]. 中南大学学报: 自然科学版, 2005,36(5): 506-510.WU Ai-xiang, YIN Sheng-hua, LI Jian-feng. Influential factors of permeability rule of leaching solution in ion-absorbed rare earth deposits with in-situ leaching[J]. Journal of Central South University: Science and Technology, 2005, 36(5): 506-510.
[6]王贻明, 吴爱祥, 左恒, 等. 微粒渗滤沉积作用对铜矿排土场渗流特性的影响[J]. 中国有色金属学报, 2007, 17(12):2074-2078.WANG Yi-ming, WU Ai-xiang, ZUO Heng, et al. Effect of particles sedimentation during leaching on seepage characteristic of copper dumps[J]. The Chinese Journal of Nonferrous Metals,2007, 17(12): 2074-2078.
[7]Aberg B. Void ratio of noncohesive soils and similar materials[J].Journal of Geotechnical Engineering, ASCE, 1992, 118(9):1315-1334.
[8]Aberg B. Hydraulic conductivity of noncohesive soils[J]. Journal of Geotechnical Engineering, ASCE, 1992, 118(9): 1335-1347.
[9]Aberg B. Washout of grains from filtered sand and gravel materials[J]. Journal of Geotechnical Engineering, ASCE, 1993,119(1): 36-53.
[10]Watling H R, Elliot A D, Maley M, et al. Leaching of a low-grade, copper-nickel sulfide ore: Key parameters impacting on Cu recovery during column bioleaching[J]. Hydrometallurgy,2004, 97: 204-212.
[11]Antonijevic M M, Bogdanovic G D. Investigation of the leaching of chalcopyritic ore in acidic solutions[J].Hydrometallurgy, 2004, 73: 245-256.
[12]余润兰, 刘松军, 曹钰, 等. 铀矿酸法堆浸中结垢的形成及其预防[J]. 铀矿冶, 1998(1): 24-31.YU Run-lan, LIU Song-jun, CAO Yu, et al. Incrustation for uranium ore acid heap leaching: Formation and precaution[J].Uranium Mining and Metallurgy, 1998(1): 24-31.
[13]刘迎九, 谢水波, 周泉, 等. 某铀矿床酸法地浸现场试验及化学堵塞成因分析[J]. 南华大学学报: 自然科学版, 2007, 21(1):10-15.LIU Ying-jiu, XIE Shui-bo, ZHOU Quan,et al. The field test of acid in-situ leaching in the uranium deposit and study on the chemical jamming [J]. Journal of University of South China:Science and Technology, 2007, 21(1): 10-15.
[14]Alfano N J, Boffardi B P. Scale control in gold and silver mining heap leach and water circuits using polyether polyamino methylene phosphonates: USA, 5368830[P]. 1994-11-29.
[15]田新军, 沈红伟, 陈雪莲, 等. 用二氧化碳减缓碱法地浸采铀中的化学沉淀堵塞[J]. 铀矿冶, 2006, 25(1): 15-19.TIAN Xin-jun, SHEN Hong-wei, CHEN Xue-lian, et al. Using CO2for reducing chemical precipitation jamming in alkaline in-situ leaching of uranium[J]. Uranium Mining and Metallurgy,2006, 25(1): 15-19.
[16]薛臣, 郑晔, 王海东. 利用除垢剂消除黄金堆浸生产中钙离子影响: 中国, 200710055336.8[P]. 2007-08-08.XUE Chen, ZHENG Ye, WANG Hai-dong. Eliminating the effect of Ca2+in the process of gold heap leaching using anticrustator: China, 200710055336.8[P]. 2007-08-08.
[17]汪祖模. 水质稳定剂[M]. 上海: 华东化工学院出版社, 1991:52-55.WANG Zu-mo. Water quality stabilizer[M]. Shanghai: East China University of Science and Technology Press, 1991: 52-55.
[18]杨保华. 堆浸体系中散体孔隙演化机理与渗流规律研究[D].长沙: 中南大学资源与安全工程学院, 2009: 123.YANG Bao-hua. The evolution mechanisms of the pore structure of granular ore media and seepage rules in heap leaching system[D]. Changsha: Central South University. School of Resources and Safety Engineering, 2009: 123.
[19]Klepetsanis P G, Dalas E. Role of temperature in the spontaneous precipitation of calcium sulfate dehydrate[J]. Langmuir, 1999, 15:1534-1540.
[20]方健, 李广兵, 李杰. 硫酸钙晶体自发沉淀动力学研究[J]. 工业水处理, 2000, 20(10): 1-4.FANG Jian, LI Guang-bing, LI Jie. Kinetics of spontaneous precipitation of calcium sulfate dehydrate[J]. Industrial Water Treatment, 2000, 20(10): 1-4.
[21]Klepetsanis P G, Koutsoukos P G. Precipitation of calcium sulfate dihydrate at constant calcium activity[J]. Journal of Crystal Growth, 1989, 98: 480-486.
[22]Amathieu L, Boistelle R. Crystallization kinetics of gypsum from dense suspension of hemihydrate in water[J]. Journal of Crystal Growth, 1998, 88: 183-192.
[23]Nielsen A E. Kinetics of precipitation[M]. London Oxford:Pergamon Press, 1964: 1-53.

