添加铜镉锑对锌粉置换除钴的影响
胡根火,刘志宏,刘智勇,李玉虎,李启厚
(中南大学 冶金科学与工程学院,湖南 长沙,410083)
深度净化不仅可改善锌电解的技术经济指标和增加产量,也是实现机械化剥锌的先决条件[1],是硫酸锌电解液净化的主要发展趋势[2],对湿法炼锌工业具有重要意义。目前,国内外湿法炼锌厂采用的除钴方法归纳起来有2类[3-6]:一类是采用特殊的化学试剂如黄药和α-亚硝基β-萘酚净化除钴法;另一类是采用砷盐和锑盐等作活化剂的锌粉或合金锌粉置换除钴法。黄药和α-亚硝基β-萘酚净化除钴法,由于原料价格昂贵或操作环境恶劣,目前仅有少数工厂采用;砷盐净化法易产生剧毒 AsH3气体,安全及环保要求高,国内应用较少。基于安全、环保及经济等因素,以锑盐为活化剂的锌粉置换法是目前应用最广泛的除钴工艺(简称锑盐净化法)。在锑盐净化除钴中,国内外许多工厂都采用了向溶液中加入一定量硫酸铜或一段净化时保留少量铜和镉的方法,实现了深度净化除钴。关于其作用机理,开展了大量的研究。一些研究者认为,Cu2+的作用是降低Co的超电势,增大锌钴微电池电势差,从而增大置换过程的热力学推动力[1,7-9],Cd2+可起到阻止碱式硫酸锌或氢氧化锌吸附在锌粉表面的作用[10];另一些研究者认为,Cu2+和Cd2+首先被锌粉置换出来,形成 Co沉积的基底[11-14],提高锌粉净化除钴的速度。目前,国外对Cu2+和Cd2+在除钴过程中的作用研究较多,并且取得了较好的除钴效果,但对Cu2+和 Cd2+的加入量存在争议[14-16],国内对 Cu2+和 Cd2+在净化中的作用虽有研究,但在实际生产中不加或少加Cu2+和Cd2+,同时国内工业生产数据表明:钴离子净化水平(约 1 mg/L)远落后于发达国家的平均水平(0.27 mg/L)[17],鉴于此,有必要研究添加Cu2+和Cd2+及其相关影响因素对锑盐净化除钴的影响,为工艺改进提供基础数据。
1 试验
1.1 试验用原料及辅助材料
试验中所用试剂,包括 ZnSO4·7H2O,CuSO4·5H2O , 3CdSO4·8H2O , CoSO4·7H2O ,K(SbO)C4H4O6·0.5H2O,均为分析纯。试验采用配制的硫酸锌溶液,其中 Zn2+质量浓度为 140 g/L,Co2+质量浓度为16.7 mg/L,所用锌粉为取自某厂的电炉锌粉(粒度约为75 μm),其主要化学成分如表1所示;锌粉的比表面积采用美国康塔仪器公司Autosorb-1型自动比表面分析仪测定,其值为0.88 m2/g;锌粉粒度分布采用英国马尔文公司Mastersizer Microplus型激光粒度仪测量,如图1所示;锌粉形貌采用日本电子公司JSM-6360LV 扫描电镜观察,如图2所示。图1和图2表明:锌粉一次颗粒为球形,粒度小于10 μm,颗粒间呈“葡萄串”状团聚。
1.2 试验与分析方法
试验在1 L三口瓶中进行,三口瓶置于恒温水浴中,水浴温度自动控制。将500 mL预先配好的硫酸锌溶液(pH为4)加入到三口瓶中,按试验预定量以溶液的形式加入铜、锑和镉盐。启动恒温水浴升温,待溶液温度达到预定值时,启动搅拌机逐渐调至预定转速,称取一定量的锌粉直接加入溶液中,开始净化反应计时。在净化15,30,45,60和90 min时,用移液管取出10 mL的料液,过滤后再用移液管取出5 mL滤液,滤液中的Co2+浓度采用电感耦合等离子发射光谱仪(ICP,美国热电公司,IRIS Intrepid Ⅱ XSP )进行分析。
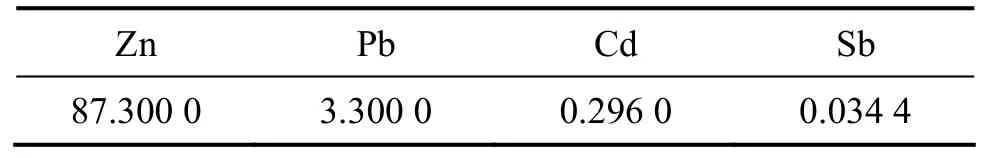
表1 试验所用锌粉的主要化学成分(质量分数)Table 1 Main chemical compositions of zinc dust used in experiments %

图1 锌粉的粒径分布Fig.1 Particle size distributions of zinc dust used

图2 锌粉的SEM形貌Fig.2 SEM photograph of zinc dust
2 结果与讨论
2.1 单独添加Cu2+对净化除钴的影响
2.1.1 初始Cu(II)离子质量浓度
在酒石酸锑钾质量浓度为3 mg/L,反应温度为85℃,锌粉用量为2 g/L,搅拌转速为300 r/min的条件下,考察初始 Cu(II)离子质量浓度(ρ(Cu2+)0)对净化除钴的影响,结果如图3所示。纵坐标是净化后溶液中残余Co(II)离子质量浓度(ρ(Co2+))与初始Co(II)离子质量浓度(ρ(Co2+)0)的比值。以下各图中出现的水平虚线均为硫酸锌溶液深度净化除钴目标值(ρ(Co2+)=0.1 mg/L)。

图3 ρ(Cu2+)0对净化除钴的影响Fig.3 Effect of ρ(Cu2+)0 on cobalt removal
从图3可看出:一定量的Cu2+对除钴有很明显的促进作用,除钴速率随ρ(Cu2+)0增加而迅速提高。当溶液中的ρ(Cu2+)0达到50 mg/L,反应进行到60 min时,已达到了深度净化水平,即ρ(Co2+)<0.1 mg/L,继续增加ρ(Cu2+)0,前45 min之内,除钴速率略有增加,并且反应45 min就已经达到了深度净化水平,但45 min之后,已沉积的钴会出现明显的返溶现象。这是因为Cu2+首先被锌粉置换,与Zn组成Cu-Zn微电池,沉积的铜成为微电池中Co2+沉积的阴极基底,Co在铜阴极上的析出有较正的电势,有利于钴的沉积;但是当Cu2+浓度高于一定范围时,反而对除钴有害,因为H+在Cu上的放电过电势低于在Zn上的放电过电势,所以Cu2+大量沉积会使H+大量放电,造成锌粉表面上的pH上升,而溶液中Zn2+浓度又很高,于是在锌粉表面形成碱式硫酸锌,减少了锌粉的活性表面,并且随着时间的延长,碱式硫酸锌的量越来越多,最终使Cu-Zn微电池不再起作用,而Co与Cu形成微电池,并作为阳极返溶,因此过多的Cu2+必然会引起钴的返溶[13]。由此可知,要达到钴的深度净化,加入一定量的Cu2+非常有必要,并且Cu2+用于锑盐净化除钴要控制在一定的浓度范围内,超过此范围,已沉积下来的钴会出现返溶。
2.1.2 锌粉用量
在酒石酸锑钾质量浓度为 3 mg/L,反应温度为85 ℃,搅拌转速为300 r/min,以及添加Cu2+和未添加Cu2+的条件下,考察锌粉用量对净化除钴的影响,结果如图4所示。
由图4可看出:在未添加Cu2+的条件下,除钴速率较低,随着锌粉用量增加,除钴速率逐渐提高,但锌粉用量为 2.5 g/L时,也不能在 90 min内达到ρ(Co2+)=0.1 mg/L,在添加Cu2+后,除钴速率明显提高,锌粉用量为1.5 g/L时的除钴速率比未添加Cu2+和锌粉用量为2.5 g/L时的除钴速率还要高,并且2 g/L以上的锌粉用量即可达到深度净化水平,达到ρ(Co2+)<0.1 mg/L的时间至少提前了30 min;从图4还可看出:当锌粉用量较少时,反应进行一段时间后,已沉积的钴都会出现明显的返溶,这说明锌粉实际上为钴的沉积起到了阴极保护作用。由此可知:在锑盐净化除钴时,锌粉用量和一定量的Cu2+对溶液的除钴速率和深度都有明显的影响,增加锌粉用量有利于深度净化,添加一定量的Cu2+不但能够明显提高除钴速率,而且可以用更少的锌粉用量来达到深度净化水平。

图4 不同锌粉用量和ρ(Cu2+)0对净化除钴的影响Fig.4 Effect of zinc dust dosage and ρ(Cu2+)0 on cobalt cementation
2.2 同时添加Cu2+和Cd2+对净化除钴的影响
在酒石酸锑钾质量浓度为 3 mg/L,反应温度为85 ℃,锌粉用量为2 g/L,搅拌转速为300 r/min的条件下,考察不同Cu2+和Cd2+添加量组合对净化除钴的影响,结果如图5~7所示。
从图5可看出:当同时添加Cu2+(ρ(Cu2+)0=15 mg/L)和 Cd2+(ρ(Cd2+)0=15 mg/L)时,能够获得比单独添加Cu2+(ρ(Cu2+)0=15 mg/L)时更快的除钴速率,且除钴效果好于单独添加 Cu2+(ρ(Cu2+)0=50 mg/L)时的除钴效果,这说明Cu2+和Cd2+对锑盐净化除钴的协同作用大于单独添加Cu2+时的作用,这可能是因为沉积的镉呈海绵状[18],表面具有很大的过剩能量,很容易沉积下来成为钴的载体,形成 CoxCuySbz金属间化合物,此化合物中,y比x和z大很多,而且分布极不均匀,使化合物中钴的活度减小,导致钴的析出电势正向移动[19],增大锌钴微电池电势差,从而使置换除钴过程更容易进行。由此可知:Cu2+和Cd2+对锑盐净化除钴的协同作用在工业生产上具有很重要的意义,因为在硫酸锌浸出液一段净化时,通过控制锌粉用量,保留一定量的 Cu2+和 Cd2+,这样不但能减少一段净化除Cu2+和Cd2+的锌粉消耗,同时可作为二段净化除钴时的添加剂,以期达到减少除钴的锌粉消耗、提高除钴速率及深度净化的目的。

图5 不同Cu2+和Cd2+添加量组合对净化除钴的影响Fig.5 Effect of Cu2+ and Cd2+ additives on cobalt cementation

图6 ρ(Cd2+)0对净化除钴的影响Fig.6 Effect of ρ(Cd2+)0 on cobalt removal
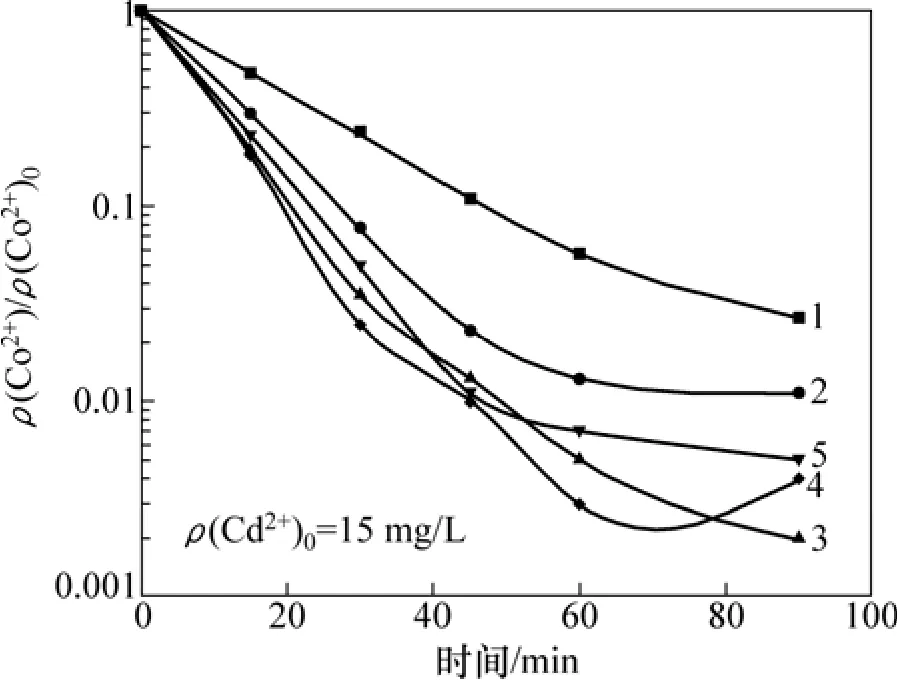
图7 ρ(Cu2+)0对净化除钴的影响Fig.7 Effect of ρ(Cu2+)0 on cobalt removal
由图6可知:固定ρ(Cu2+)0=15 mg/L,在一定的ρ(Cd2+)0范围内,除钴速率随ρ(Cd2+)0的增加而提高,且达到深度净化水平的最低ρ(Cd2+)0为15 mg/L,再增加ρ(Cd2+)0,如ρ(Cd2+)0为25 mg/L时,除钴速率变化不大且除钴效果有所下降;固定ρ(Cd2+)0=15 mg/L,由图7可知:除钴速率随ρ(Cu2+)0的增加而提高,达到深度净化水平所需的最低ρ(Cu2+)0为 15 mg/L,当ρ(Cu2+)0为25 mg/L时,除钴效果降低。因此,对于添加Cu2+和Cd2+用于锑盐净化除钴在85 ℃时的最佳条件为:ρ(Cu2+)015 mg/L和ρ(Cd2+)015 mg/L。超过此范围的ρ(Cu2+)0和ρ(Cd2+)0,除钴效果不明显或变差。这是因为,对于特定的锌粉和添加剂组合而言,锌粉表面的活化区域数量存在一个最大值[15]。Nelson等[14]假定钴的置换沉积与能吸附在锌粉表面的羟基络合物的形成有关,根据这个说法,过量的Cu2+或Cd2+之所以会产生负效果是因为所谓的竞争吸附现象所致,如果某种添加剂(如 Cd2+)的浓度太大,将造成其他添加剂(Cu2+和Sb3+)解吸,从而减弱置换反应强度。
2.3 温度对净化除钴的影响
在酒石酸锑钾3 mg/L,锌粉用量2 g/L,搅拌转速 300 r/min,ρ(Cu2+)015 mg/L 和ρ(Cd2+)015 mg/L 的条件下,考察温度对净化除钴的影响,结果如图8所示。
由图8可知:温度和时间对锑盐净化除钴有非常显著的影响,温度越高,时间越长,净化效果越好。在55 ℃时,除钴反应进行得很慢,90 min的除钴率不到37%,当温度达到85 ℃,反应进行到60 min时,ρ(Co2+)<0.1 mg/L,已达到深度净化要求,再升高温度到95 ℃,仅需要反应45 min就能达到ρ(Co2+)<0.1 mg/L,但是反应60 min后,已沉积的钴会出现返溶现象,这是因为氢的超电势随温度的升高而降低,钴的阳极极化也会下降,所以温度过高不仅使氢气析出增多,锌粉消耗增加,而且会导致已沉积的钴返溶[20];同时在生产过程中温度过高还会大大增加能耗。因此,从深度净化和能耗等方面考虑,锑盐净化除钴时温度应控制在85 ℃左右。
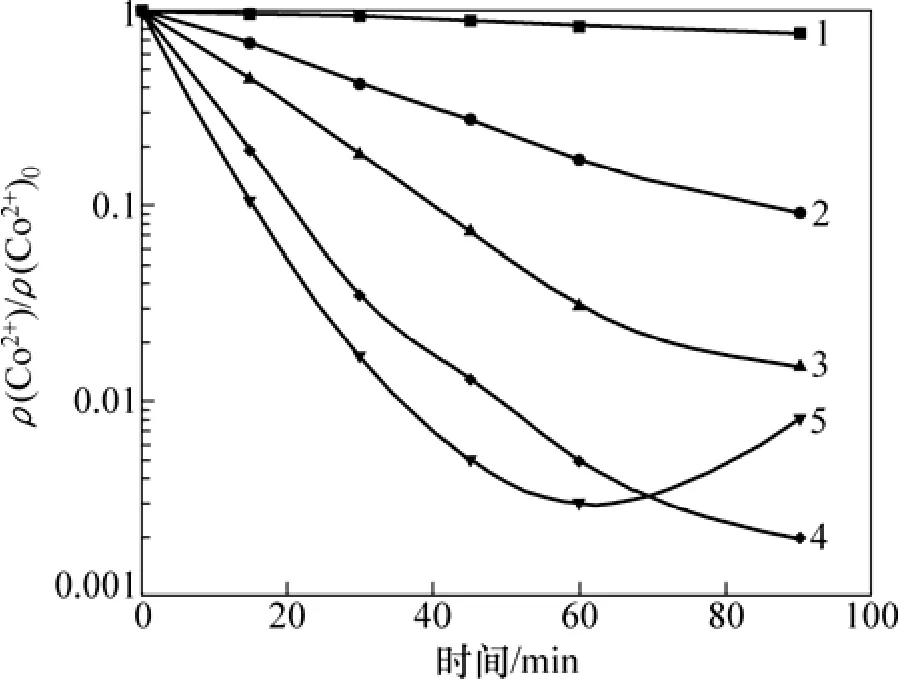
图8 温度对净化除钴的影响Fig.8 Effect of temperature on cobalt removal
根据图8,作-ln(ρ(Co2+)/ρ(Co2+)0)与时间的关系曲线,结果如图9所示,由图9可看出:在不同温度下,-ln(ρ(Co2+)/ρ(Co2+)0)与时间呈现较好的线性关系,这说明锌粉置换除钴为一级反应,直线的斜率即为除钴反应速率常数k,用线性回归的方法求得在各温度下的除钴反应速率常数k,作-lnk与1/T关系曲线图,如图10所示,由图10可求得除钴反应的表观活化能为103 kJ/mol,如此高的活化能表明,在Cu2+、Cd2+与锑盐同时存在下,锌粉置换除钴过程为化学反应步骤控制。

图9 不同温度下-ln(ρ(Co2+)/ρ(Co2+)0)与时间的关系Fig.9 Relationship between -ln(ρ(Co2+)/ρ(Co2+)0) and time at different temperatures
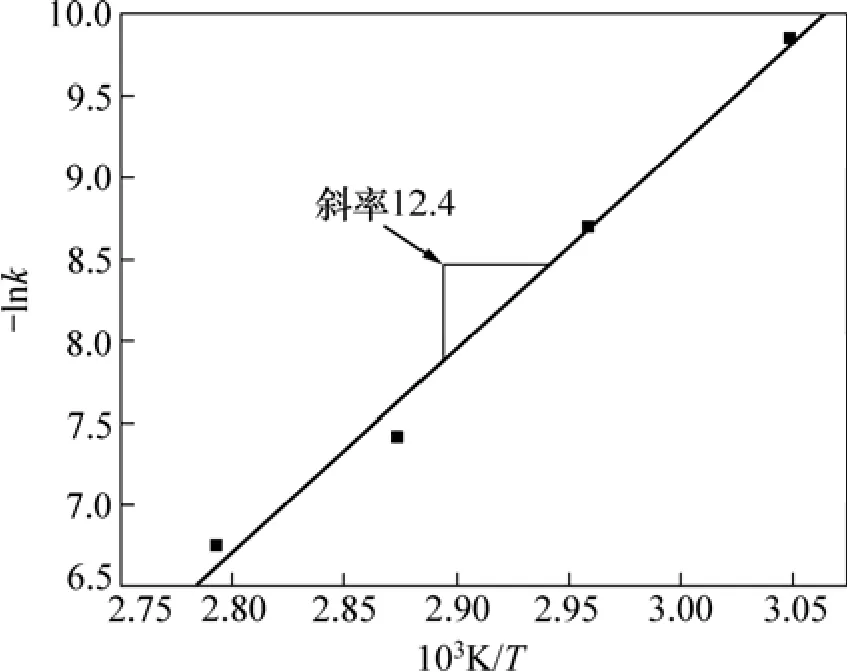
图10 -lnk与1/T的关系Fig.10 Relationship between –lnk and 1/T
2.4 搅拌转速对净化除钴的影响
在酒石酸锑钾质量浓度为 3 mg/L,反应温度为85 ℃,锌粉用量为 2 g/L,ρ(Cu2+)0为 15 mg/L和ρ(Cd2+)0为15 mg/L的条件下,考察搅拌转速对净化除钴的影响,结果如图11所示。
由图11可知:当搅拌转速在100~300 r/min时,除钴速率随搅拌转速的增大而提高,这是因为锑盐净化除钴时,Co2+的析出伴随有H+还原,导致电极表面附近pH值升高,且溶液中Zn2+浓度较高,因而在电极附近Zn2+生成碱式硫酸锌或氢氧化锌吸附在电极表面,溶液中Co2+必须扩散穿过此沉积物层才能到达锌粉表面,从而阻碍了Co2+的进一步被置换,因此强化搅拌有利于Co2+的扩散,增加与锌粉接触的机会,从而加速置换反应的进行;当搅拌转速超过 300 r/min时,除钴速率变化很小,并且反应60 min后,已沉积的钴还会出现返溶,钴返溶主要是由于在高的搅拌转速条件下,钴容易脱离锌粉表面,从而失去锌粉的阴极保护作用,与溶液中的Cu2+和Sb3+形成微电池而发生返溶。因此,锑盐净化除钴时搅拌转速应控制在300 r/min为宜。

图11 搅拌转速对净化除钴的影响Fig.11 Effect of stirring speed on cobalt removal
3 结论
(1) 添加一定量的 Cu2+不仅能提高除钴速率和效果,同时也能减少锌粉用量;同时添加Cu2+和Cd2+,除钴效果比单独添加Cu2+时更好。试验确定的最优除钴工艺条件为:ρ(Cu2+)015 mg/L,ρ(Cd2+)015 mg/L,酒石酸锑钾3 mg/L,锌粉用量2 g/L,温度85 ℃和搅拌转速300 r/min。
(2) 温度对净化除钴的影响很大,升高温度可显著提高除钴的反应速率,在Cu2+和Cd2+与锑盐同时存在时,锌粉置换除钴反应的活化能为103 kJ/mol,表明锌粉置换除钴过程为化学步骤控制。
(3) 在一定的搅拌转速范围内,增加搅拌转速能提高除钴速率;在高的搅拌转速条件下,已沉积的钴容易返溶。
[1]曾桂生. 硫酸锌溶液中锌粉置换除钴的机理研究[D]. 昆明:昆明理工大学材料与冶金工程学院, 2006: 14-16.ZENG Gui-sheng. Mechanism of cobalt removal from zinc sulfate solution with zinc powder[D]. Kunming: Kunming University of Science and Technology. Faculty of Materials and Metallurgical Engineering, 2006: 14-16.
[2]唐朝波. 锑盐净化除钴工艺的研究[D]. 长沙: 中南工业大学冶金科学与工程学院, 1999: 15-16.TANG Chao-bo. Study on the process of purification cobalt from zinc sulfate solution with Sb2O3[D]. Changsha: Central South University of Technology. School of Metallurgical Science and Engineering, 1999: 15-16.
[3]李向东. 硫酸锌溶液锑盐净化除钴工艺的优化[J]. 湖南有色金属, 2004, 20(4): 24-26.LI Xiang-dong. Optimization of the process that purification-Co of ZnSO4solution by antimony salt[J]. Hunan Nonferrous Metals,2004, 20(4): 24-26.
[4]曹为民. 砷盐和锑盐净化除钴的探讨[J]. 湖南有色金属, 2001,17(z1): 17-18.CAO Wei-ming. Research of cobalt removal by arsenic and antimony salt[J]. Hunan Nonferrous Metals, 2001, 17(z1):17-18.
[5]黄国清. 硫酸锌溶液的净化除钴[J]. 株冶科技, 1995, 23(3):34-39.HUANG Guo-qing. Study on cobalt removal from zinc sulfate solution[J]. Science and Technology of Zhuzhou Smelters, 1995,23(3): 34-39.
[6]Raghavan R, Mohanan P K, Verma S K. Modified zinc sulphate solution purification technique to obtain low levels of cobalt for the electrowinning process[J]. Hydrometallurgy, 1999, 51(2):187-206.
[7]Fountoulakis S G. Studies on the cementation of cobalt with zinc in the presence of copper and antimony additives[D]. Ann Arbor:University Microfilms International. School of Engineering and Applied Science, 1983: 245-246.
[8]曹家淑, 严君其. 湿法炼锌中用 Pb-Sb置换锌粉除钴的研究[J]. 南方冶金学院学报, 1982(Z1): 68-82.CAO Jia-shu, YAN Jun-qi. Study on cobalt removal with Pb-Sb of zinc dust in hydrometallurgy of zinc[J]. Journal of Southern Institute of Metallurgy, 1982(Z1): 68-82.
[9]李世禄, 王正明, 朱军, 等. 湿法炼锌净化除钴实验研究及实践[J]. 湖南有色金属, 2010, 26(2): 25-26.LI Shi-lu, WANG Zheng-ming, ZHU Jun, et al. Experimental study and practice on the process of removing cobalt for zinc hydrometallurgy[J]. Hunan Nonferrous Metals, 2010, 26(2):25-26.
[10]曾桂生, 谢刚, 杨大锦, 等. 镉离子对硫酸锌溶液除钴的影响及机理探索[J]. 科学技术与工程, 2005, 5(13): 872-875.ZENG Gui-sheng, XIE Gang, YANG Da-jin, et al. Effect and mechanism of cadmium ion on cobalt removal in zinc sulfate solution[J]. Science Technology and Engineering, 2005, 5(13):872-875.
[11]Lew R W. The removal of cobalt from zinc sulphate electrolyte using the copper-antimony process[D]. Vancouver: The University of British Columbia. Department of Metals and Materials Engineering, 1994: 44-45.
[12]Nelson A. Novel activators in cobalt removal from zinc electrolyte by cementation[D]. Montreal: McGill University.Department of Mining and Metallurgical Engineering, 1999:15-22.
[13]徐承坤, 张蕴珊, 梁英教. 硫酸锌溶液中锌粉净化除钴的机理[J]. 东北工学院学报, 1987, 50 (1): 29-35.XU Cheng-kun, ZHANG Yun-shan, LIANG Ying-jiao.Mechanism of cobalt removal from zinc sulfate solution with zinc powder[J]. Journal of Northeast University of Technology,1987, 50(1): 29-35.
[14]Nelson A, Demopoulos G P, Houlachi G. Effect of solutionconstituents and novel activators on cobalt cementation[J].Canadian Metallurgical Quarterly, 2000, 39(2): 175-186.
[15]Dreher T M, Nelson A, Demopoulos G P, et al. The kinetics of cobalt removal by cementation from an industrial zinc electrolyte in the presence of Cu, Cd, Pb, Sb and Sn additives[J].Hydrometallurgy, 2001, 60(2): 105-116.
[16]van der Pas V, Dreisinger D B. A fundamental study of cobalt cementation by zinc dust in the presence of copper and antimony additives[J]. Hydrometallurgy, 1997, 43(1/3): 187-205.
[17]彭容秋. 锌冶金[M]. 长沙: 中南大学出版社, 2005: 80.PENG Rong-qiu. Zinc metallurgy[M]. Changsha: Central South University Press, 2005: 80.
[18]梅光贵, 王德润, 周敬元, 等. 湿法炼锌学[M]. 长沙: 中南大学出版社, 2001: 436.MEI Guang-gui, WANG De-run, ZHOU Jing-yuan, et al.Hydrometallurgy of zinc[M]. Changsha: Central South University Press, 2001: 436.
[19]刘中青, 唐谟堂. 硫酸锌溶液低温锑盐除钴研究[J]. 湿法冶金, 1999(4): 22-27.LIU Zhong-qing, TANG Mo-tang. Study on cobalt removal from zinc sulfate solution at low temperature with antimony salt[J].Hydrometallurgy of China, 1999(4): 22-27.
[20]陈世琯. 硫酸锌溶液净化除钴的理论分析和工艺进展[J]. 上海有色金属, 1996, 17(4): 161-168.CHEN Shi-guan. Theoretical analysis and technological progress in purification of cobalt from zinc sulfate solution[J]. Shanghai Nonferrous Metals, 1996, 17(4): 161-168.

