肺结核患者外周血CD4+和CD8+记忆性T细胞亚群、IL-17、IL-27表达的初步探讨①
鄢仁晴 方 宁 赵建军 罗军敏 罗建波 刘晓燕 (贵州省遵义医学院附属医院检验科,遵义563003)
结核病是由结核分枝杆菌感染引起的慢性传染病,其发病机制尚未完全阐明。结核病广泛传播的潜在危险使得人们再次认识到疫苗开发研制的重要性。免疫记忆性是疫苗作用的物质基础,在完成初次免疫应答后淋巴细胞大部分被清除,只有极少数效应T细胞转变为记忆性T细胞(Memory T lymphocyte,Tm)。如再次遇到相同抗原刺激,此类细胞可介导更快、更强的免疫应答。根据CD62L和CCR7分子表达的不同可以将记忆性T细胞分为两大群[1],一群是 CD62L+和 CCR7+细胞,称为中央型记忆性T细胞TCM,与初始T细胞相似;主要分布于淋巴组织;而另外一群细胞是CD62L-和CCR7+,称为效应型记忆性T细胞TEM,主要分布于非淋巴组织,表达向炎症部位迁移的趋化因子。当受抗原刺激后,中央型记忆性T细胞可转变为效应型记忆性T细胞,发挥免疫应答功能。动物模型实验结果显示[2]:TEM介导了保护性记忆,其迁移到外周炎症部位并发挥效应功能;而反应性记忆则由TCM发挥,其归巢到次级淋巴器官的T细胞区,几乎没有效应功能,但能稳定地增殖并在抗原刺激下分化为效应细胞。IL-17是目前新发现的由CD4+记忆T淋巴细胞、CD8+细胞等多种细胞分泌的细胞因子,被认为参与了机体多种炎性疾病的发生。IL-27具有诱导Th1反应促炎性作用和减轻炎性反应双重作用,在抗感染免疫、抗肿瘤免疫及自身免疫性炎症等Th1型免疫主导的病理过程中起重要作用。国外鲜见人肺结核外周血记忆性 T细胞的报道[3,4],国内学者做过相关基础研究[5-7],但未见肺结核患者外周血记忆性T细胞的报道,国外少见肺结核与IL-17、IL-27的相关研究报道[8-10]。所以拟以 CD4+(CD8+)CD45RA-CD62L-CCR7+作为效应型记忆性T细胞(Effector memory T cell,TEM)表面标志,CD4+(CD8+)CD45RA+CD62L+CCR7+作为中央型记忆性T细胞(Central memory T cell,TCM)表面标志,用以探讨肺结核患者外周血记忆性T细胞亚群的表达以及与IL-17、IL-27水平的相关性。
1 材料与方法
1.1 材料
1.1.1 患者组 收集2011年1月到12月30例住院病人及门诊病人,经呼吸内科临床诊断的继发性肺结核(包括浸润性肺结核、纤维空洞性肺结核及干酪性肺炎等)。参照《中华人民共和国卫生行业标准WS288-2008肺结核诊断标准》:a.两次痰标本涂片镜检抗酸杆菌阳性或分离培养分支杆菌阳性。b.胸部X线摄片显示肺结核征象。具有咳嗽、咳痰、疲乏、胸闷气短、胸痛、低烧、食欲不振、血痰或咯血、体重减轻、月经失调等症状。c.五个单位结核菌素(OT或PPD-T)皮内注射,72小时注射局部硬结反应直径≥5 mm。d.肺部病理标本(手术、纤维支气管镜检、肺穿刺等)经病理学诊断为结核病变。具备a、b,或同时伴有c,d中一项者或同时具备a、d者,均可确诊。
分组:(1)参照《中华人民共和国卫生行业标准结核病分类》中化疗史规定把患者分为初治组和复治组;初治组为凡既往未用过抗结核药物治疗或用药时间少于一个月的新发病例;复治组为凡既往应用抗结核药物一个月以上的新发病例、复发病例、初治治疗失败病例等。(2)根据痰涂片抗酸染色分组:阳性为痰涂阳组,阴性为痰涂阴组。
所有病例均无心、肝、肾等脏器合并症及其它感染,无糖尿病、肿瘤等免疫相关性或免疫性疾病,4个月内未用过激素及免疫抑制剂,均在抗结核治疗前采血。其中初治8例,复治22例。痰涂阳9例,痰涂阴21例。男/女:16/14例,平均年龄36岁,最大68岁,最小13岁。
1.1.2 健康对照组 随机选择20例健康正常者,均排除心、肝、肾等疾病,男/女:12/8例,平均年龄38岁,最大52岁,最小15岁。
1.2 标本收集 记忆性T细胞数量检测:无菌操作取患者组及对照组清晨空腹静脉血5 ml于EDTANa2抗凝管中,立即轻摇混匀,室温保存,6小时内测定。IL-17、IL-27水平检测:取普通管抽取静脉血3 ml,分离血清,-20℃冰冻保存,待测。

表1 肺结核患者外周血记忆性T细胞亚群的表达(中位数,最小值,最大值,%)Tab.1 Expression of memory T cell subgroups in peripheral blood of pulmonary tuberculosis patients(median,min,max,%)
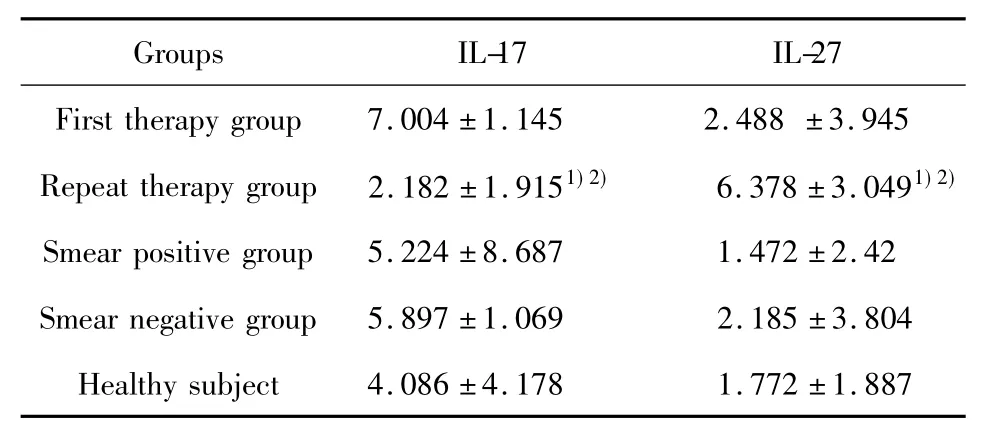
表2 肺结核患者血清IL-17和IL-27表达水平(ng/L)Tab.2 Level of IL-17 and IL-27 in peripheral blood of pulmonary tuberculosis patients(ng/L)
1.3 试剂及仪器 试剂:CD4-Percp、CD8-Percp、CCR7(CD197)-PE、CD45RA-FITC、CD62L-APC、鼠IgG1-PE、鼠IgG2a-PE、FACS溶血素、裂解液均购自美国BD公司;人IL-17、IL-27酶联免疫分析试剂盒购自美国R&D systems公司;仪器:BD-FACSCalibur流式细胞分析仪(美国BD公司),DNM-9602G酶标分析仪(北京普朗新技术有限公司)。
1.4 流式分析操作方法 用流式细胞术检测EDTANa2抗凝的外周血记忆性T细胞:取100μl待检样本,分别加入 CD4-Percp、CD8-Percp、CCR7(CD197)-PE、CD45RA-FITC、CD62L-APC标记抗体。按照常规方法进行标记,设相应的同型对照,室温闭光反应30分钟,然后加2 ml溶血剂,5分钟后离心去上清,再加0.5~1.0 ml的 PBS液洗涤2次,流式细胞仪检测,CellQuest软件分析数据,记录阳性细胞百分率,减去非特异对照值,样品在6小时内检测完毕。
1.5 ELISA双抗夹心法 测定肺结核患者外周血中IL-17、IL-27的含量。按照试剂盒说明书操作,应用酶标仪定量检测。
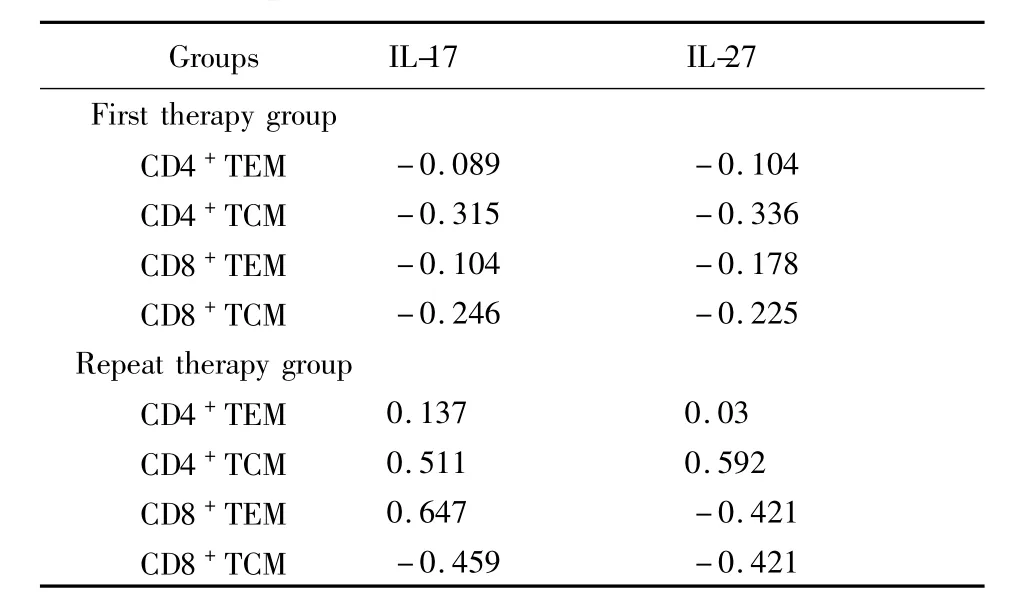
表3 肺结核患者记忆性T细胞亚群与IL-17/IL-27的相关性(r)Tab.3 The correlation analysis between memory T cells subgroups and IL-17/IL-27 in pulmonary tuberculosis patients(r)
1.6 统计学处理 检验数据是否成正态分布,成偏态分布,采用中位数(最大值,最小值)描述数据,统计方法采用Wilcoxon秩和检验,相关性分析采用Spearman秩相关,成正态分布采用均数标准差描述数据,统计采用两样本均数T检验,相关性分析采用泊松分析。
2 结果
2.1 流式细胞仪分析记忆性T细胞亚群 CD4+TEM 初治组和复治组,涂阳组和涂阴组均高于健康对照组(P<0.05);CD4+TCM:初治组高于复治组 (P<0.05),涂阴组高于涂阳组(P<0.05);CD8+TEM:初治组与涂阴组均低于健康对照组(P <0.05),初治组低于复治组(P <0.05),涂阴组低于涂阳组(P<0.05);CD8+TCM:涂阴组高于涂阳组(P <0.05),见表1。
2.2 ELISA法检测肺结核患者外周血清IL-17/IL-2 7水平 IL-17复治组低于初治组和健康对照组(P<0.05);IL-27:复治组高于初治组和健康对照组 (P <0.05),见表2。
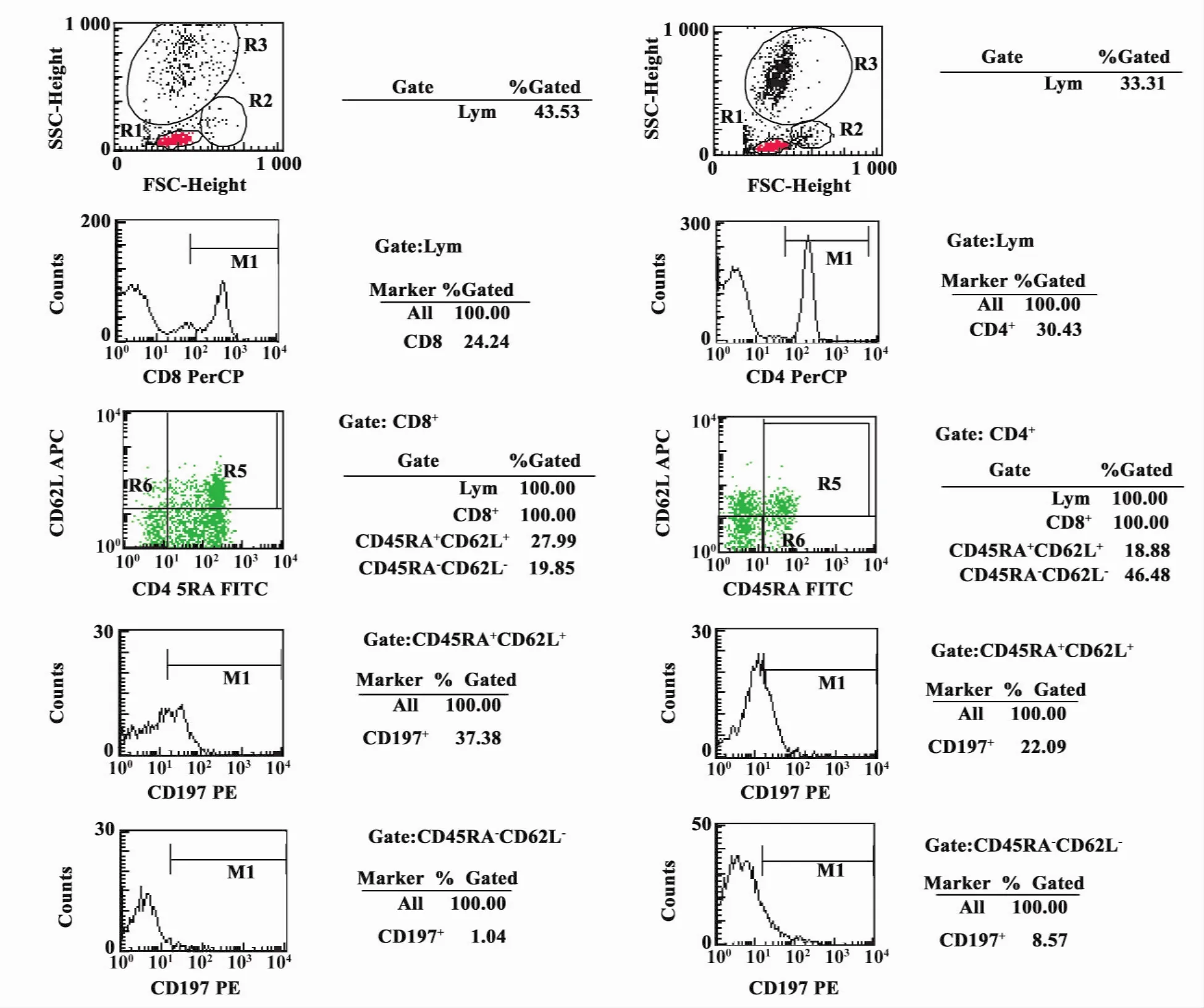
图1 1例肺结核患者CD4+/CD8+记忆性T细胞流式分析图谱Fig.1 One result of pulmonary tuberculosis patients of CD4+/CD8+memory T cells analyzed by flow cytometry
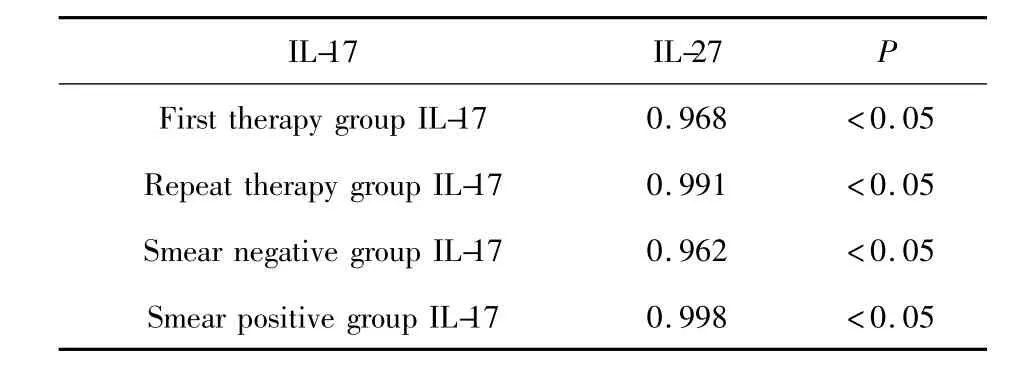
表4 肺结核患者IL-17与IL-27的相关性(r)Tab.4 The correlation analysis between IL-17 and IL-27 in pulmonary tuberculosis patients(r)
2.3 相关性分析 患者组CD4+和CD8+记忆T细胞与 IL-17、IL-27水平比较无显著相关性(P>0.05),患者IL-17与IL-27比较有显著相关性(P<0.05),见表3、4。
2.4 流式分析图谱 第一行图谱R1为外周血淋巴细胞,R2是单核细胞,R3是中性粒细胞,第二行图谱M1是CD4+和CD8+细胞,第三行图谱R5是CD45RA+、CD62L+的 细 胞,R6 是 CD45RA-、CD62L-的细胞,第四行图谱 CD45RA+、CD62L+、CD197+的细胞,第五行图谱 CD45RA-、CD62L-、CD197+的细胞,如图1。
3 讨论
因为结核病流行形势的严峻和卡介苗抗结核保护作用的有限,故抗结核新疫苗的研制一直为人们所关注。结核分枝杆菌属胞内寄生菌,以T细胞免疫为主。记忆性T细胞在数量上、细胞膜表面分子的表达、细胞因子的产生和功能等方面均与初始T细胞有明显不同[11]。
我们采用多种染色流式细胞术检测,以及国内外常用鉴别记忆性T细胞表型标志的抗体,在单个细胞水平上检测肺结核患者外周血CD4+(CD8+)记忆性T细胞亚群的表达。结果表明患者组CD4+TEM表达水平均高于健康对照组,与文献报道相符[12-14]。肺结核是以Th1型细胞免疫来对付侵袭的结核分枝杆菌,CD4+效应型记忆性T细胞在急性炎症期表达增高,可以为机体提供免疫记忆保护。继发性肺结核患者外周血CD4+TEM表达水平明显高于正常人,可望作为临床诊断继发性肺结核的新型指标;CD8+TEM初治组与涂阴组均低于健康对照组(P<0.05),初治病例体内免疫反应向Th1方向极化,CD8+TEM带有大量的颗粒酶和穿孔素,可对吞噬了大量抗原的靶细胞进行呈递和杀伤,CD8+TEM在结核感染初期或活动期降低,与CD8+T功能细胞介导的细胞免疫反应一致。有学者认为CD8+T细胞的数量降低是结核病治疗失败和复发的重要原因[15],本研究提示CD8+TEM降低,因此在研制新型结核疫苗中迫切需要解决如何提高CD8+T细胞的数量及其免疫应答效率。
复治组CD4+TCM显著低于初治组(P<0.05),复治组CD8+TEM细胞显著高于初治组(P<0.05),CD4+TCM记忆性T细胞在体内长期存在,在复治组表现为对原来抗原的再次入侵产生快速而强烈的克隆增殖反应,并能有效地刺激树突状细胞,辅助B细胞,产生免疫效应。在外周表现为数量减少,也可能为复治期CD4+中央型转变为效应型记忆细胞,发挥免疫应答功能。复治组CD8+TEM增高是否由于结核菌的耐药,不能对靶细胞进行呈递和杀伤,因此存活的CD8+TEM增加,还需进一步探讨。
涂阴组CD4+TCM显著高于涂阳组 (P<0.05),涂阴组 CD8+TEM显著低于涂阳组(P<0.05),涂阴组 CD8+TCM显著高于涂阳组(P<0.05)。通常涂阳组患者由于长期带菌,结核分枝杆菌在抗原刺激和自稳细胞因子的作用下使得TCM分化为TEM,因此涂阳组TCM减少[16]。
范艳等[8]研究显示机体外周血中存在着卡介苗(BCG)特异性记忆CD4+T细胞,这些记忆T细胞在体内的产生是由于BCG免疫后所诱导,还是环境中分枝杆菌所致,需要进一步探讨。据本研究可以推断结核分枝杆菌的免疫反应是可以产生特异性的CD4+记忆性T细胞,但是CD8+记忆性T细胞可能参与细胞杀伤作用而数量有所下降。
复治组IL-17水平低于健康对照组和初治组,与文献[17]报道相符 ,IL-17在招募中性粒细胞聚集感染部位吞噬结核杆菌的同时也加重了感染部位的炎症反应。项杰等[18]报道结核病未治疗组患者的IL-17水平升高,炎症加重,经治疗一段时间后IL-17水平明显下降,炎症反应降低,因此IL-17参与了机体抗结核杆菌感染的免疫反应。复治组IL-27水平高于健康对照组和初治组,与文献[19]报道相符,在炎症早期,IL-27可以通过JAK/STATs途径来促进CD4+T细胞、CD8+T细胞、NK细胞、肥大细胞和单核细胞活化增殖产生炎性细胞因子IFN-γ、IL-1、IL-12、IL-18 和 TNF.[20]。记忆 T 细胞表达 IL-27受体,当受体缺失时,炎症性细胞因子激活、IL-27产生增多[21]。IL-27在结核菌感染过程中发挥双重作用,虽然阻止了抗结核菌的保护性免疫反应,但可以限制慢性炎症造成的最终病理损害[22]。由此提示IL-17、IL-27参与了抗感染免疫的炎症介导过程,尤其是参与了Th1型免疫主导的病理过程。各患者组IL-17、IL-27水平有显著相关性,进一步证实两者均参与了结核的抗感染免疫,有学者认为IL-27可以通过JAK/ST AT1途径抑制活化CD4+T细胞产生 IL-17[23,24]。IL-17、IL-27 水平与记忆性 T 细胞的数量无明显相关性,提示IL-17、IL-27可能未参与抗结核的免疫记忆过程,具体原因尚需进一步研究。
综上所述,肺结核患者外周血CD4+TEM记忆性T细胞的表达水平可望作为肺结核初步诊断的临床观察指标,CD4+TCM和CD8+TEM两者均可望作为肺结核患者的临床分组依据。IL-17、IL-27可用于判断肺结核的炎症程度。我们将深入探讨肺结核记忆性T细胞的变化,为CD4+和CD8+记忆性T细胞新型结核疫苗的研制打下基础。
1 徐 林,熊思东.中枢记忆性T细胞和效应记忆性T细胞[J].科技导报,2006;24(12):20-22
2 Dorer D E,Czepluch W,Lambeth M R et al.Lymphatic tracing and T cell responses following oral vaccination with live Mycobacterium bovis(BCG)[J].Cell Microbiol,2007;9(2):544-553
3 Commandeur S,van Meijgaarden K E,Lin M Y et al.Identification of human T cell responses to Mycobacterium tuberculosis resuscitation-promoting factors in long-term latently infected individuals[J].Clin Vaccine Immunol,2011;18(4):676-683.
4 Veiga A P,Casseb J,Duarte A J et al.Humoral response to hepatitis B vaccination and its relationship with T CD45RA+(na ve)and CD45RO+(memory)subsets in HIV-1-infected subjects[J].Vaccine,2006;24(49-50):7124-7128.
5 吴长有,刘 杰.利用多种表面标志鉴别正常人外周血初始和记忆T细胞亚群[J].免疫学杂志,2006;22(2):121-128.
6 杨滨燕,吴长有.初始CD4 T和记忆性Th1细胞在淋巴器官的分布和 IFN-γ 的表达[J].免疫学杂志,2005;21(4):273-276.
7 Zhang Y,Joe G,Hexner E et al.Host reactive CD8+memory stem cells in graft-versus-host disease[J].Nat Med,2005;11(12):1299-1305.
8 Peng M Y,Wang Z H,Yao C Y et al.Interleukin 17-producing gamma delta Tcells increased in patients with active pulmonary tuberculosis[J].Cell Mol Immunol,2008;5(3):203-208.
9 Matthews K,Wilkinson K A,Kalsdorf B et al.Predominance of interleukin-22 over interleukin-17 at the site of disease in human tuberculosis[J].Tuberculosis,2011;91(6):587-593.
10 Peng M Y,Wang Zh H,Yao Ch Y et al.Interleukin 17-producing γδT cells increased in patients with active pulmonary tuberculosis[J].细胞与分子免疫学·英文版,2008;5(3):203-208
11 Walrath J,Zukowski L,Krywiak A et al.Resident Th1-like effector memory cells in pulmonary recall responses to mycobacterium tuberculosis[J].Am J Respir Cell Mol Biol,2005;33(1):48-55.
12 Huster K M,Koffler M,Stemberqer C et al.Unidirectional development of CD8+central memory T cells into protective Listeria-specific effector memory T cells[J].Eur J Immunol,2006;36(6):1453-1464.
13 范 艳,杨利桃,李丽 et al.人外周血卡介苗(BCG)特异性中央型和记忆型CD4+细胞的特[J].中国免疫学杂志,2006;22(5):403-406.
14 Wang X,Cao Z,Jiang J et al.Association of mycobacterial antigenspecific CD4(+)memory T cell subsets with outcome of pulmonary tuberculosis[J].Infect,2010;60(2):133-139.
15 孙 丽.关于CD8细胞在结核病免疫治疗效果评价中的意义之我见[J].中国防痨杂志,2002;24(1):65-66.
16 Jeyanathan M,Mu J,McCormick S et al.Murine airway luminal antituberculosis memory CD8 T cells by mucosal immunization are maintained via antigen-driven in situ proliferation,independent of peripheral T cell recruitment[J].Am J Respir Crit Care Med,2010;181(8):862-872.
17 Scriba T J,Kalsdorf B,Abrahams D A et al.Distinct,specific IL-17 and IL-22 producing CD4+T cell subsets contribute to the human anti-mycobacterial immune response[J]JImmunol ,2008;180(3):1962-1970.
18 项 杰,章晓联,席淑红.结核病人血清 IL-27、TNF-α、IFN-γ 的检测及其免疫学意义[J].数理医药学杂志,2009;22(2):148-151.
19 Villarino V,Larkin J,Sarisc J et al.Positive and negative regulation of the IL-27 receptor during lymphoid cell activation[J].Immunol,2005;174(12):76842-76911.
20 Holscher C,Holsher A,Ruckerl D et al.The IL-27 receptor chain WSX2-1 differentially regulates antibacterial immunity and survival during experimental tuberculosis[J].Immunol,2005;174(6):35342-35441.
21 Villarino A V,Larkin J 3 rd,Saris C J et al.Positive and negative regulati on of the IL-27 receptor during lymphoid cell activation[J].Immunol,2005;174(12):76842-76911.
22 Holscher C,Holscher A,Ruckerl D et al.The IL-27 receptor chain WSX2-1 differentially regulates antibacterial immunity and survival during experimental tuberculosis[J].Immunol,2005;174(6):35342-35446.
23 Batten M,Li J,Yi S et al.Interleukin 27 limits autoimmune encephalomyelitis by supp ressing the development of interleukin 17 producing T cells[J].Nat Immunol,2006;7(9):9292-9361.
24 Stumhofer JS,Laurence A,Wilson E H et al.Interleukin 27 negatively regulates the development of interleukin 17 producing T helper cells during chronic inflammation of the central nervous system[J].Nat Immunol,2006;7(9):9372-9451.

