宫颈癌细胞通过分泌TSLP促进自身细胞活力①
谢 锋 孟玉菡 李明清 李大金
(复旦大学附属妇产科医院暨妇产科研究所生殖免疫教研室,上海200011)
胸腺基质淋巴细胞生成素(TSLP)是一种IL-7样细胞因子,最早在胸腺间质细胞株培养上清液中发现。TSLP是身体和环境界面(皮肤、呼吸道、肠道、眼组织等)介导Th2反应的关键因子。近期研究发现,除了上皮细胞和表皮角质细胞外,多种细胞包括肥大细胞、呼吸道平滑肌细胞、纤维细胞、树突细胞(DCs)、滋养细胞以及肿瘤和肿瘤相关细胞均可表达 TSLP[1]。
TSLP参与多种病理生理过程。如通过活化树突细胞促使CD4+T细胞呈现Th2免疫优势[2],直接活化T细胞受体促进T细胞增殖、产生Th2型细胞因子和促进B细胞发育和分化。此外,皮肤T细胞淋巴瘤患者血清TSLP的表达增高[3]。TSLP诱导的Th2型炎性反应与胰腺癌和乳腺癌的进展和预后不良有关[4,5]。我们课题组的前期工作发现,人早孕期滋养细胞分泌的TSLP能促进自身增殖和侵袭[6]。考虑到滋养细胞与肿瘤细胞具有相似的生物学特性,因此本研究是在前期研究的工作基础上,检测宫颈癌细胞是否表达TSLP,并分析TSLP对宫颈癌细胞的细胞活力的调节作用。
1 材料与方法
1.1 材料
1.1.1 细胞来源 人宫颈癌细胞株(HeLa和Cas-Ki)均购自中国科学院细胞库。
1.1.2 试剂DMEM-F12培养液、胎牛血清为Gibco公司产品;人TSLPELISA试剂盒和人重组的细胞因子TSLP均购自R&D公司;PE结合的抗人TSLPR流式抗体及其同型对照购自Biolegend公司;MTT购自Sigma公司。
1.2 方法
1.2.1 ELISA检测 HeLa和 CasKi细胞培养上清TSLP的浓度 将1×105细胞的HeLa或CasKi细胞接种于24孔板中,分别收集培养24、48和72小时的培养上清。按照人TSLP ELISA试剂盒的操作步骤检测上清液TSLP的浓度。TSLP检测敏感度为3.46 pg/ml,板内、板间变异系数<10%。实验重复3次,每次设3复孔。
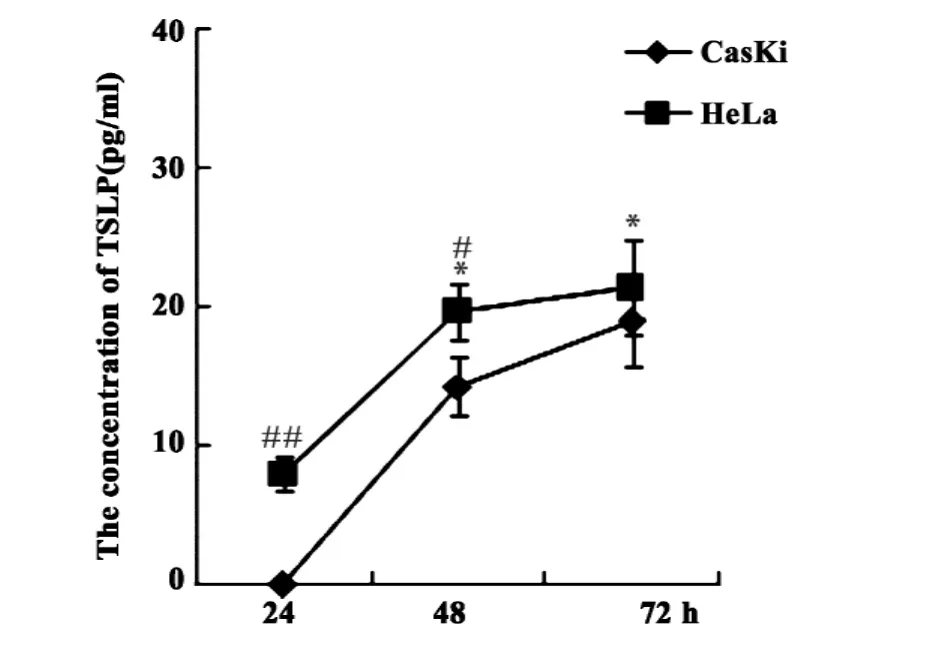
图1 CasKi和HeLa细胞不同时间上清中TSLP的浓度Fig.1 TSLP concentration in the supernatants of Cas-Ki and HeLa cells
1.2.2 流式细胞术检测HeLa和CasKi细胞TSLPR的表达 常规胰酶消化HeLa和CasKi细胞,收获的细胞加PE标记抗人的TSLPR或同型对照,常温孵育30分钟,PBS洗涤后重悬细胞,然后经流式细胞仪(BD FACSCalibur)进行检测。实验重复3次,每次设3复孔。
1.2.3 MTT法检测HeLa和CasKi细胞的细胞活力
将5×103细胞的HeLa或CasKi细胞接种于96孔板中,培养12小时后经无血清DMEM+F12培养液饥饿12小时,然后经溶媒、1、10或100 ng/ml TSLP处理24、48或72小时,随后MTT法检测各组细胞的细胞活力。实验重复3次,每次设6复孔。
1.3 统计学分析 实验数据输入SPSS13.0软件系统,进行t检验或One-way ANOVA检验,以P<0.05为差异有显著性。
2 结果
2.1 CasKi和HeLa细胞均分泌 TSLP 如图1所示,ELISA结果显示宫颈癌细胞株CasKi和HeLa细胞均分泌TSLP,并呈现时间依赖性(仅培养24小时的CasKi细胞TSLP分泌水平检测不出)。与CasKi细胞相比,HeLa细胞早期(24小时和48小时)分泌TSLP水平较高(P <0.05或P <0.01),但是随着时间的进展,培养72小时时两者TSLP的分泌水平无明显差异(P >0.05)。
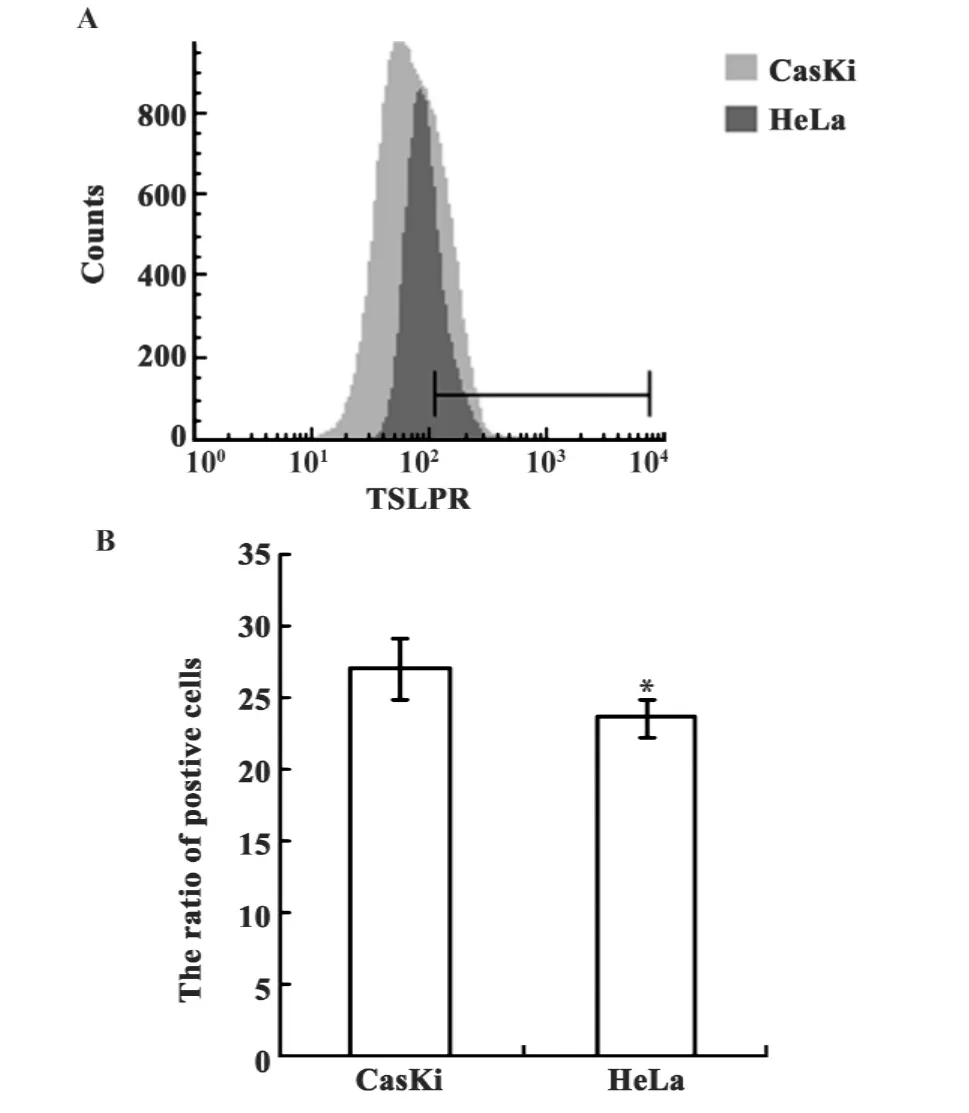
图2 CasKi和HeLa细胞表面TSLPR的表达Fig.2 The expression of TSLPR of CasKi and HeLa cells
2.2 CasKi和HeLa细胞均表达TSLPR 流式检测发现培养48小时后的CasKi和HeLa细胞TSLPR阳性表达率分别为 27.07 ±2.13 和 23.61 ±1.30,CasKi细胞表达 TSLPR高于HeLa细胞(P<0.05,图2)。
2.3 TSLP增加 CasKi和 HeLa细胞的细胞活力不同浓度细胞因子TSLP作用CasKi和HeLa细胞后MTT法检测细胞活力,发现TSLP各浓度组处理的细胞于24小时时不影响CasKi和HeLa细胞的活力(P>0.05);低剂量组(1 ng/ml)TSLP亦不影响CasKi和 HeLa细胞活力(P>0.05);而10或100 ng/ml的TSLP处理CasKi和HeLa细胞48或72小时后,均能显著增强其细胞活力(P<0.05,图3)。

图3 TSLP对CasKi和HeLa细胞活力的调节作用Fig.3 The regulation of TSLP on the viability of CasKi and HeLa cells
3 讨论
TSLP是1994年被发现,主要由上皮细胞表达的一种造血细胞因子,人TSLP mRNA高表达于皮肤、心脏、肝脏、前列腺、胃肠道、肺和胸腺等器官[7]。最近研究发现一些肿瘤细胞同样分泌高水平TSLP,如:纤维母细胞瘤、肺癌、乳腺癌细胞和胰腺癌细胞等。TSLP的受体是由IL-7Rα链和TSLPR链组成的异质二聚体。其中人TSLPR mRNA全长1 579 bp,含一个由371 aa组成的开放阅读框,有一个跨膜区,为Ⅰ型跨膜蛋白,属于造血细胞因子受体家族。人TSLP/TSLPR参与调节发挥多种生物学过程,如调节先天和获得性免疫反应,此外在过敏性皮肤病、呼吸道疾病、寄生虫感染和调节肠道免疫中具有重要作用。
我们课题组的前期工作已经证实人早孕期滋养细胞来源的TSLP可以剂量依赖的方式促进滋养细胞的增殖和侵袭力[6]。母-胎界面滋养细胞具有独特的类似于肿瘤细胞的生物学行为,即高增殖和侵袭能力。而国内外的研究未见TSLP与宫颈癌的相关性报道,因此本课题借助ELISA和流式分别检测了宫颈癌细胞株CasKi和HeLa细胞TSLP和TSLPR的表达特征。我们的结果首次发现人宫颈癌细胞株CasKi和HeLa细胞均分泌TSLP,且共表达TSLPR,提示TSLP可能以自分泌的方式参与宫颈癌细胞的生物学功能调控。
肿瘤最基本的特征是细胞的失控性生长,肿瘤细胞的不断增殖是肿瘤侵袭的前提,而增殖活性是肿瘤侵袭转移的基础。为解析人重组细胞因子TSLP是否参与对CasKi和HeLa细胞的细胞活力的调控,我们利用MTT试验检测发现,一定浓度的重组细胞因子TSLP处理细胞48或72小时可以增加CasKi和HeLa细胞的细胞活力。
有研究显示乳腺癌和肺癌细胞表达TSLP,且与肿瘤的增殖和侵袭相关[5,8]。如乳腺癌细胞能以一种依赖TSLP的方式诱导DCs表达OX40L。原发性乳腺癌浸润灶中发现OX40L+DCs。OX40L+DCs在体外促进炎性Th2细胞产生IL-13和TNF。在异种移植模型中,TSLP和OX40L的中和性抗体均能抑制乳腺癌生长和IL-13的产生[5]。因此,乳腺癌细胞来源的TSLP通过诱导DCs表达OX40L,促进炎性Th2微环境,进而促使肿瘤发展。
综上所述,TSLP与宫颈癌增殖和侵袭可能存在一定的关系,对宫颈癌的发生发展可能发挥了一定作用。我们推测TSLP对宫颈癌生长的调节,一方面可能直接以自分泌的方式,活化下游STAT信号通路来促进宫颈癌细胞的细胞活力;另一方面可能通过调节肿瘤免疫微环境中免疫细胞的功能改变来间接促进宫颈癌细胞的生长。因此进一步解析TSLP调节宫颈癌细胞生长和侵袭的确切分子机制,对于阐明TSLP在宫颈癌发生发展中的调控机制,及宫颈癌的早期预防和临床治疗具有重要的理论意义。
1 Takai T.TSLP expression:cellular sources,triggers,and regulatory mechanisms[J].Allergol Int,2012;61(1):3-17.
2 He R,Geha RS.Thymic stromal lymphopoietin[J].Ann NY Acad Sci,2010;1183:13-24.
3 Miyagaki T,Sugaya M,Fujita H et al.Eotaxins and CCR3 interaction regulates the Th2 environment of cutaneous T-cell lymphoma[J].JInvest Dermatol,2010;130(9):2304-2311.
4 De Monte L,Reni M,Tassi E et al.Intratumor T helper type 2 cell infiltrate correlates with cancer-associated fibroblast thymic stromal lymphopoietin production and reduced survival in pancreatic cancer[J].JExp Med,2011;208(3):469-478.
5 Pedroza-Gonzalez A,Xu K,Wu T C et al.Thymic stromal lymphopoietin fosters human breast tumor growth by promoting type2 inflammation[J].J Exp Med,2011;208(3):479-490.
6 Wu H X,Guo P F,Jin L P et al.Functional regulation of thymic stromal lymphopoietin on proliferation and invasion of trophoblasts in human first-trimester pregnancy[J].Hum Reprod,2010;25(5):1146-1152.
7 Quentmeier H,Drexler H G,Fleckenstein D et al.Cloning of human thymic stromal lymphopoietin(TSLP)andsignaling mechanisms leading to proliferation[J].Leukemia,2001;15(8):1286-1292.
8 Li H,Zhao H,Yu J et al.Increased prevalence of regulatory T cells in the lung cancer microenvironment:a role of thymic stromal lymphopoietin[J].Cancer Immunol Immunother,2011;60(11):1587-1596.

