骨髓间充质干细胞向血管内皮细胞分化过程在银屑病发病中的作用①
张永翠 刘瑞风 任国华 朱爱茹 王 荣 李新华 尹国华 张开明
(菏泽市中医医院皮肤科,菏泽274000)
我们前期研究发现,银屑病患者BMMSCs生物学活性有异常,并发现1例父母均为银屑病的患者BMMSCs 在原代培养时即自发转 化 为 VEC[1,2]。BMMSCs是骨髓中除造血干细胞以外的另一类多能干细胞,具有自我更新和多向分化潜能,已证实这类细胞在合适的体内外特定条件下可向成骨、软骨、神经、肌肉、皮肤和VEC等多种类型的成熟细胞分化[3-5]。VEC在银屑病发病中有重要作用,因此,我们设想银屑病患者BMMSCs可能有易于向VEC分化的倾向,BMMSCs-VEC分化发育系统在银屑病微血管异常中可能发挥重要作用。为此,我们将银屑病患者和正常对照BMMSC体外定向分化为VEC,并对分化过程及分化的的VEC活性进行初步研究,研究结果验证了开始的设想,现将结果报道如下:
1 材料与方法
1.1 标本来源 银屑病组20例,均为本院皮肤科临床及病理确诊为银屑病的门诊患者,就诊前2个月内未系统使用过糖皮质激素、维甲酸类药物和免疫抑制剂。其中男12例,女8例;年龄20~45岁,平均30.56岁,病程7天~18年;皮损范围占体表面积10% ~80%。对照组15例,取自本院血液科骨穿检查正常的骨髓,性别、年龄与患者组匹配。取材均经患者同意。
1.2 主要试剂及仪器 胎牛血清(hyclone)、DMEM/F12培养基(hyclone)、人淋巴细胞分离液(天津灏洋)、胰蛋白酶(Sigma),FITC-鼠抗人CD44、PE-鼠抗人 CD34、PE-鼠抗人 HLA-DR、FITC-鼠抗人CD45、FITC-鼠抗人CD29的单克隆抗体(BD公司)、鼠抗血管性假血友病因子(VonWillebrand Factor,VWF,Invitrogen)单克隆抗体、体外血管成形试剂盒(Millipore)、血管内皮生长因子(Vascularendothelial growth factor,VEGF,Sigma)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF,Sigma公司,美国)、青链霉素缓和液(华北制药厂)、倒置相差显微镜(Olympus公司,日本)、37℃恒温培养箱(Shedon Manufactuing Inc)、流式细胞仪(BeckmanCoulter EPICS-XL型,美国)。
1.3 BMMSCs的分离及培养 从髂后上棘,采取骨髓10 ml,用DMEM/F12培养液1∶1稀释后加于淋巴细胞分离液上部,比例为2∶1,2 000 r/min,离心20分钟,吸取中间的白膜层至新的试管中,以1 000 r/min离心10分钟,弃去上清。重复洗涤细胞2次,然后加入含10%胎牛血清、青霉素100 U/ml、链霉素100μg/ml、DMEM/F12培养基重悬细胞,调整细胞浓度,以1×106ml-1密度接种于24孔培养板,置于37℃、5%CO2恒温培养箱中培养。
1.4 BMMSCs体外培养扩增 细胞培养48小时后,全量换液(弃去未贴壁的细胞),加入新鲜的含10%胎牛血清的DMEM/F12,继续培养贴壁细胞,以后每3天半量换液1次,倒置显微镜下观察生长情况。贴壁的细胞培养48小时后即伸展,成梭形或多角形并开始呈克隆性生长,即为BMMSCs。生长14天左右近80%融合时,吸净培养液,而后每孔加入新鲜培养基洗脱未贴壁的细胞,然后每孔加入含0.25%胰蛋白酶0.02%EDTA的消化液200μl消化3分钟左右,倒置显微镜下观察,待细胞变圆部分脱落后,加入含血清的培养液终止消化,并轻轻吹打,以1 000 r/min离心8分钟,去消化液,加10%胎牛血清的DMEM/F12培养液重悬,接种于24孔培养板培养,为第一代细胞,倒置显微镜下观察生长情况。按上述方法以1∶2继续消化传代培养,开始诱导分化为VEC。
1.5 BMMSCs表面标志鉴定 用FITC或PE标记的表面分子 CD44、CD29、CD34、CD45、HLA-DR 抗体对第二代BMSCs进行流式细胞术鉴定。
1.6 BMMSCs诱导VEC 在细胞传至第三代再培养2天后对银屑病组和正常对照组加入诱导剂(即bFGF 10 ng/ml、VEGF 50 ng/ml、2% 胎牛血清的DMEM/F12培养液)诱导BMMSCs向VEC分化,每3天半量换液,倒置相差显微镜下观察细胞生长情况,流式细胞术定期观察细胞分化表达情况。
1.7 流式细胞仪测 CD34、CD45、HLA-DR、ICAM-1表达 在倒置显微镜下观察,细胞形态出现VEC形态特点时,每个培养孔加入200μl 0.02%EDTA消化,用含胎牛血清的培养基终止反应,吸管仔细吹打,离心后去上清,PBS洗涤1遍,用PBS制成悬液每份1×105个细胞调整到100μl,加入荧光标记的抗体后冰上避光孵育30分钟,以1 000 r/min离心8分钟弃去PBS,再用PBS洗涤1次以去除未结合的荧光抗体,100μl Buffer重新悬浮细胞,在4℃下保存待测,用荧光标记的表面分子CD34、CD45、HLADR、ICAM-1抗体对诱导的VEC进行流式细胞术鉴定。
1.8 细胞免疫荧光法测定VEC内VWF的表达情况 当BMMSCs诱导21天,弃去培养液,PBS洗3遍,每次2分钟,4%多聚甲醛固定30分钟,PBS洗3遍,每次2分钟,0.25%TritonX-100作用10分钟,破膜处理,PBS洗3遍,每次2分钟,1%羊血清常温封闭30分钟,弃去血清加入1∶200稀释单克隆鼠抗人一抗,4℃过夜,然后弃一抗,PBS洗3遍,每次2分钟,加入1∶50稀释FITC标记的羊抗鼠二抗,37℃孵育30分钟,PBS洗3遍,每次2分钟,荧光显微镜下观察结果:荧光闪亮,呈明显的亮绿色判定为+++;荧光明亮,呈黄绿色判定为++;荧光较弱,但清楚可见判定为+;无荧光判定为-。
1.9 血管成形试验检测诱导的血管内皮细胞体外血管成形能力[6]在96孔培养板中每孔加入50μl的凝胶基质溶液,37℃孵育1小时,然后胰酶消化细胞,5×103细胞悬浮于50μl的DMEM/F12培养基中,观察3个视野形成的血管数目的平均数。
2 结果
2.1 BMMSCs培养形态学观察及表面标志的鉴定
2.1.1 形态学观察 结果显示:倒置显微镜下,银屑病组与正常对照组BMMSCs形态上无差异。BMMSCs接种3天首次换液可见少量梭形或多角形贴壁细胞;10~20天左右细胞汇合可达80% ~90%,汇合细胞形态均一,成梭形排列。
2.1.2 表面标志的鉴定 两组细胞传至第3代经流式检测,CD44(92.89%)、CD29(95.02%)均为阳性,而HLA-DR(3.79%)及造血细胞表面标志CD45(4.14%)、CD34(4.73%)阴性表达。图 1 结果表明,所培养的细胞为较纯的BMMSCs。
2.2 BMMSCs细胞诱导培养后形态学观察及表面标志的鉴定
2.2.1 形态学观察 银屑病组诱导后平均16.65天前倒置显微镜形态:细胞形态呈现BMMSCs形态的特点;而后观察细胞生长呈梭形,少部分区域呈集落生长;有的细胞形成血管腔样结构,管腔样结构周围有呈铺路石样排列的内皮样细胞(图2)。正常对照细胞组光镜下观察形态改变较晚且诱导21天形态没有变化,而且不像银屑病那么典型。
2.2.2 表面标志的鉴定 银屑病组和正常对照组诱导21天流式细胞术检测细胞表面标志CD34、CD45、HLA-DR、ICAM-1呈阳性表达,与正常对照组比较具有统计学差异(P<0.05,表1,图3)。

图1 BMMSCs的鉴定Fig.1 Phenotypic identification of BMMSCs

图2 患者组与对照组诱导21天后细胞形态学观察(×100)Fig.2 Morphological features of the induced BMMSC from psoriatic patients and control group under microscope(×100)
表1 银屑病患者组与对照组诱导的VEC表面抗原的表达(x ± s,%)Tab.1 Surface antigen expression of induced VEC between psoriasis patients and control groups( ± s,%)
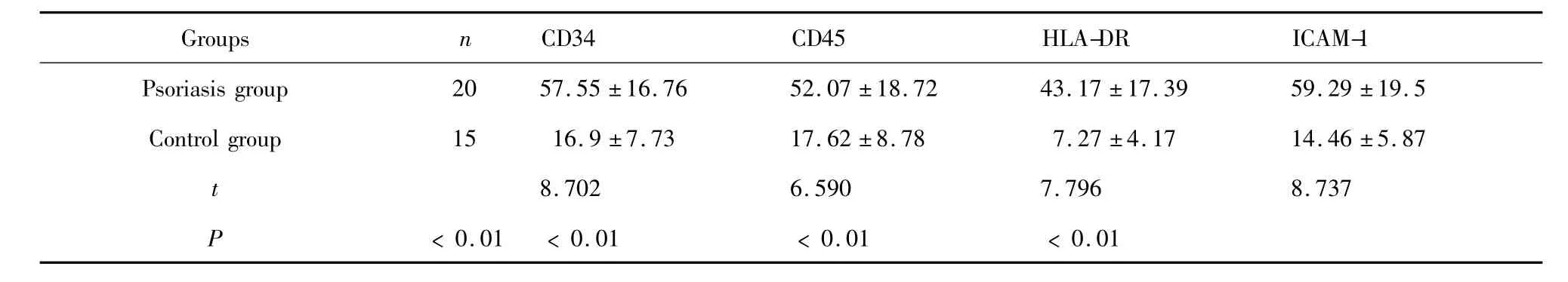
表1 银屑病患者组与对照组诱导的VEC表面抗原的表达(x ± s,%)Tab.1 Surface antigen expression of induced VEC between psoriasis patients and control groups( ± s,%)
Groups n CD34 CD45 HLA-DR ICAM-1 Psoriasis group 20 57.55 ±16.76 52.07 ±18.72 43.17 ±17.39 59.29 ±19.5 Control group 15 16.9 ±7.73 17.62 ±8.78 7.27 ±4.17 14.46 ±5.87 t 8.702 6.590 7.796 8.737 P<0.01 <0.01 <0.01 <0.01

图3 流式细胞术检测两组诱导21天内皮细胞表面标志 HLA-DR、CD34、CD45 、ICAM-1表达比较图Fig.3 The expression of endothelial-specific markers HLA-DR,CD34,CD45 and ICAM-1 was assayed by flow cytometry

表2 银屑病患者组与对照组诱导的VEC内的VWF表达情况Tab.2 The expression of endothelial-specific markers VWF was assayed by immunofluorescence cytochemistry
2.3 诱导后细胞免疫荧光分析 银屑病组与正常对照组BMMSCs诱导21天后,银屑病组可见细胞胞浆中有 VWF细胞免疫荧光,而对照组荧光强度很微弱,且可见非特异性荧光(图4),与正常对照组比较具有统计学差异(P<0.05,表2)。

图4 患者组与对照组VWF细胞免疫荧光(×100)Fig.4 Fluorescent staining of BMMSCs from a psoriatic patient and control group under microscope(×100)
2.4 诱导后的细胞体外血管成形分析 银屑病组与正常对照组BMMSCs诱导21天后,进行体外血管成形实验,5小时后倒置显微镜下观察:诱导的银屑病组可见有大量毛细血管管腔样结构形成,5例银屑病患者3个视野下平均形成的管腔数为65个;而5例对照组平均形成的管腔数为(42±1)个,但培养基中还可见没有形成管腔样结构的球形细胞存在,表明尚有部分细胞未形成血管样结构。
3 讨论
新生血管形成是银屑病皮损真皮中主要的病理变化之一,真皮乳头层微血管异常增生可能启动了皮损部位病理变化过程。研究显示,银屑病皮损表皮分泌VEGF,并与真皮毛细血管增生扩张密切相关;VEGF及其受体在银屑病新生血管形成中起重要作用[7];另外,其它血管活性因子(如内皮素、一氧化氮、降钙素基因相关肽等)在银屑病皮损中含量显著增高,通过一系列作用影响和调节局部微血管的功能及皮肤炎症[8]。然而,银屑病明显且复杂的遗传背景提示固有的内部因素可能在银屑病局部微血管异常中发挥更为重要的作用。Prodanovich等[9]的近期研究表明,银屑病患者比对照组更易患动脉粥样硬化,也更易患缺血性心脏病、脑血管疾病或外周血管疾病;另外,重症银屑病可伴有系统性血管通透性增高[10],均提示银屑病血管异常可能是一种全身性、系统性反应。
目前关于银屑病VEC研究全部集中在VEC本身异常及其如何参与银屑病发生,但关于VEC障碍又是何种因素所致,目前尚不太清楚。根据对T细胞研究结果[11,12],推测造血干细胞异常参与了银屑病发病。经过初步研究我们首先发现银屑病患者骨髓造血干细胞定向分化的T细胞具有银屑病T细胞活性,细胞因子产生及对表皮等作用与银屑病外周血T细胞有很多相似的免疫特性[13-15]。由于骨髓造血微环境对造血干细胞分化有重要影响,且BMMSCs是造血微环境的重要组成部分,对造血细胞的增殖和分化起着重要的调控作用,我们前期对银屑病患者BMMSCs进行了研究,发现银屑病患者BMMSCs生物学活性有异常[1],并发现1例父母均为银屑病的患者BMMSCs在原代培养时即自发转化为VEC[2]。故我们设想BMMSCs-VEC分化发育系统异常,实验结果验证了开始的设想,研究分析如下:
CD34是一种分子质量为120 ku的单链跨膜蛋白,表达于早期淋巴造血干、祖细胞、VEC、胚胎成纤维细胞和某些神经组织细胞[16];ICAM-1在血管新生过程中也有重要作用,肿瘤、动脉粥样硬化、糖尿病视网膜病变及损伤修复中是促进血管新生的因子之一;HLA-DR主要存在于B淋巴细胞、单个核细胞及VEC的细胞膜上,在较为原始的干细胞中表达较少[17],本实验结果显示银屑病组流式细胞术检测细胞表面标志 CD34、CD45、HLA-DR 、ICAM-1呈阳性表达,与正常对照组比较具有统计学差异(P<0.01)。血管性假血友病因子(VWF)主要由血管内皮细胞合成,存在于血管内皮细胞的胞浆中,可以作为内皮细胞的鉴定标志,免疫细胞荧光结果显示银屑病组VWF的表达量高于对照组。以上结果显示银屑病组BMMSCs具有易于分化为VEC的倾向。
BMMSCs是多潜能干细胞可以向多种成熟细胞分化,其分化方向取决于体外培养条件及培养时间。由于BMMSCs向VEC分化需要时间较长,且体外血管成形实验对培养细胞同期性要求较高,因此在该部分实验中我们仅对10例样本进行研究。体外血管成形试验显示银屑病组形成的管腔个数多于对照组,提示银屑病患者分化的VEC血管成形能力明显高于对照组,BMMSCs-VEC分化发育系统异常可能是导致银屑病患者皮损真皮乳头层微血管异常增生的根源。
1 邓 起,刘瑞风,王 丽et al.银屑病患者骨髓基质细胞白介素-8、粒细胞-巨噬细胞集落刺激因子分泌水平的实验研究[J].临床皮肤科杂志,2010;39(9):545-547.
2 刘瑞风,冯海燕,张 静et al.银屑病患者骨髓间充质干细胞体外自发向血管内皮细胞分化[J].临床皮肤科杂志,2010;39(7):7-10.
3 Grove JE ,Bruscia E ,Krause D S et al.Plasticity of bone-derived stem cells[J].Stem Cells,2004;22:487-500.
4 Jiang Y,Jahagirdar B N,Reinhardt R L et al.Pluripotency of mesenchymal stem cells derived from adult marrow[J] .Nature,2002;418:41-49.
5 Bonnet D.Biology of human bone marrow stem cells[J] .Clin Exp Med,2003;3:140-149.
6 段华新,卢光琇,程腊梅.JLFA-1和VLA-4参与人高增殖潜能内皮祖细胞与血管内皮的黏附和跨内皮迁移[J].中国实验血液学杂志,2008;16(3):671-675.
7 Elias PM,Arbiser J,Brown B E et al.Epidermal vascular endothelial growth factor production is required for permeability barrier homeostasis,dermal angiogenesis,and the development of epidermal hyperplasia:implications for the pathogenesis of Psoriasis[J].Am J Pathol,2008;173:689-699.
8 张锡宝,罗 权,吴志华et al.血管内皮生长因子及其受体在银屑病发病中的作用及意义[J].中华皮肤科杂志,2005;38(1):8-10.
9 Prodanovich S,Kirsner R S,Kravetz JD et al.Association of psoriasis with coronary artery,cerebrovascular,and peripheral vascular diseases and mortality[J].Arch Dermatol,2009;145:700-703.
10 Creamer D,Allen M,Jaggar R et al.Mediation of Systemic vascular hyperpermeability in severe psoriasis by circulating vascular endothelial growth factor[J].Arch Dermatol,2002;138:791-796.
11 Li X,Fan X,Zhang K et al.Influence of psoriatic peripheral blood CD4+T and CD8+T lymphocytes on C-myc,Bcl-xL and Ki67 gene expression in keratinocytes[J].Eur J Dermatol,2007;17:392-396.12 Ferran M,Giménez-Arnau A M,Bellosillo B et al.Effector function of CLA(+)T lymphocytes on autologous keratinocytes in psoriasis[J].Actas Dermosifiliogr,2008;99(9):701-707.
13 尹国华,李新华,张开明et al..银屑病患者骨髓CD34+细胞体外定向分化的T细胞活性研究[J].中华皮肤科杂志,2006;39(2):124-127.
14 李新华,张开明,尹国华.胸腺基质细胞支持下骨髓CD34+细胞向T细胞体外定向分化[J].中国免疫学杂志,2008;24(8):786-789.
15 Zhang K M,Li X H,Yin GH et al.Functional characterization of T cells differentiated in vitro from bone marrow-derived CD34+cells of psoriatic patients with family history[J].Experimental Dermatology,2010;19:128-135.
16 周 俊,朱 兵,杜海燕.流式细胞术联合检测骨髓细胞CD271、CD133、CD34的表达与分析[J].中国实验血液学杂志,2009;19(1):133-136.
17 Le Blanc K,Tammik C ,Rosendahl K et al.HLA expression and immunologic properties of differentieted and undifferentiated mesenchymal stemcells[J].Exp Hematol,2003;31(10):890-896.

