法尼醇X受体在糖尿病肾病肾组织中的表达及意义
丁涵露,王 莉,汪 伟,邹玉荣,廖常志,张 萍
(四川省医学科学院·四川省人民医院肾内科,四川 成都 610072)
糖尿病肾病(diabetic nephropathy,DN)发病机制不完全清楚,炎症机制在DN发病中的作用正得到重视,而机体内源性抗炎机制目前研究较少。法尼醇X受体(farnesoid X receptor,FXR)是一种重要的核受体,除参与胆固醇、脂类和葡萄糖等物质代谢过程外[1,2],还具有重要抗炎作用[3]。巨噬细胞浸润肾组织引发的炎症反应是造成DN病变持续进展的重要机制[4],有关人类DN肾组织FXR表达及其与巨噬细胞浸润、肾损伤之间的关系目前未见报道,因此,明确FXR在糖尿病肾病肾组织中的表达及其与炎细胞浸润、肾损伤之间的关系将有助于明确DN炎症反应的调控。
1 对象与方法
1.1 研究对象 试验对象15例均为我院2005~2011年住院DN患者(DN组),其中男7例,女8例,年龄(54±8.5)岁,均经肾活检组织病理检查确诊为DN。正常组5例,年龄(52±6.9)岁,来自我院肾肿瘤做肾切术但远离肿瘤部位的肾组织,均经光镜证实肾组织正常。
1.2 材料 兔抗人FXR多克隆抗体购于美国Ebioscience公司,小鼠抗人CD68单克隆抗体、超敏SP(鼠/兔)免疫组化试剂盒和DAB显色试剂盒购于北京中杉公司。
1.3 FXR、CD68免疫组织化学染色 石蜡切片4 μm,常规脱蜡、水洗后,3%H2O2室温 15 min,FXR行EDTA微波修复,CD68行胰酶修复,分别滴加一抗:兔抗人FXR多克隆抗体(稀释比例为1∶200)和小鼠抗人CD68抗体原液,4℃过夜。次日0.01 mol/L PBS洗5 min×3次后,即按照超敏SP免疫组化试剂盒说明书进行操作,DAB显色,苏木精复染细胞核。阴性对照以PBS代替一抗,同法操作。
1.4 肾小球病理损害程度的判定 石蜡切片行HE、PAS等常规染色,PAS染色切片在200倍视野下进行分析,每张切片选择10个正切的肾小球,计算系膜区扩张指数(以系膜区/毛细血管襻面积比表示),取平均值作为每个标本的系膜区扩张指数[5]。
1.5 肾小管-间质病理损害程度的判定 根据肾小管扩张程度、肾小管萎缩程度、肾小管上皮细胞空泡变性程度、肾小管上皮细胞坏死程度、间质纤维化程度及肾间质炎症细胞浸润程度的无、轻、中、重分别计0、1、2、3,每例样本观察10个视野,结果以每例样本的相加总和平均值表示[6]。
1.6 FXR、CD68阳性细胞结果判断
1.6.1 FXR免疫组化表达 采用半定量法分析,由两人在事先不知道标本临床指标和肾脏病理结果的情况下同时阅片。阳性评分方法:①按阳性范围记分:无为0分,<25%为1分,26% ~50%为2分,51% ~75%为3分,>75%为4分;②按阳性程度记分,0分:无染色;1分:弱阳性;2分:中度阳性;3分:强阳性;4分:极强阳性。③阳性范围和阳性程度的评分相乘结果,即该例的阳性积分[7]。
1.6.2 CD68表达观察 每例标本选取皮质肾小管-间质10个高倍视野(×400)计数平均阳性细胞数[7]。
1.7 统计学方法 以SPSS 11.0统计软件处理数据。计量资料数据以均数±标准差表示,正态计量资料采用单因素方差分析或t检验。FXR阳性表达积分与CD68阳性细胞数、临床指标和肾组织病理变化的相关分析用Spearman等级相关分析。
2 结果
2.1 一般情况 正常组和DN组年龄[(52±6.9)岁 vs(54±8.5)岁]、内生肌酐清除率[(99.7±10.1)ml/(min·1.73m2)vs(92.4±9.7)ml/(min·1.73m2)]差异均无统计学意义(P>0.05);而DN组患者尿蛋白、低密度脂蛋白胆固醇(LDL)和甘油三酯(TG)水平以及系膜区扩张指数和肾小管病变积分明显高于正常对照组(P<0.01),见表1。

表1 两组研究对象临床特征及肾脏病理比较
2.2 FXR和CD68在肾组织中的表达 在正常和DN肾组织中,肾小球系膜细胞、内皮细胞和足细胞、近端肾小管上皮细胞、远端肾小管上皮细胞及集合管上皮细胞均表达FXR(图1a、图2a,表2),免疫组化阳性染色颗粒主要位于细胞浆中,表达强度正常组较DN组弱。CD68在正常肾组织的肾间质和肾小球无明显表达(图1b,表2),而在DN肾小球和肾小管间质均有CD68表达(图2b,表2),阴性对照未见FXR和CD68阳性染色。
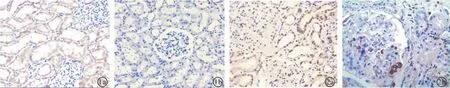
图1 FXR(a)和CD68(b)在正常肾组织中的表达(免疫组化×200);图2 FXR(a)和CD68(b)在糖尿病肾病肾组织表达增强(a免疫组化×200;b免疫组化×400)
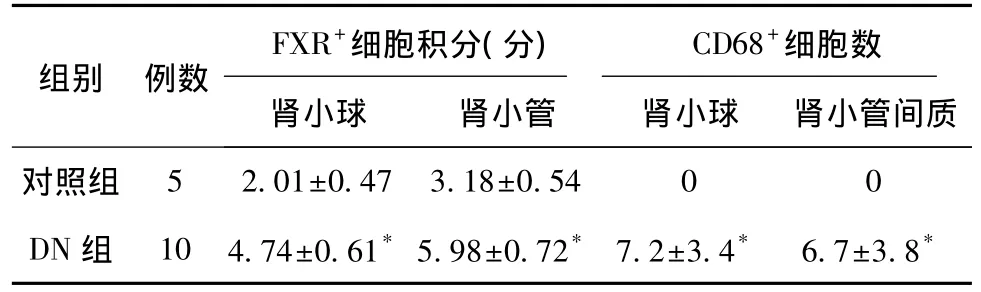
表2 FXR和CD68在肾小球、肾小管-间质内阳性强度积分比较
2.3 FXR阳性表达积分与CD68阳性+细胞积分和临床指标之间的相关性分析 肾组织内FXR阳性表达积分与CD68阳性细胞数以及LDL和TG水平呈负相关(r分别为-0.742、-0.654、-0.632,P 均<0.01);FXR阳性表达积分与肾小球系膜扩张指数和肾小管-间质病变呈负相关(r分别为-0.587、-0.636,P均<0.01),与24小时尿蛋白定量无相关性。
3 讨论
FXR是核受体家族成员中一种重要的核受体,在正常肝脏、肾脏和小肠高表达,初级胆酸是FXR亲和力最强的内源性配体。体外试验发现肾小球膜细胞中FXR过度表达或是以人工合成配体GW4064激活FXR后,能抑制系膜细胞上固醇调控元件结合蛋白-1c(SREBP-1c)及其他生脂基因转化生长因子(TGF)-β和白细胞介素(IL-6)的表达,从而减轻系膜细胞的脂质和炎症损害[8]。本试验发现,FXR主要表达在系膜细胞和肾小管上皮细胞,DN肾组织FXR表达较正常肾组织增强,且与肾小球系膜区扩张指数负相关,推测DN患者系膜细胞增殖和细胞外基质产生增加,FXR代偿性表达增加以抑制系膜基质增加。内皮细胞、足细胞损害也是促进DN病变进展的重要机制,有报道FXR可在足细胞、内皮细胞表达[8],在本研究中我们也发现少量FXR在足细胞和肾小球毛细血管内皮细胞位置表达,可能与其抗炎反应有关。本试验中,肾小管上皮细胞表达FXR在DN组织较正常组织增强,FXR阳性积分与肾小管间质病变呈负相关,提示FXR可能参与了肾小管间质炎症反应和纤维化的病变。
DN存在明显脂代谢紊乱,脂质在肾小球沉积可引起肾小球单核细胞浸润、泡沫细胞和含胆固醇/胆固醇酯细胞增多,系膜细胞增生及细胞外基质积聚,在表现为I型DN的C57BL/6鼠,当FXR基因敲除后,肾损害较野生型糖尿病C57BL/6小鼠明显加重,而给予DBA/2J小鼠FXR激动剂INT-747后,肾组织脂质沉积减少,尿蛋白、肾小球硬化、肾间质纤维化、氧化应激减轻,巨噬细胞浸润减少,FXR配体通过激活Akita和OVE26小鼠肾组织FXR及FXR靶基因小异源二聚体伴侣受体 SHP,抑制SREBP-1和PPARalpha活性,减少脂肪酸、甘油三酯在肾组织的沉积,从而减轻蛋白尿和细胞外基质沉积,说明FXR具有通过调节脂代谢而保护肾组织的作用[8]。本试验结果显示,DN患者血 LDL、TG较正常组升高,肾组织FXR表达增加,其阳性积分与血LDL、TG呈负相关,提示肾组织表达FXR增加以加强对LDL、TG的清除,减轻脂质沉积增加所引起的肾损害,但需要进一步观察肾组织脂质沉积和FXR及其靶信号通路SREBP-1等的表达,以明确FXR在DN脂质肾损害中的作用。
FXR除参与胆固醇、脂类和葡萄糖等物质代谢过程外[1,2],还具有重要抗炎作用[3],其在抑制多种器官的炎症以及全身性炎症的发生和发展中发挥了重要作用[9~11]。炎症反应在DN发病机制中占有重要位置,浸润于肾组织的巨噬细胞通过释放炎性介质,在DN中起着重要的致病作用[12],与蛋白尿程度及肾功能衰退密切相关[13],因此,本研究拟通过观察FXR表达和巨噬细胞标志物CD68表达,探讨FXR与DN炎症反应之间的关系,结果发现,DN肾组织较正常肾组织,FXR和CD68表达均增加,相关分析显示,DN肾组织FXR阳性表达积分和CD68阳性表达积分呈负相关。国外研究发现FXR不仅抑制炎症反应,而且FXR的活化可在转录水平抑制NF-KB诱导的炎症因子,如诱导型一氧化氮合酶(iNOS)、环氧化酶-2(COX-2)、干扰素诱导蛋白10和干扰素 r的表达[9],下调单核细胞趋化蛋白-1(MCP-1)[2],因此本研究中表达增强的FXR有可能通过抑制MCP-1表达而抑制巨噬细胞的迁移和浸润,减轻炎症反应和肾损害加重,而且在炎症刺激下,FXR的活性及表达水平被抑制[1],因此炎症反应和FXR相互影响而参与DN炎症反应的发生发展,其具体病理生理意义还需要研究。
[1]Fiorucci S,Mencarelli A,Palladino G,et al.Bile-acid-activated receptors:targeting TGR5 and farnesoid-X-receptor in lipid and glucose disorders[J].Trends Pharmacol Sci,2009,30(11):570-580.
[2]Zhang S,Wang J,Liu Q,et al.Farnesoid X receptor agonist WAY-362450 attenuates liver inflammation and fibrosis in murine model of non-alcoholic steatohepatitis[J].J Hepatol,2009,51(2):380-388.
[3]Wang XX,Jiang T,Shen Y,et al.The farnesoid X receptor modulates renal lipid metabolism and diet-induced renal inflammation,fibrosis,and proteinuria[J].Am J Physiol Renal Physiol,2009,297(6):F1587-1596.
[4]Schwartz YSh,Khoshchenko OM,Dushkin MI,et al.Effects of cholesterol and nuclear hormone receptor agonists on the production of transforming growth factor-beta in macrophages[J].Bull Exp Biol Med,2009,148(3):406-409.
[5]Shankland SJ,Scholey JW,Ly H et al.Expression of transforming growth factor-beta 1 during diabetic renal hypertrophy[J].Kidney Int,1994,46(2):42-43.
[6]Austin H,Muenz L,Joyce KM,et al.Diffues proliferative lupus nephritis:identification of specific pathologic features affecting renal outcome[J].Kidney Int,1984,25:689-695.
[7]Zhao-Long Wu,Nian-Song Wang,Xun-Hui Xu,et al.Positive and negative hepatitis B virus in renal biopsies of IgA nephropathy:an 85-case clinicopathological analysis[J].Nephrology,2001,6(4):185-189.
[8]Jiang T,Wang XX,Scherzer P,et al.Farnesoid X receptor modulates renal lipid metabolism,fibrosis,and diabetic nephropathy[J].Diabetes,2007,56(10):2485-2493.
[9]Inge AM,van den Oever.Endothelial Dysfunction,Inflammation,and Apoptosis in Diabetes Mellitus[A].Mediators of Inflammation,2010,Article ID 792393:15.
[10]Ronald B.Cytokine and Cytokine-Like Inflammation Markers,Endothelial Dysfunction,and Imbalanced Coagulation in Development of Diabetes and Its Complications[J].J Clin Endocrinol Metab,2009,94(9):3171-3182.
[11]Flatt B,Martin R,Wang TL,et al.Discovery of XL335(WAY-362450),a highly potent,selective,and orally active agonist of the farnesoid X receptor(FXR)[J].J Med Chem,2009,52(4):904-907.
[12]Nakajima K,Tanaka Y,Nomiyama T,et al.RANTES promoter genotype is associated with diabetic nephropathy in type 2 diabetic subjects[J].Diabetes Care,2003,26(3):892-898.
[13]Sasaki S,Nishihira J,Ishibashi T,et al.Transgene of MIF induces podocyte injury and progressive mesangial sclerosis in the mouse kidney[J].Kidney Int,2004,65:469-481.

