冠心病患者发生重症感染的处理
潘灵爱,黄晓波
(四川省医学科学院·四川省人民医院外科ICU,四川 成都 610072)
1 背景介绍
1.1 危险因素多 据统计2006年在美国有50万~70万人反复发作冠心病。冠心病导致的直接和间接的经济损失达1425亿美元。每年约有100万人需行心导管检查,约40万人行心血管血运重建术[1]。目前冠心病的治疗主要包括经皮冠脉介入治疗(PCI)和冠脉搭桥手术(CABG)。手术也随之带来了一系列的并发症,其中包括重症感染。手术本身的感染的发生率低,脓毒症的发生率更低(0.39%)[2],但心脏手术在术中及术后监测措施中有很多侵入性操作,如主动脉球囊反搏(IABP)、漂浮导管(SWAN-GANS)、脉搏指示持续心输出量(PICCO)等监测及辅助措施的使用大大增加了感染风险。一旦发生感染则会给患者带来灾难性的后果[3]。发展为脓毒血症者,死亡率高达 17% ~65%。有数据显示腿部获取大隐静脉后伤口相关的并发症大约1% ~43.8%[4]。呼吸机的使用,也带来了呼吸机相关肺部感染[5]。也有文献显示CABG后发生严重纵膈感染的危险因素,但这些因素都不能在术前就确定,且也没有提示何时是干预的最好时机[6,7]。所以冠心病术后感染部位多、后果严重等特点应引起重症医生的高度重视。
CABG术后感染评估一直欠缺一个合理的评分系统。有研究分析了美国胸外科医师协会(STS)的国家心脏数据库300000例CABG术后患者的感染情况,该研究调查了CABG术后感染的发生率、感染的高危因素,制订了评估患者感染的简易床旁评分系统。研究指出冠脉搭桥术后感染的发生率约3.51%,(其中25.1%发生纵膈炎,32.6%腿部静脉获取部位感染,35%发生败血症,0.5%胸骨切开部位感染,6.8%患者多部位感染),Joannis等[8]研究指出术后感染性心内膜炎的发病率为0.96%。感染后患者的死亡率较未发生感染的患者明显增高(17.3%vs 3.9%,P<0.0001),术后住院日超过14天的患者明显增多。该研究指出术前的高危因素包括体重指数(BMI)>40 kg/m2、糖尿病、血液透析、心源性休克、年龄>85岁、免疫抑制治疗;术中的操作时间尤其是体外循环的时间及IABP的应用也会增加感染的风险[9]。
1.2 监测指标多样化 Michalopoulos等[10]纳入了心外科2615例心脏术后患者,脓毒症的发生率约2%,主要临床表现包括:低氧(41%)、发热(39%)、代谢性酸中毒(36%)、急性肾功能衰竭(36%)、心律失常(33%)、低血压(28%)及意识障碍(22%)。但冠脉搭桥术后早期感染难以认识,术后三天患者血象、体温及PCT等传统感染监测指标均有升高,会误导医护人员的诊断,很可能会延误治疗时机。在临床上有很多评估全身炎症反应的指。其中一般指标:①发热(中心体温>38.3℃);②低体温(中心体温<36℃);③心率>90次/min或大于不同年龄段正常心率范围2个标准差;④气促,呼吸频率>30次/min;⑤意识改变;⑥明显水肿或液体正平衡(>20 mg/kg超过 24 h);⑦ 高糖血症(血糖>7.7 mmol/L)而无糖尿病史。炎症反应参数包括:①白细胞增多症(白细胞计数>12×109);②白细胞减少症(白细胞计数<4×109);③白细胞计数正常,但不成熟白细胞>0.10;④血浆C反应蛋白>正常值2个标准差;⑤前降钙素原>正常值2个标准差。血流动力学参数:①低血压(收缩压<90 mmHg,平均动脉压<70 mmHg,或成人收缩压下降>40 mmHg);②混合静脉血氧饱和度>70%。器官功能障碍指标:①低氧血症,氧和指数<300 mmHg;②急性少尿[尿量<0.5 ml/(kg·h)];③肌酐显著增加;④凝血异常;⑤腹胀,腹内压显著升高;⑥血小板减少,计数<100×109。组织灌注参数:乳酸明显增高,>3 mmol/L,毛细血管再充盈时间延长或皮肤出现花斑。在治疗过程中出现上述征象应提高警惕。此外,Favory等[11]指出术后心肌肌钙蛋白(cTnT)持续升高与左室收缩功能减低相关,且心肌肌钙蛋白升高程度与脓毒性休克患者低血压耐受程度和血管活性药物的支持强度有关。River等[12]研究发现钠尿肽(BNP)升高程度与心功能不全程度和病死率相关。
2 治疗措施
鉴于心脏术后脓毒症死亡率高,且目前心脏内外科对脓毒症的认识尚较缺乏,作为重症医生在治疗上应做到以下几点:
2.1 争取黄金治疗时间 6小时内应做到早期识别、早期培养和抗生素治疗、早期目标指导治疗(EGDT)。Silva等[2]研究指出目前应用的EGDT方案同样适用于冠心病患者发生感染性休克患者,它能够明显减少死亡率,改善患者预后。但在液体复苏时容量的控制应尽可能的兼顾到心功能的情况。目前已有改良的EGDT方案(见图1)。在液体选择方面,最新的欧洲液体复苏指南提出严重败血症患者液体复苏时应使用人血白蛋白,对于心功能不全患者,更应用有限的液体量达到最大程度的扩容效果。
2.2 寻找病原学证据 祛除感染源,寻找病原学证据。应立即采取血培养,在抗生素使用前搜集细菌学证据。及时手术清创引流,加强换药。对于肺部感染患者,加强纤支镜支气管肺泡灌洗,寻找痰液细菌学证据,痰液引流较好可明显降低感染评分。但应注意动作轻柔,避免诱发心律失常和心功能不全。
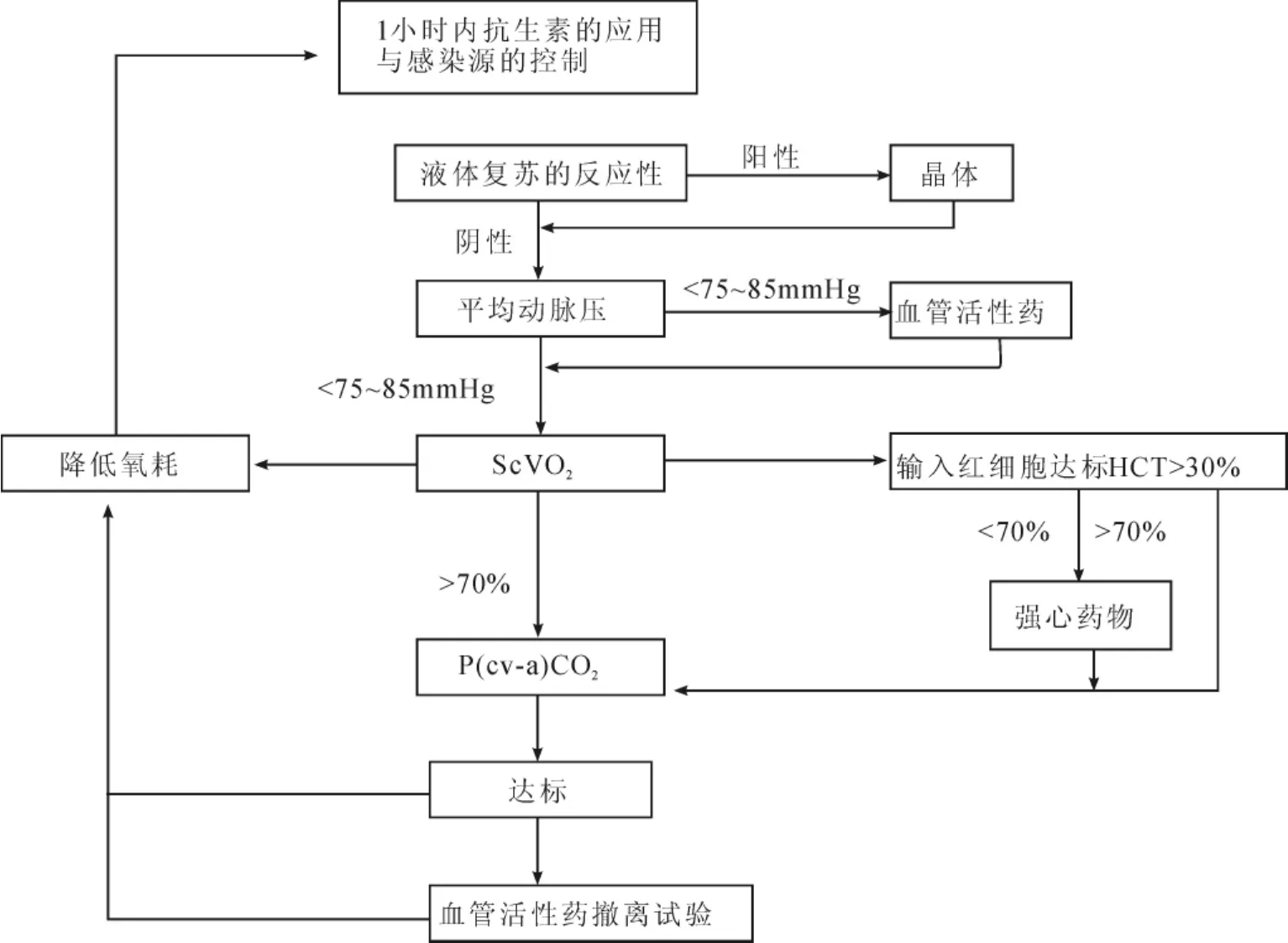
图1 改良的EDT方案流程图
2.3 正确评估容量 传统上使用中心静脉压(CVP)或肺动脉楔压(PAOP)估计容量或指导液体复苏,但心功能不全尤其是右心功能不全患者,这些指标往往不能准确估测容量复苏效果。目前认为在剑突下使用经胸超声测量下腔静脉(IVC),其直径随呼吸的改变对于容量的判断更可靠,对复苏更有指导意义[13]。另一个可靠性较高的指标是房间隔活动情况,能反应左右心房的压力差及PAOP[14]。正常情况下房间隔在收缩中期轻微的一过性的右向左移动,如移动加剧提示容量不足,出现左向右移动则提示容量偏多。此外,围手术期心脏彩超可检查有无瓣膜赘生物等感染性心内膜炎征象及评估有无心室壁运动异常从而评价心肌收缩力。在液体复苏时也可选择PICCO等措施监测血管外肺水量和心指数的变化来评估液体复苏效果。此外,目前临床上还有许多无创监测的方法,尚需进一步临床试验证实,如经胸生物阻抗法(BioZ ICG)、经胸生物电阻抗法(NICOM)、二氧化碳重吸法(NICO)等方法。
2.4 利用心脏辅助装置 心血管术后常常伴发严重左心功能衰竭,若并发感染,则心功能衰竭会进行性加重,出现严重的难以纠正的代谢性酸中毒。此时心脏对血管活性药物的反应差,心脏代偿空间很小,需要心脏辅助装置来改善患者心功能。IABP和体外膜肺氧和(ECMO)均可减小左室前负荷、减少心脏做功促进心功能恢复。同时ECMO还可时肺脏得以休息,对并发严重肺部感染患者有较大帮助。当IABPA、有创通气、血管活性药物均应用后仍存在组织氧供不足的表现时,ECMO是一个很好的选择。心脏术后约1.0%的患者心脏和肺脏功能障碍难以控制,需 ECMO 支持[15]。
2.5 浅低温疗法 低温可降低基础代谢。体温每降低1℃,则基础代谢减少13%[16]。中心血温降至34℃可降低约45%的代谢,使心脏做功明显减少,但温度过低也会带来心律失常等一系列并发症。持续血液净化(CRRT)恰恰能精确地控制体温,使机体的温度维持在一个理想的水平从而提高了患者对缺血缺氧的耐受性。研究还发现利用CRRT能清除循环中的炎性介质和心肌抑制因子,能够改善对药物和IABP治疗无效的心衰患者的心功能[17]。利用CRRT可滤除过多的水分迅速减低心脏前负荷、减少心脏做功。心衰患者往往还并发肾前性灌注不足从而存在内环境紊乱的问题,CRRT可保证内环境的稳定,从而在保证心脏能够最大程度的减轻负荷而又保证内环境的稳定。
2.6 药物选择要优化 去甲肾上腺素可通过提高血管阻力使血压升高,对心脏的影响较小。但对于冠脉搭桥术后病人,若去甲肾上腺素剂量过大,会对桥血管产生不良影响,此时可适当加用多巴酚丁胺等药物。此外,左西孟旦和奈西立肽是新型血管活性药物,对心功能衰竭有一定疗效。感染性休克时应用可达到维持心排量、增加组织氧供、缓解微循环功能障碍、缓解呼吸困难的效果[18,19]。
2.7 充分镇静镇痛 疼痛、气管插管等各种不适均可增加患者氧耗及心功能负担,镇静镇痛对于处于应激状态的患者尤其对伴发心功能不全患者能起到最大程度减负作用。临床中镇静药物多种多样,应尽量选择镇静效果较好同事对心血管系统影响小的药物。
3 小结
总之,心脏重症是重症医学的“重中之重”,我们应尽可能的利用ICU的高级监护措施将其融合入心脏内外科。但心脏重症之路尚在探索之中,更优化的治疗方案还需在临床及科研工作中进一步探讨,相信重症医生的心脏之路会越走越宽、越走越好。
[1]Thom T,Haasw N,Rosamond W.Heart disease and stroke statistics—2006 update[J].Circulation,2006,113(6):85-151.
[2]Oliveira DC,Oliveria JB,Silva RF.Sepsis in the postoperative period of cardiac surgery:problem description[J].Arq Bras Cardiol,2010,94(3):352-356.
[3]Slaughter MS,Olson MM,Lee JT.A fifteen-year wound surveillance study after coronary artery bypass[J].Ann Thoracic Surg,1993,56(5):1063-1068.
[4]L'Ecuyer PB,Murphy D,Little JR.The epidemiology of chest and leg wound infections following cardiothoracic surgery[J].Clin Infec Dis,1996,22(3):424-429.
[5]Linnane B,McNally P.Bronchoalveolar Lavage-Directed Therapy in Children With Cystic Fibrosis and Pseudomonas aeruginosa Infection[J].JAMA,2011,306(16):1761-1761.
[6]Abboud CS,Wey SB,Baltar VT.Risk factors for mediastinitis after cardiac surgery[J].Ann Thoracic Surg,2004,77(2):676-683.
[7]Wang FD,Chang CH.Risk factors of deep sternal wound infections in coronary artery bypass graft surgery[J].Cardiovas Surg,2000,41(5):709.
[8]Toumpoulis IK,Anagnostopoulos CE.Risk factors for sepsis and endocarditis and long-term survival following coronary artery bypass grafting[J].World J Surgery,2005,29(5):621-627.
[9]Fowler VG,Muhlbaier LH,Corey GR.Clinical predictors of major infections after cardiac surgery[J].Circulation,2005,112(9 suppl):358-365.
[10]Michalopoulos A,Stavridis G,Geroulanos S.Severe sepsis in cardiac surgical patients[J].Eur J Surgery,1998,164(3):217-222.
[11]Favory R,Neviere R.Bench-to-bedside review:significance and interpretation of elevated troponin in septic patients[J].Crit Care,2006,10:224.
[12]Rivers EP,Otero R,McCord J.Clinical utility of B-type natriuretic peptide in early severe sepsis and septic shock[J].J Intens Care Med,2007,22(6):363-373.
[13]Royse CF,Rovse AG,Soeding PF.Shape and movement of the interatrial septum predicts change in pulmonary capillary wedge pressure[J].Ann thorac Cardiovasc Surgery,2001,7(2):79.
[14]Perlas A,Lupu CM,Chan VWS.Ultrasound assessment of gastric content and volume[J].Anesthesiology,2009,111(1):82.
[15]Smith C,Bellomo R,Raman JS.An extracorporeal membrane oxygenation-based approach to cardiogenic shock in an older population[J].Ann Thoracic Surgery,2001,71(5):1421-1427.
[16]Colafranceschi AS,Monterio AJO.Adult extracorporeal life support:a failed or forgotten concept[J].Arq Bras Cardiol,2008,91(1):36-41.
[17]Jander A,Tkaczyk M.Continuous veno-venous hemodiafiltration in children after cardiac surgery[J].Eur J Cardio Thorac Surg,2007,31(6):1022-1028.
[18]Rehberg S,Ertmer C,Morelli A.Combined arginine vasopressin and levosimendan:A promising therapy for septic shock[J].Crit Care Med,2011,39(4):922.
[19]Fries M,Ince C,Rossaint R.Levosimendan but not norepinephrine improves microvascular oxygenation during experimental septic shock[J].Crit Care Med,2008,36(6):1886.

