深海独岛枝芽孢杆菌A493产活性物质特性与发酵条件优化研究
陈 莉,张少博,黄 典,邵宗泽,孙风芹,王雪飞,喻子牛,张吉斌
(1.华中农业大学 农业微生物学国家重点实验室 微生物农药国家工程研究中心,湖北 武汉 430070;2.国家海洋局第三海洋研究所 海洋生物遗传资源重点实验室,福建 厦门 361005)
海洋微生物资源极其丰富。近年来,由于研究者对海洋生物研究的不断深入,发现了越来越多的来源于海洋微生物的生物活性物质。这些海洋源活性物质结构新颖、种类繁多,成为新药开发的重要来源之一。此外,海洋源微生物的活性物质在化工、食品甚至农药等领域也都有着广阔的应用前景,已经成为海洋资源开发的重要内容之一[1]。国外很早就开始了海洋源微生物药物的开发研究,并已经取得了许多引人注目的成果,但海洋源微生物农药领域的研究才刚刚开始,我们应该抓住这一有利时机大力发展我国海洋源微生物农药产业。
水稻白叶枯病是由水稻黄单胞菌(Xanthomonasoryzae)引起的,最早于1884年在日本福冈地区发现,后随种子调运,病区不断扩大,其中中国、日本和印度发生比较严重。1944年Waksman从灰色链霉菌中发现了链霉素,对水稻白叶枯病有很好的防治效果[2]。目前国内外主要还是利用陆地微生物来进行水稻白叶枯病的防治。
枝芽孢杆菌属(Virgibacillussp.)的前身为泛酸芽孢杆菌属(Bacilluspantothenticussp.),是1998年Heyndrickx等通过rDNA扩增片段限制性内切酶和生理生化鉴定等方法来确定分类的[3]。近几年,陆续有一些新分离的海洋枝芽孢杆菌被报道,例如中国南海硇洲岛附近水域分离得到的Virgibacilluszhanjiangensissp.nov.[4],韩国黄海海域分离得到的Virgibacillusbyunsanensissp.nov.[5]和Virgibacilluscampisalissp.nov.[6]等。运用海洋来源尤其是深海来源的枝芽孢杆菌进行生物防治目前还未见报道,随着该属菌株类型的逐渐增多,未来很有可能成为海洋活性物质研究的热点。
作者以深海独岛枝芽孢杆菌A493为研究对象,研究了其产活性物质特性及发酵条件的优化,以期发现新型活性物质并提高活性物质的产量,为后续深入研究提供可靠的依据。
1 实验
1.1 菌种与培养基
病原指示菌:水稻黄单胞菌(Xanthomonasoryzaepv.oryzae)pxo99,由华中农业大学农业微生物学国家重点实验室菌种保藏中心(CCAM)提供。
海洋菌:海洋独岛枝芽孢杆菌A493(V.dokdonensisMCCC1A00493),由国家海洋局第三海洋研究所海洋生物遗传资源重点实验室鉴定并提供。该菌分离自东太平洋多金属结核区,采集深度4754 m,站点:ES0304。
海洋菌培养基(2216e):蛋白胨10 g,酵母粉5 g,牛肉浸粉1 g,乙酸钠1 g,硝酸铵0.2 g,柠檬酸钠0.5 g,柠檬酸铁0.1 g,人工海水定容至1 L,pH=7.6±0.2。
水稻黄单胞菌培养基:马铃薯300 g,蔗糖15 g,Na2HPO4·12H2O 2 g,Ca(NO3)2·4H2O 0.5 g,蛋白胨5.0 g,蒸馏水1 L。
1.2 方法
1.2.1 A493产活性物质特性研究
(1)遗传稳定性
海洋菌A493连续传代10代,传代间隔2 d。同时挑取每一代平皿生长的单菌落接液体培养基,于28 ℃、180 r·min-1振荡培养48 h。以水稻黄单胞菌为指示菌采用牛津杯法检测抑菌圈大小。重复3次。
(2)温度处理
取A493发酵48 h的无菌上清液7份,分别在50 ℃、60 ℃、70 ℃、80 ℃、90 ℃、100 ℃、121 ℃条件下处理60 min,冷却至室温25 ℃,检测抑菌效果。重复3次。
(3)酸、碱处理
取无菌上清液7份,分别调pH值为2、4、6、8、9、10、12,室温下处理3 h,然后复调到原始pH值9。以原始上清液为对照,检测抑菌效果。重复3次。
(4)紫外线照射处理
取1 mL无菌上清液4份分别加至灭菌平皿中,形成一层很薄的水层。距紫外灯15 cm处各处理30 min、60 min、90 min、120 min。以原始上清液为对照,检测抑菌效果。重复3次。
(5)蛋白酶处理
取蛋白酶K、胰蛋白酶、胃蛋白酶(终浓度均为1 mg·mL-1)分别处理无菌上清液3 h。蛋白酶K在pH值8.0、40 ℃处理;胰蛋白酶在pH值8.0、37 ℃处理;胃蛋白酶在pH值4.5、37 ℃处理。以原始上清液和终浓度为1 mg·mL-1的蛋白酶K、胰蛋白酶、胃蛋白酶为对照,检测抑菌效果。重复3次。
(6)超滤处理
选用3 kDa、10 kDa、50 kDa、100 kDa再生纤维膜超滤管,取无菌上清液5 mL,先过100 kDa超滤管,取截留液以及滤过液分别测定活性;然后将100 kDa滤过液再经过50 kDa超滤管,取截留液以及滤过液分别测定活性;同法依次经过10 kDa、3 kDa超滤管过滤。以原始上清液为对照,测定抑菌活性并判断活性物质分子量范围。
(7)有机溶剂溶解处理
取石油醚、异戊醇、氯仿、乙酸乙酯、水饱和正丁醇分别与等体积无菌上清液混合萃取。分别取萃取相和萃余相浓缩处理。以原始上清液为对照,分别测定萃取液和萃余液的抑菌活性。
取4份20 mL的无菌上清液浓缩成固体粉末,分别用水、甲醇、乙醇、丙酮溶解,弃沉淀,浓缩干燥,用水定容至20 mL。以原始上清液为对照,检测抑菌效果。
(8)酸沉淀和硫酸铵沉淀处理
酸沉淀:将无菌上清液用盐酸调pH值至2.0,于4 ℃过夜处理。然后于8000 r·min-1、4 ℃离心30 min,上清液复调回原始pH值,沉淀用pH值9.0磷酸缓冲溶液溶解。以原始上清液为对照,测定抑菌活性。
硫酸铵沉淀:采用梯度盐析法,分别检测0~20%、20%~40%、40%~60%、60%~80%、80%~100%硫酸铵浓度梯度下沉淀以及上清液的活性。各浓度处理的无菌上清液4 ℃过夜处理。
1.2.2 A493发酵条件的初步优化
1.2.2.1 发酵条件单因子实验
挑选A493单菌落进行种子液摇瓶培养,分别取培养12 h的种子液按照1%(体积比,下同)的接种量接种至250 mL摇瓶中,装液量为70 mL,于28 ℃、180 r·min-1培养48 h,测定无菌上清液活性。
固定其它条件不变,分别考察接种菌龄(8 h、12 h、16 h、20 h、24 h)、接种量(1%、3%、5%、7%、9%、11%)、发酵时间(4 h、8 h、12 h、16 h、20 h、24 h、28 h、32 h、36 h、40 h、44 h、48 h、52 h、56 h、60 h)、发酵温度(24 ℃、26 ℃、28 ℃、30 ℃、32 ℃、34 ℃)、装液量(30 mL、50 mL、70 mL、90 mL、110 mL)、培养转速(120 r·min-1、140 r·min-1、160 r·min-1、180 r·min-1、200 r·min-1)对活性物质产量(以抑菌圈直径表示,抑菌圈直径大,表示活性物质产量高)的影响。每组实验重复3次。
1.2.2.2 抗菌活性与菌体生长的关系
根据确定的最佳条件发酵,分别取4 h、8 h、12 h、16 h、20 h、24 h、28 h、32 h、36 h、40 h、44 h、48 h、52 h、56 h、60 h发酵液各1 mL,检测菌体生长(OD660)及活性物质产生情况。OD660表示菌体量,以对水稻黄单胞菌抑菌圈大小表示活性物质活性,绘制菌体量与抗菌活性的关系曲线。
1.2.2.3 活性物质相对效价的测定
以标准链霉素为对照。分别配制浓度为250.0 μg·mL-1、125.0 μg·mL-1、62.5 μg·mL-1、31.25 μg·mL-1、15.63 μg·mL-1、7.81 μg·mL-1、3.90 μg·mL-1、1.95 μg·mL-1的链霉素标准溶液,检测不同浓度链霉素对水稻黄单胞菌的抑制效果。以各浓度抑菌圈直径为横坐标、链霉素浓度的对数值为纵坐标绘制标准曲线。根据等体积 A493发酵液对水稻黄单胞菌抑菌圈大小,确定A493产活性物质的相对效价。
2 结果与讨论
2.1 A493产活性物质特性
2.1.1 遗传稳定性(图1)

图1 A493抑菌效果的遗传稳定性
从图1可以看出,经过10代连续培养,A493对水稻黄单胞菌的抑制效果无明显变化,说明A493产活性物质遗传稳定性较好。
2.1.2 对温度的敏感性(表1)

表1 不同温度处理后A493发酵液的抑菌效果
从表1可以看出,A493产活性物质对温度不敏感,100 ℃处理60 min后抑菌活性基本没有变化,121 ℃处理60 min后才有所降低。表明该活性物质结构较稳定,在高温下不容易失活。
2.1.3 对酸、碱的敏感性(图2)

图2 不同pH值处理后A493发酵液的抑菌效果
从图2可以看出,发酵液的抑菌活性在pH值4~10之间都是稳定的,但是过酸或过碱对其有一定的影响。说明A493产活性物质对酸、碱稳定性较好。
2.1.4 对紫外线的敏感性(图3)

图3 紫外线照射不同时间的A493发酵液的抑菌效果
从图3可以看出,即使经过长达2 h的紫外线照射,发酵液的抑菌活性仍未受影响。表明A493产活性物质对紫外线耐受。
2.1.5 对蛋白酶的敏感性
将发酵液经蛋白酶K、胰蛋白酶、胃蛋白酶分别处理后进行抑菌实验发现,其抑菌活性未受到影响。说明A493产活性物质对这3种蛋白酶不敏感。
2.1.6 分子量大小
取经梯度超滤处理后的发酵液分别进行抗菌检测,结果显示A493产活性物质可以通过3 kDa的超滤管,属小分子物质。
2.1.7 有机溶剂溶解性
萃取实验结果表明,有机溶剂石油醚、异戊醇、氯仿、乙酸乙酯、水饱和正丁醇均不能将活性物质萃出,萃余相的活性物质也不会因为有机溶剂处理而失活,对这些有机溶剂耐受。分别用水、甲醇、乙醇、丙酮溶解经过干燥处理的无菌上清液粉末,充分溶解后进行抑菌实验,结果显示A493产活性物质只能被水和甲醇溶解,是极性很强的物质。
2.1.8 酸沉淀和硫酸铵沉淀处理结果
脂肽类物质是芽孢杆菌产生的主要抗菌物质,这类物质可以经酸沉淀或硫酸铵沉淀而析出。实验发现,酸沉淀后虽有部分物质析出,但上清液具有活性而沉淀物没有活性,表明活性物质不能被酸沉淀;而任何硫酸铵浓度下活性物质均不被析出。由此可以初步判断,A493产活性物质不属于脂肽类抗菌活性物质。
2.2 A493发酵条件优化结果
2.2.1 发酵条件单因子实验
2.2.1.1 接种菌龄对活性物质产量的影响(图4)

图4 接种菌龄对活性物质产量的影响
从图4可以看出,种子液菌龄对活性物质产量影响较大,种子液菌龄为8 h时活性物质产量最小,为12 h时活性物质产量最高,为16~24 h时活性物质产量又有所降低。所以选择12 h为最佳接种菌龄。
2.2.1.2 接种量对活性物质产量的影响(图5)
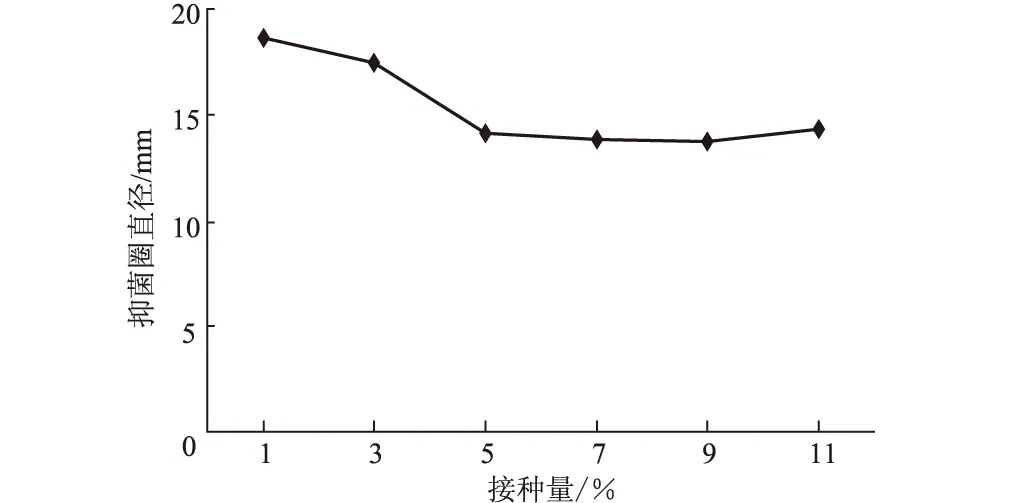
图5 接种量对活性物质产量的影响
从图5可以看出,接种量对活性物质产量影响较大。接种量为1%~3%时活性物质产量较高,其中接种量为1%时活性物质产量最高;随着接种量的增加,活性物质产量逐渐降低。所以选择1%为最佳接种量。
2.2.1.3 发酵时间对活性物质产量的影响(图6)
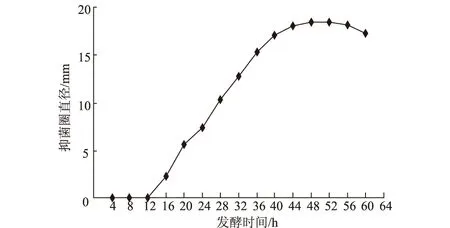
图6 发酵时间对活性物质产量的影响
从图6可以看出,在发酵前12 h没有活性物质产生,从16 h开始活性物质产量持续增加,至48 h时活性物质产量达最大值,之后活性物质产量下降。所以选择48 h为最佳发酵时间。
2.2.1.4 发酵温度对活性物质产量的影响(图7)

图7 发酵温度对活性物质产量的影响
从图7可以看出,发酵温度在24~34 ℃范围内,活性物质产量几乎没有变化。表明A493产活性物质在24~34 ℃范围内基本稳定,不受温度影响。这也说明了深海微生物可能具有更强的适应能力。结合本实验室需要,选择28 ℃为最佳发酵温度。
2.2.1.5 装液量对活性物质产量的影响(图8)

图8 装液量对活性物质产量的影响
从图8可以看出,装液量对活性物质产量有一定的影响。装液量在30~70 mL之间时活性物质产量较高;随着装液量的提高,其产量逐渐降低。这可能是由于溶氧量的下降造成的。所以选择70 mL为最佳装液量。
2.2.1.6 培养转速对活性物质产量的影响(图9)
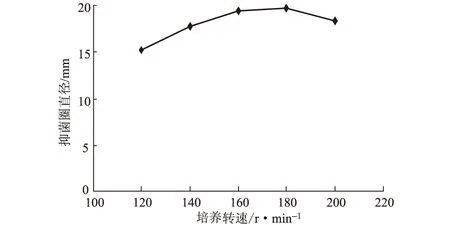
图9 培养转速对活性物质产量的影响
从图9可以看出,培养转速对活性物质产量影响较小。转速在160~180 r·min-1之间时活性物质产量较高,转速过低或过高时活性物质产量均略有降低。这可能是由于,转速过低时供氧量不足,转速过高又产生过多泡沫而影响菌体生长。所以选择180 r·min-1为最佳培养转速。
2.2.2 优化条件的验证
单因子实验得到A493最佳发酵条件为:接种菌龄12 h、接种量1%、发酵时间48 h、发酵温度28 ℃、培养转速180 r·min-1、250 mL锥形瓶中的装液量为70 mL。验证实验结果表明所确定优化发酵条件有效,抑菌圈直径由原来的16.6 mm增大到19.7 mm,单位体积发酵液抑菌效果提高了18.7%。
2.2.3 抗菌活性与菌体生长的关系(图10)

图10 A493生长与其抗菌物质活性的关系
从图10可以看出,发酵前12 h内没有活性物质产生,发酵48 h后活性物质的活性达到最大,然后开始下降;A493在发酵8 h后进入对数生长期,28 h后进入稳定生长期,48 h后进入衰亡期。这表明抑菌活性是在A493对数生长期开始出现,直到菌株稳定生长期末期达到最大值,进入衰亡期后开始降低。
2.2.4 活性物质相对效价的测定
根据链霉素产生的抑菌圈直径和浓度对数值绘制标准曲线,见图11。

图11 链霉素抑制水稻黄单胞菌标准曲线
在保证培养基浓度及厚度、指示菌浓度、A493发酵上清液和对照链霉素加样量相同的前提下,经过48 h培养后,精确测量A493发酵上清液所产生的抑菌圈与对照链霉素所产生的抑菌圈直径。根据等体积A493发酵上清液对水稻黄单胞菌抑菌圈的大小和链霉素标准曲线,确定A493发酵液中活性物质的相对效价相当于15.6 μg·mL-1的标准链霉素。
3 结论
以筛选得到的一株抗菌谱较窄并且稳定拮抗水稻黄单胞菌的海洋独岛枝芽孢杆菌(V.dokdonensis)A493为研究对象,对其产活性物质特性及发酵条件的优化进行了研究。
(1)菌株A493有较高的遗传稳定性,所产活性物质热稳定性强、在pH值4~10之间稳定、对紫外线耐受、对蛋白酶不敏感、分子量小于3 kDa、只能溶于水和甲醇。酸沉淀和硫酸铵沉淀实验结果,排除了活性物质是脂肽类物质的可能性,初步研究显示该活性物质可能是极性较强的水溶性小分子新化合物。
(2)菌株A493最佳发酵条件为:接种菌龄12 h、接种量1%、发酵时间48 h、发酵温度28 ℃、培养转速180 r·min-1、250 mL锥形瓶中的装液量为70 mL。优化后,其单位体积发酵液抑菌效果提高了18.7%,活性物质对水稻黄单胞菌的抑菌效价相当于15.6 μg·mL-1的标准链霉素。
参考文献:
[1] 李冰,徐涛,蔡敬民.海洋微生物活性物质的研究进展[J].安徽农业科学,2011,39(23):13931-13934,13978.
[2] EI-Tarabily K A,Soliman M H,Nassar A H,et al.Biological control of sclerotinia minor using a chitinolytic bacterium and actinomycetes[J].Plant Pathol,2000,49(5):573-583.
[3] Heyndrickx M,Lebbe L,Kersters K,et al.Proposal ofVirgibacillusproomiisp.nov.and emended description ofVirgibacilluspantothenticus[J].International Journal of Systematic Bacteriology,1999,49(3):1083-1090.
[4] Peng Q Z,Chen J,Zhang Y Q,et al.Virgibacilluszhanjiangensissp.nov.,a marine bacterium isolated from sea water[J].Anton Leeuw Int J G,2009,96(4):645-652.
[5] Yoon J H,Kang S J,Jung Y T,et al.Virgibacillusbyunsanensissp.nov.isolated from a marine solar saltern[J].Int J Syst Evol Microbiol,2010,60(2):291-295.
[6] Lee S Y,Kang C H,Oh T K,et al.Virgibacilluscampisalissp.nov.,isolated from a marine solar saltern in the west coast of Korea[J].Int J Syst Evol Microbiol,2011,62(2):347-351.

