胃肠肿瘤术后短期应用生长激素对患者营养状况及预后的影响
袁 野
江苏省苏州市上海交通大学苏州九龙医院普外科,江苏 苏州 215021
目前,关于短期生长激素应用对于胃肠肿瘤患者术后营养状况影响的研究相对较少,同时该药物应用于肿瘤患者是否会增加肿瘤复发和转移的风险还存在一定的争议[1-3]。因此,本实验采用随机临床对照研究的方法对61例胃肠肿瘤术后患者进行了短期应用生长激素的研究。探讨生长激素短期应用对于胃肠肿瘤患者手术后营养状况及血清IGF-1水平的影响,以及低剂量生长激素短期应用是否会增加根治术患者肿瘤复发或转移的危险。
1 资料与方法
1.1 一般资料
选择我院2007年5月~2009年12月住院接受手术治疗的61例胃肠肿瘤患者作为研究对象,采用随机数字表分为实验组(29例)和对照组(32例)。入组标准:年龄大于等于18周岁,行胃肠道外科手术患者。排除标准:年龄小于18周岁,严重全身感染性疾病,肿瘤晚期已发生转移,肝肾功能障碍,甲亢等代谢性疾病,重度营养不良,妊娠。实验组男18例,女 11例,平均年龄(56.5±7.5)岁;对照组男 19例,女 13例,平均年龄(57.3±8.4)岁。两组患者临床基线情况经统计学处理差异无有统计学意义(P>0.05)(表1)。本研究通过医院伦理委员会审核,所有参与研究患者经患者本人或监护人签署知情同意书自愿加入该研究。
表1 两组患者临床资料比较()
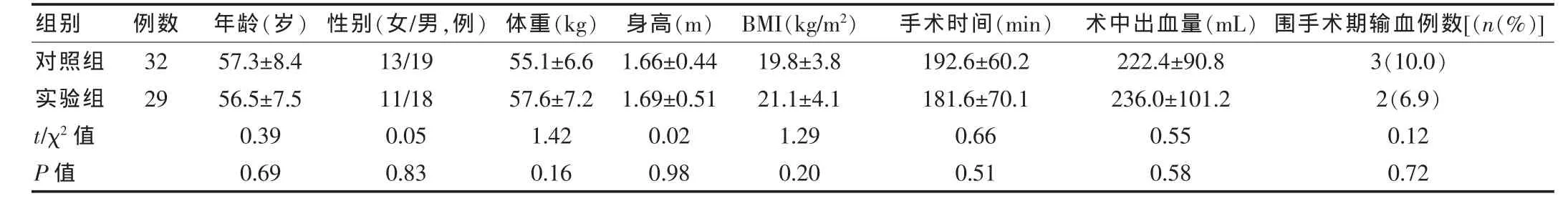
表1 两组患者临床资料比较()
表2 两组患者术后氮平衡比较()

表2 两组患者术后氮平衡比较()
1.2 方法
两组患者胃肠术后给与相同的对症及营养支持治疗。术后第1天给予生理盐水及葡萄糖溶液,于第2天起进行营养支持,术后第2~5天营养支持逐渐由完全肠外营养过度到完全肠内营养,并按正常需求量给予微量元素、水、电解质。治疗期间肠内营养患者饮水不受限制,根据患者情况进行输液并维持水,电解质平衡。实验组在上述基础上第3日起每日应用重组人生长激素0.15 U/kg,皮下注射,连续应用7 d,对照组给予相同剂量的安慰剂(葡萄糖氯化钠注射液)。
1.3 观察指标
根据凯氏定氮法氮平衡计算公式:氮平衡=氮摄入量-氮排除量,氮摄入量=肠内营养含氮量+场外营养含氮量,氮排出量=尿氮排出量+粪氮排出量+引流液含氮量,测定术后3~9 d两组患者的氮平衡情况。同时于术前1 d,术后第10天测定血清白蛋白、纤维连接蛋白及IGF-1水平,观察患者术后有无不良反应发生,随访2年,记录肿瘤转移复发时间。
1.4 统计学方法
应用SPSS 17.0统计软件包进行统计学处理,年龄、身高、体重等计量资料以均数±标准差()表示,两独立样本的计量资料采用t检验;重复测量的计量资料采用方差分析,两两比较采用LSD-t检验。性别比例、手术部位等计数资料采用率表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 氮平衡比较
术后第4~9天,实验组氮平衡明显高于对照组(P<0.01),实验组术后累积氮平衡为(12.05±11.32)g,对照组为(-7.78±12.24)g,两组比较差异有高度统计学意义(P<0.01)。见表2。
2.2 血清白蛋白、纤维连接蛋白和IGF-1比较
术后第10天实验组IGF-1和纤维连接蛋白明显高于对照组(P<0.05),而血清白蛋白差异无统计学意义(P=0.53>0.05)。 见表 3。
表3 两组患者手术后营养指标比较()
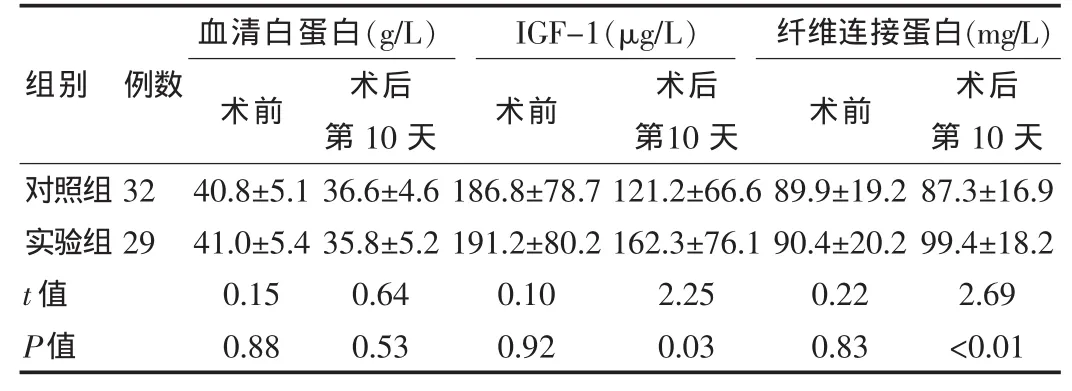
表3 两组患者手术后营养指标比较()
2.4 随访结果
术后两组患者随访24个月,对照组肿瘤复发或转移6例(25.0%)实验组7例(21.9%),随访期间,实验组与对照组转移复发风险无差别 (HR=0.75,95%CI:0.25~2.23,P=0.60 >0.05)。
3 讨论
人生长激素(human groth hormon,hGH)是由位于人脑垂体前叶的嗜酸粒细胞分泌的一种由191个氨基酸残基组成的单链多肽。该多肽可以与肝靶细胞膜受体相结合,并激活下游通路,调节肝脏合成分泌胰岛素样生长因子-1,进而发挥促进细胞生长、分化和增殖的作用。20世纪80年代,波耶尔首先通过基因重组技术合成了与人的生长激素多肽结构,即重组人生长激素(RhGH)。重组人生长激素的生理功能在很多方面与人自身分泌的生长激素作用相似,可以促进个体生长发育、体内营养物质新陈代谢,同时还具有促进细胞分化、增殖、调节机体免疫功能等[4]。
手术创伤可以导致患者体内蛋白的分解增加抑制机体免疫功能[5],术后患者机体处于高分解代谢状态,多种分解代谢激素的活化会增加代谢水平,如白介素2、类固醇激素等。同时机体蛋白质合成激素如生长激素,IGF-1分泌减少及患者对其反应降低加剧机体的分解代谢。胃肠外科术后患者生长激素合成分泌不足可以显著影响蛋白代谢,抑制蛋白的合成,加速总体蛋白与肌肉蛋白的分解,促进氨基酸的分解与氧化。因此,胃肠外科术后及早进行营养补充,可以及时纠正负氮平衡,改善机体营养状态和机体免疫功能[6]。但单纯补充营养的效果并不理想,研究显示,在补充营养的同时术后短期生长激素应用可以显著改善患者体内负氮平衡,增加蛋白质合成与利用,抑制蛋白质分解,增强营养支持治疗结果[7],加速患者的康复进程。
本研究结果显示,实验组术后累积氮平衡、IGF-1和纤维连接蛋白明显高于对照组(P<0.05),而血清白蛋白差异无统计学意义。术后随访24个月,对照组肿瘤复发或转移6例(25.0%),实验组7例(21.9%)。随访期间,实验组与对照组转移复发风险明无差别 (HR=0.75,95%CI:0.25~2.23,P=0.60>0.05)。因此,胃肠术后患者短期小剂量生长激素联合早期营养支持,可以促进胃肠外科术后患者氮平衡与蛋白的代谢,不增加肿瘤的复发和转移风险,与既往的研究结果基本一致[5]。生长激素应用可以促进胃肠术后患者保持正氮平衡,提示了生长激素对于外科术后患者有促进合成的作用,如生长激素与谷氨酸术后短期应用可以增加术后患者体内氮保留,围手术期给予生长激素可以有利术后患者瘦肉体组织保存。一般情况下,生长激素经过IGF-1发挥作用,IGF-1可以介导生长激素促进组织合成代写,促进机体生长发育及创伤后康复。因此生长激素与IGF-1具有保存瘦肉体组织及维持蛋白合成的生理功能。同时,血清蛋白指标检测证明生长激素具有增加合成蛋白的功效,虽然本研究病例组与对照组血清白蛋白无差异,分析原因可能是由于白蛋白的半衰期较长有关,平均为14~21 d。因此血清白蛋白可能无法反应急性期的营养状况变化。
胃肠道肿瘤术后的复发转移是较为常见的远期并发症,也是影响患者术后生存的关键。恶性肿瘤患者术后应用生长激素是否会增加肿瘤转移复发风险一直存在一定的争议[6]。有研究认为生长激素可以促进肿瘤的分裂与增值,增加术后肿瘤复发风险[6],Van等[7]认为生长激素在促生长发育组织愈合及合成代谢方面可能存在选择性,它可以支持宿主生长发育,而抑制了肿瘤的分裂增殖,从而抑制复发和转移;另一方面,生长激素可能通过免疫调节功能来发挥抗肿瘤作用。Tacke等[3]将3种剂量的生长激素应用于术后肿瘤患者,结果未发现生长激素会增加肿瘤远期复发的风险;另一项关于肝癌肝术后应用生长激素的研究也得到了相似的结果[8]。
综上所述,生长激素应用与胃肠外科手术后患者可以促进蛋白合成的代谢及氮平衡的维持,适量剂量的生长激素短期应用安全性好,且不增加肿瘤复发危险。
[1]Akaza H,Matsuki K,Matsushima H,et al.Stimulatory effects of growth hormone on rat bladder carcinogenesis[J].Cancer,1991,68(11):2418-2421.
[2]Maneatis T,Baptista J,Connelly K,et al.Growth hormone safety update from the National Cooperative Growth Study [J].J Pediatr Endocrinol Metab,2000,13(21):1035-1044.
[3]Tacke J,Bolder U,Herrmann A,et al.Long-term risk of gastrointestinal tumor recurrence after postoperative treatment with recombinant human growth hormone[J].J Parenter Enteral Nutr,2000,24(3):140-144.
[4]高云峰.生长抑素对单纯性肠梗阻的辅助治疗效果观察[J].中国医药导报,2011,8(18):182-183.
[5]胡丽燕,叶世伟.生长激素加早期肠内营养对重度脑损伤患者术后营养状况及并发症的影响[J].武警医学,2010,21(8):656-658.
[6]Cassorla F,Cianfarani S,Haverkamp F,et al.Growth hormone and treatment outcomes:expert review of current clinicalpractice[J].Pediatr Endocrinol Rev,2011,9(2):554-565.
[7]Van Buul-Offers SC,Kooijman R.The role of growth hormone and insulin-like growth factors in the immune system [J].Cell Mol Life Sci,1998,54(10):1083-1094.
[8]Cao J,Luo SM,Liang L,et al.Effects of parenteral nutrition without and with growth hormone on growth hormone-insulin-like growth factor-1 axis after hepateetomy in hepatocellular carcinoma with liver cirrhosis[J].J Parenter Enteral Nutr,2007,31(6):496-501.

