灵芝多糖联合5-氟尿嘧啶对LoVo细胞增殖及凋亡的影响
梁曾恩妮, 易有金, 郭雨桐, 王仁才, 熊兴耀*
(1.湖南农业大学园艺园林学院,湖南长沙410128;2.湖南农业大学食品科技学院,湖南长沙410128)
结肠癌是发生于结肠部位的常见消化道恶性肿瘤,占胃肠道肿瘤的第3位,近年来其发病率呈上升趋势。5-氟尿嘧啶对消化系统癌疗效较好,是治疗结肠癌的常见药物,属于剂量依赖型药物。因此疗效增加的同时药物副作用也随之增加,这已成为治疗中的难题,限制了化疗药物的临床应用,降低了疗效[1]。灵芝多糖是灵芝的主要活性成分,具有广泛的药理活性,其抗肿瘤作用备受关注[2-3]。研究证明中药与化疗药物联用不但可以减少药物的不良反应,还可使每药发挥最大疗效[4-5],使临床效果达到最佳。但灵芝多糖与抗癌化疗药物联合应用的研究很少[6],尚未见灵芝多糖与化疗药物联合作用于肿瘤细胞的报道。本实验采用MTT法、联合指数法、荧光染色和流式细胞术研究灵芝多糖联合5-氟尿嘧啶在体外对人结肠癌LoVo细胞生长、凋亡及细胞周期的影响。
1 材料与方法
1.1 材料 人结肠癌细胞株LoVo由武汉微生物研究所提供。灵芝多糖由国家中医药管理局亚健康干预技术实验室提供。灵芝用热水提取,脱蛋白、脱色素、葡聚糖凝胶Sephadex G-100和DEAE-纤维素层析柱分离纯化,冷冻干燥得灵芝多糖粉。实验前灵芝多糖和5-氟尿嘧啶用含10%血清的高糖DMEM培养液溶解,混匀,过滤除菌,-4℃保存。
胎牛血清 (FBS)、DMEM(高糖)培养基(美国Gibco公司);胰酶、碘化丙啶 (PI)(Beyotime公司);MTT(美国Sigma公司);5-氟尿嘧啶(上海旭东海普药业有限公司,批号:090807);二甲基亚砜 (DMSO)(北京Solarbio公司);6孔板和96孔板 (美国Conring公司)。
CO2培养箱2406-2(美国 Shellab公司);冷冻离心机CF16RXⅡ (日本日立公司);酶联检测仪mk3(美国 thermo公司);荧光倒置显微镜BX51(日本 Olympus公司);流式细胞仪 FC500(美国Beckman Coulter公司)。
2 方法
2.1 细胞培养及试剂配制 LoVo细胞株生长于含10%胎牛血清的高糖DMEM培养基中,贴壁生长,于37℃恒温、5%CO2,饱和湿度的培养箱中培养。取对数生长期的细胞经0.25%胰蛋白酶消化并吹打分散均匀后使用。
2.2 细胞增殖抑制率的测定 采用MTT法[7]进行。前期实验测定了灵芝多糖 IC50值为2.33 mg/mL,后续实验的灵芝多糖质量浓度梯度设计以此为基础,5-氟尿嘧啶的剂量设置参照文献 [8]。将对数生长期密度为3×104个/mL的LoVo细胞接种于96孔培养板内,每孔接种100 μL。培养24 h后,吸弃上清液,每孔加200 μL药液。实验共分5组,分别为灵芝多糖组 (终质量浓度为0.625、1.25、2.5、5 mg/mL)、5-氟尿嘧啶组 (终质量浓度为25、50、100 μg/mL)、联用组 (灵芝多糖终浓度为0.313、0.625、1.25和2.5 mg/L,5-氟尿嘧啶终质量浓度为6.25、12.5、25和50 μg/mL,两药合用比例为1∶1方案),另设对照组 (细胞、培养基和血清)和空白组 (培养基和血清),每组5个复孔。分别培养24 h、48 h和72 h后,每孔加MTT(5 mg/L)20 μL,继续培养4 h后,小心吸弃上清液,每孔加150 μL DMSO,轻轻震荡10 min,用酶标仪在492 nm处测定光密度 (A)值。按下式计算药物对肿瘤细胞生长的抑制率:肿瘤细胞生长抑制率 (inhibitory rate,IR)=(1-实验组A492值/对照组A492值) ×100%。
2.3 药物联合作用评价 参照文献 [9],采用Chou-Talalay联合指数法分析灵芝多糖和5-氟尿嘧啶之间相互作用效果。已知OD值求出药物作用效应 (Fraction affected,fa)即抑制率,根据中效方程式fa/fu=(D/Dm)m,两边取对数lg(fa/fu)=mlgD-mlgDm。其中:fa为药物作用效应;fu=1-fa,D为药物质量浓度;m为斜率;Dm为中效质量浓度,即达到50%效应时的药物浓度。采用IC50计算软件算出中效质量浓度Dm(即IC50),再计算出单用及两药合用时在各种效应时所需药物质量浓度fa/fu=(D/Dm)m,可计算出两药合用时在各种效应时的合用指数 (Combination index,CI),CI=D1/DX1+D2/DX2+ αD1D2/DX1DX2,其中 D1、D2为两药合用时产生X效应时两药各自所需质量浓度,DX1、DX2为两药单独使用时产生X效应时两药各自质量浓度。α为常数,当两种药物合相互排斥时为0,当两种药物相互非排斥时为1。灵芝多糖和5-氟尿嘧啶的相互作用为非排斥性,取α=1。CI<1,协同;CI=1,相加;CI>1,拮抗。
2.4 细胞凋亡和细胞周期的检测 参照文献[10],6孔板中接种处于对数生长期的细胞,每孔1×106个细胞,放置于培养箱过夜。加入不同质量浓度的灵芝多糖培养24和48 h,同时设阴性对照组。胰酶消化细胞,生理盐水洗涤3次后,弃上清,-4℃ 70%乙醇固定过夜。PBS洗涤3次,制成单细胞悬液,加入0.5 mL PI染色液 (50 mg/L PI,1 g/L柠檬酸钠,10 g/L Triton X-100,1 mg/L RNase A),4℃避光放置30 min,过400目筛网,流式细胞仪检测,Modfit LT软件分析结果。
2.5 统计学处理 应用SPSS18.0统计软件进行t检验。
3 结果
3.1 灵芝多糖和5-氟尿嘧啶对LoVo细胞的增殖作用
3.1.1 灵芝多糖、5-氟尿嘧啶单独用药抑制LoVo细胞增殖作用 由图1可知,与对照组相比,灵芝多糖和5-氟尿嘧啶均对LoVo细胞显示出了良好的杀伤效果 (P<0.01),并呈剂量和时间依赖性。以灵芝多糖质量浓度为5 mg/mL作用72 h抑制率最高,IC50为5.83 mg/mL。5-氟尿嘧啶质量浓度为100 μg/mL作用72 h抑制率最高,作用48 h、72 h的 IC50为 36.55 μg/mL、10.73 μg/mL。
3.1.2 灵芝多糖联用5-氟尿嘧啶抑制LoVo细胞增殖作用 结果见表1。
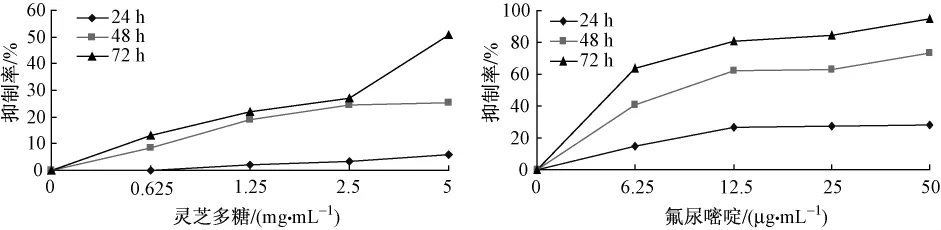
图1 灵芝多糖、5-氟尿嘧啶单用对LoVo细胞增殖抑制作用Fig.1 Inhibitory effect of Ganoderma lucidum polysaccharide and 5-fluorouracil alone on the proliferation of LoVo cells
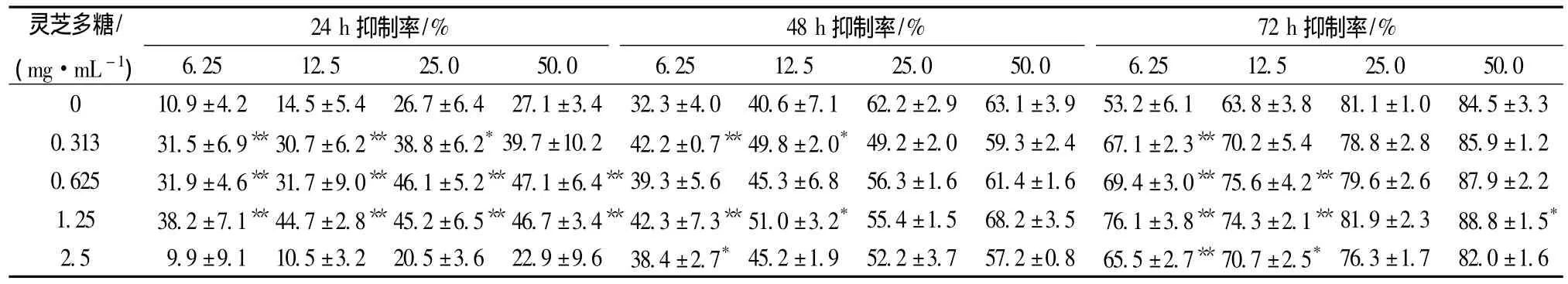
表1 灵芝多糖联合5-氟尿嘧啶对LoVo的增殖抑制率(n=4)Tab.1 Inhibitory effect of Ganoderma lucidum polysaccharide and 5-fluorouracil on the proliferation of LoVo cells(n=4)
结果可知,灵芝多糖联用5-氟尿嘧啶对肿瘤细胞LoVo增殖抑制效应随时间的延长而增强,但无剂量上依赖。两药联用采用联合指数法计算CI值,fa=0.86,即89%的LoVo细胞生长受抑制时,CI≈1,两药联合效应相加;当fa<0.86,即灵芝多糖质量浓度<14.70 mg/mL,5-氟尿嘧啶质量浓度<0.29 mg/mL时,CI<1,两药联合产生协同效应;当fa>0.86时,CI>1,两药合用效应拮抗。当抑制效应fa=0.50时,联合用药组 (5-氟尿嘧啶的质量浓度为0.86 μg/mL),相对于5-氟尿嘧啶单独应用 (5-氟尿嘧啶的质量浓度为0.01 mg/mL)并取得相同效应时,5-氟尿嘧啶的剂量减少了10.6倍 (见表2、图2)。
3.2 灵芝多糖联合5-氟尿嘧啶对LoVo凋亡率的影响 流式细胞仪分析表明,5-氟尿嘧啶单独用药组和联合用药组作用LoVo细胞24 h后,可见明显的亚G1峰,即凋亡峰,且随作用时间延长,凋亡率升高,但无剂量依赖性 (见图3)。联合用药24 h,1.25 mg/mL 灵芝多糖联合 12.5 μg/mL 5-氟尿嘧啶的凋亡率最高 (14.42%),高于5-氟尿嘧啶组 (11.37%);联合用药48 h,0.625 mg/mL灵芝多糖和6.25 μg/mL 5-氟尿嘧啶联合用药凋亡率最高 (28.92%),高于5-氟尿嘧啶组(23.29%)。
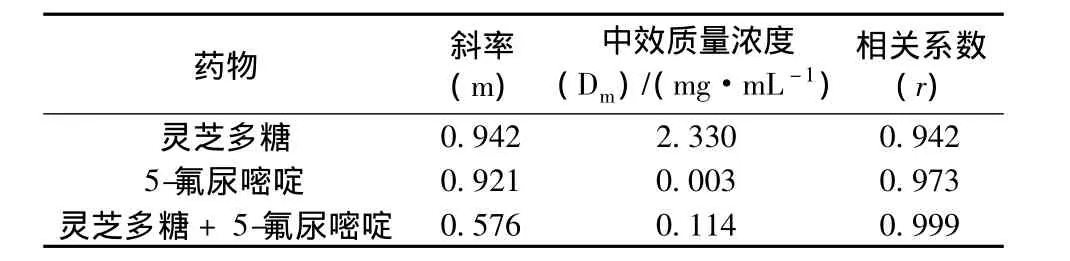
表2 两种抗癌药单用及合用时m、Dm、rTab.2 m、Dm、r of Ganoderma lucidum polysaccharide and 5-fluorouracil alone or combined
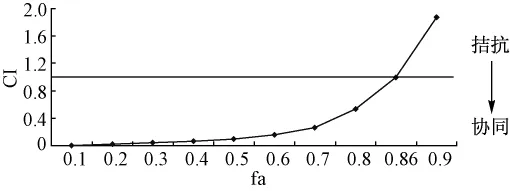
图2 灵芝多糖和5-氟尿嘧啶合用对LoVo细胞的效应与合用指数曲线Fig.2 Curve of combination index and fraction affected after treatment with Ganoderma lucidum polysaccharide and 5-fluorouracil on LoVo cells
3.3 灵芝多糖联合5-氟尿嘧啶对LoVo细胞周期的影响 与对照组相比,5-氟尿嘧啶干预LoVo细胞24、48 h后,G0/G1期和G2/M期细胞比例下降,S期细胞比例明显升高,并呈时间依赖性。两药联用对LoVo细胞也具有细胞周期特异性,但合用浓度的不同对细胞周期阻滞作用不同。联合处理组 (中、低剂量)和5-氟尿嘧啶组较对照组G0/G1期和G2/M期细胞比例下降,S期细胞比例明显升高;联合处理组 (高剂量)较对照组G2/M升高。这表明低质量浓度联合用药组可使LoVo细胞阻滞于S期,高质量浓度联合用药组使LoVo细胞阻滞于G2/M期和S期,并呈时间依赖性 (见表3)。
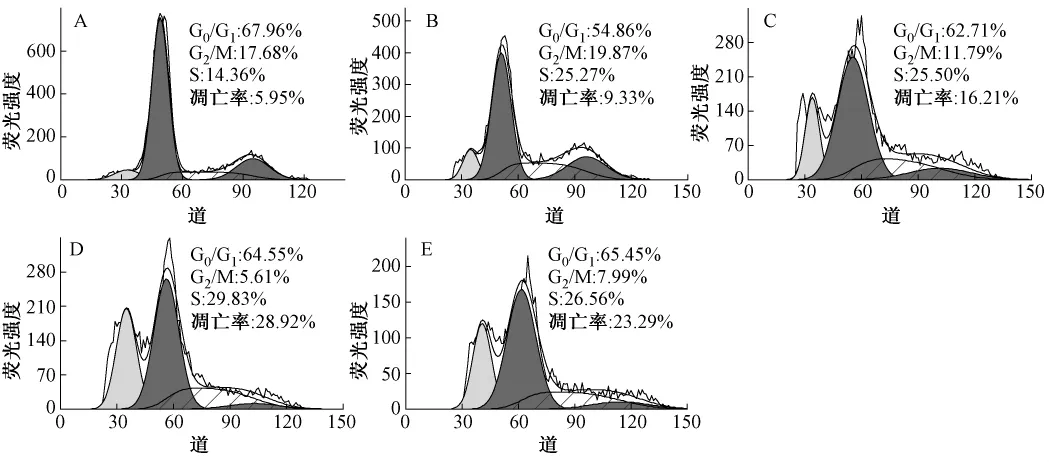
图3 灵芝多糖联合5-氟尿嘧啶对LoVo细胞48 h后周期和凋亡率的影响Fig.3 Apoptosis rate and cell cycle of LoVo cells after 48 h treatment with 5-fluorouracil and Ganoderma lucidum polysaccharide
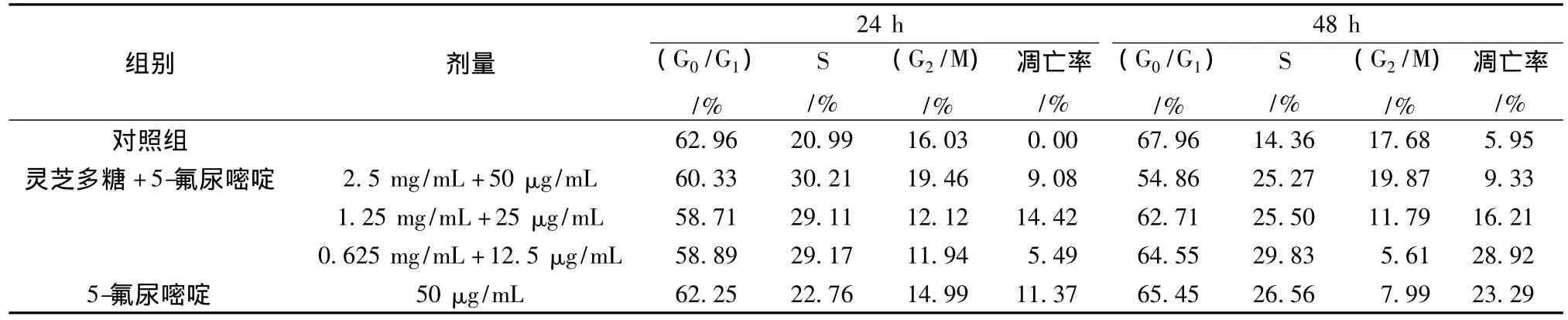
表3 灵芝多糖联合5-氟尿嘧啶对LoVo细胞周期和凋亡率的影响Tab.3 Apoptosis and cell cycle of LoVo cells after treatment with 5-fluorouracil and Ganoderma lucidum polysaccharide
4 讨论
在肿瘤化疗过程中,在杀伤肿瘤细胞的同时也会危害机体正常的组织和细胞,损伤人体器官,降低宿主免疫力,并伴随一系列毒副反应,从而影响化疗疗效。临床实践证实,肿瘤患者在接受化疗的同时使用适当的中药,有助于减轻化疗药物的毒副作用,能增强化疗药物的疗效。研究发现灵芝多糖是一种生物免疫调节剂,它通过激活免疫细胞,增强DNA多聚酶α的活性以及促进白细胞介素(IL)的分泌等途径来实现其增强机体的免疫功能[11],同时还能增强某些药物的细胞毒性[3]。但灵芝多糖联合其他化疗药物作用肿瘤细胞研究甚少,未见灵芝多糖联合其他化疗药物作用于结肠癌细胞的报道。
本研究通过体外实验显示,灵芝多糖和5-氟尿嘧啶单独应用对LoVo细胞的增殖均有抑制作用,并呈时间上和剂量上依赖性。灵芝多糖联合5-氟尿嘧啶用药的凋亡率呈时间依赖性,但无剂量依赖性,且不同时间点两药联合产生最大的抑制率的灵芝多糖质量浓度是不同的。灵芝多糖 (0.625、1.25、2.5、5 mg/mL)和 5-氟尿嘧啶 (25、50、100 μg/mL)两药联合应用可对LoVo细胞产生协同作用。流式细胞术显示灵芝多糖联合5-氟尿嘧啶作用LoVo细胞24 h后,细胞周期分布发生了明显变化。高质量浓度两药联用细胞周期滞留在S期和G2/M期,低质量浓度两药联用滞留在S期,并呈时间依赖性。5-氟尿嘧啶可使LoVo细胞周期滞留在S期,与文献报道一致[12]。
IC50的计算方法主要有 Logic[13],Bliss[14]及直线回归等多种计算方法,在数据处理过程中发现,不同的方法算出的IC50也有所不同。Logic等方法计算繁琐、费时,采用直线回归求IC50常常因为线性关系不好,结果偏差较大。且与其他方法相比,以Bliss算法为原理,利用现代高科技计算机技术,采用IC50计算软件计算IC50求IC50较简便、快捷,而且得到的值较为准确,故采用IC50计算软件和联合指数法相结合,处理灵芝多糖和5-氟尿嘧啶联合对LoVo细胞相互作用的实验数据。
PI(碘化丙啶)能够与双链DNA/RNA螺旋的大沟部位结合,它被活细胞排斥但能穿透正在死亡或已经死亡的细胞的细胞膜。由于PI不能进入完整的活细胞膜和早期凋亡细胞的细胞膜,因此PI标记流式细胞术检测是细胞晚期凋亡率。灵芝多糖和5-氟尿嘧啶联用能诱导人结肠癌LoVo细胞凋亡,并有时间依赖性,但无剂量依赖性。用药24、48 h后,联合用药组的凋亡率 (14.42%、28.92%)高于 5-氟尿嘧啶单独用药组(11.37%、23.29%)。
总之,灵芝多糖联合5-氟尿嘧啶对人结肠癌LoVo细胞的增殖抑制有较好地协同增效作用,两药联用对诱导LoVo细胞的凋亡也有一定程度的协同作用,阻滞细胞周期可能是两药联合诱导细胞凋亡的机理之一。若在临床上联合应用灵芝多糖和5-氟尿嘧啶治疗结肠癌,有可能既降低化疗药物的使用剂量减轻化疗药物对患者的毒副作用,同时又能提高疗效,具有较好的临床应用前景。由于两药互相作用机制不一样,用量,给药的顺序还有待进一步研究;体内实验结果与临床观察结果的相关率较高,还需进一步进行体内实验探索。
[1]邵红莲,辛 华,翟玉梅,等.大蒜素诱导人肝癌BEL-7402细胞凋亡[J].解剖学报,2001,32(3):290.
[2]Miyazaki T,Yadomae T,Terui T,et al.Studies on fungal polysaccharides.XXⅦ.Structural examination of a water-soluble[J].Chem Pharm Bull(Tokyo),1981,29(2):3611-3616.
[3]Kim K C,Kim J S,Son J K,et al.Enhanced induction of mitochondrial damage and apoptosis in human leukemia HL-60 cells by the Ganoderma lucidum and Duchesnea chrysantha extracts[J].Cancer Lett,2007,246(1-2):210-217.
[4]梁思雯,陈 真.多糖对抗肿瘤药物的增效减毒作用研究进展[J].安徽医药,2009,13(5):465-467.
[5]马 岩,张 锐,于小风,等.黄蘑多糖对荷瘤小鼠化疗的减毒增效作用[J].中草药,2006,37(8):1199-1202.
[6]刘艳芳,唐庆九,张劲松,等.两种灵芝多糖组分单糖组成分析及其对5-氟尿嘧啶抑制小鼠肿瘤的影响[J].食品科学,2011,32(11):288-291.
[7]Tanaka M,Matsuda A,Terao T,et al.Antitumor activity of a novel nucleoside,2'-C-cyano-2'-deoxy-1-β-D-arabinofuranosylcytosine(CNDAC)against murine and human tumors[J].Cancer Lett,1992,64(1):67-74.
[8]曾 晖,胡梅洁,乔敏敏,等.苦参碱联5-氟尿嘧啶抑制胃癌细胞株增殖作用的研究[J].中华消化杂志,2005,25(1):46-47.
[9]Chou T C.Drug combination studies and their synergy quantification using the chou-talalay method[J].Cancer Res,2010,70(2):440.
[10]黄文静,李卫平,孙文娟.氨氯地平对人乳腺癌细胞MCF-7细胞的抑制作用及机制研究[J]中国药理学通报,2009,25(12):1635-1639.
[11]Cao L Z,Lin Z B.Regulatory effect of Ganoderma lucidum polysaccharides on cytotoxic T-lymphocytes induced by dentritic cells in vitro[J].Acta Pharmacol Sin,2003,24(4):312-326.
[12]冯怡锟,付春景,黄幼田,等.丹皮酚联合5-氟尿嘧啶对食管癌EC9706细胞增殖及凋亡的影响[J].世界华人消化杂志,2010,18(7):646-651.
[13]黄 勇,秦叔逵,隋东虎,等.不同铂类为主联合化疗抗人肺癌细胞株的药效学研究[J].临床肿瘤学杂志,2011,16(3):201-205.
[14]冯婷婷,普建新,胡 政,等.二萜化合物Rabdocoetsin B抑制蛋白酶体功能并诱导t(8;21)白血病细胞凋亡[J].生物工程学报,2009,25(8):1218-1222.

