秦皮乙素诱导人肝癌细胞SMMC-7721凋亡的机制研究
王 晶, 伟忠民
(辽宁医学院附属第一医院,辽宁锦州121000)
秦皮乙素是从植物秦皮中提取、分离出来的一种内酯类化合物[1],是秦皮的主要有效成分之一,具有抗菌、消炎、镇痛等药理作用[2]。近年研究显示,秦皮乙素还具有抗肿瘤作用,有报道显示秦皮乙素对胸部肿瘤及人类白血病细胞均具有明显抑制作用[3-4]。本课题的前期研究表明,秦皮乙素可抑制人肝癌细胞SMMC-7721的生长。但有关秦皮乙素对人肝癌细胞作用机制的研究却罕见报道。为此本实验探讨了秦皮乙素对人肝癌细胞的促凋亡作用及机制,为临床更好地开发利用秦皮乙素提供理论依据与实验基础。
1 实验材料
1.1 细胞株 人肝癌细胞SMMC-7721购自辽宁医学院科学实验中心。
1.2 药物 秦皮乙素 (购自中国药品生物制品检定所,批号:110741-200506);5-氟脲嘧啶 (5-Fu)(天津金耀氨基酸药业,10 mL含0.25 g。批号:20101205);兔抗人 Bax抗体 (SANTA CRUZ公司,型号:SC-526);兔抗人Bcl-2抗体 (SANTA CRUZ公司,型号:SC-429);兔抗人Caspase-9抗体 (博奥森公司,型号:BS-0049R);兔抗人Caspase-3抗体 (博奥森公司,型号:BS-0081R)。
1.3 试剂 Caspase-3,Caspase-8,Caspase-9活性检测试剂盒 (碧云天生物技术研究所);线粒体膜电位检测试剂盒 (JC-1)(碧云天生物技术研究所);胰蛋白酶 (Hyclone公司);小牛血清 (杭州四季清生物制品公司);DMEM培养基干粉 (GIBCO公司)。其它试剂为国产分析纯。
1.4 仪器 荧光显微镜 (LEICACTR4000,德国);XD-101型倒置显微镜 (OLYMPUS TOKYO JAPAN);流式细胞仪 (BD FACSCaLibur);凝胶成像仪 (美国BIORAD);超净工作台 (江苏吴县市净化技术研究所);二氧化碳培养箱 (Sheldon Manufacturing IncUSA);酶标仪 (9602A北京普朗),IBO X600活体成像系统 (USA)。
2 实验方法
2.1 细胞培养 人肝癌细胞SMMC-7721在含10%胎牛血清的DMEM高糖培养液中,37℃,5%CO2传代培养,每2~3天换液1次,取对数生长期细胞进行实验[5]。
2.2 JC-1染色检测SMMC-7721细胞线粒体膜电位对数生长期细胞经秦皮乙素低剂量组 (1.12 mmol/L),中剂量组 (2.24 mmol/L),高剂量组(4.48mmol/L)培 养 24h,以 5-Fu(0.77 mmol/L)为阳性对照组,以PBS为阴性对照组。
SMMC-7721细胞密度约为1×106·mL-1,收集细胞,用PBS洗细胞1次,加入0.5 mL DMEM培养液和0.5 mL JC-1染色工作液,颠倒数次混匀,细胞培养箱中37℃孵育20 min。孵育结束后,600 r/min离心4 min,沉淀细胞,去上清。用JC-1染色工作液 (1×)洗涤两次,再用0.5 mL JC-1染色工作液 (1×)重悬后,流式细胞仪检测。实验重复3次。用绿色荧光细胞百分率表示线粒体膜电位的降低[6]。
2.3 分光光度法检测SMMC-7721细胞Caspase-3、Caspase-8、Caspase-9的活性 细胞分组同2.2项。细胞培养24 h后,用0.25%胰酶消化,收集细胞。PBS洗1次,吸尽上清。加入50 μL裂解液冰浴裂解30 min,12000 r/min,4℃离心10 min,小心吸上清至冰浴预冷的离心管中。然后在96孔板中每孔加入检测缓冲液70 μL,待测样品20 μL,底物Ac-IETD-ρNA 10 μL,混匀,37 ℃ 孵育 120 min。酶标仪在405 nm处测定吸光值。通过制作ρNA标准曲线,计算Caspase活化程度。每一试验重复3次以上。
2.4 蛋白印迹法 (Western blot)法检测SMMC-7721细胞中Bax、Bcl-2、Caspase-9蛋白的表达收集5-Fu阳性对照组和PBS阴性对照组及秦皮乙素各浓度组 [秦皮乙素低剂量组 (1.12 mmol/L),中剂量组 (2.24 mmol/L),高剂量组 (4.48 mmol/L和8.96 mmol/L)],处理24 h的细胞,用冷PBS洗2次,加入裂解液于4℃裂解30 min,4℃12500 r/min离心5 min,收集上清并测定蛋白浓度。用10%SDS-PAGE分离蛋白,电泳后将蛋白转至硝酸纤维素膜上。加入1∶1000稀释一抗,4℃过夜,洗膜。再加入1∶1000稀释的二抗孵育1 h,然后洗膜3次。内参照采用β-actin,显色,照相。
2.5 免疫荧光法检测 Bax、Bcl-2、Caspase-9、Caspase-3蛋白的表达 盖玻片使用实验室常规防脱片处理方法处理,六孔板做细胞爬片。取对数生长期细胞经秦皮乙素低剂量组 (1.12 mmol/L),中剂量组 (2.24 mmol/L),高剂量组 (4.48 mmol/L)培养,以5-Fu(0.77 mmol/L)为阳性对照组,以PBS为阴性对照组。培养24 h后,10%福尔马林固定30 min,PBS洗3次,30%H2O2和甲醇混合,室温浸泡15 min,蒸馏水洗3次,滴加3%BSA封闭液25 min,加入1∶500稀释的一抗,4℃过夜。PBS洗3次,加入1∶200稀释的二抗,37℃避光孵育20 min,PBS洗3次。封片,荧光显微镜下观察。
2.6 统计学处理 用SPSS17.0统计软件进行分析,计量资料以均值±标准差表示。P<0.05为差异具有统计学意义。
3 结果
3.1 JC-1染色检测人肝癌细胞SMMC-7721线粒体膜电位 JC-1是一种荧光探针,当线粒体膜电位较高时,JC-1聚集在线粒体的基质中,形成聚合物,产生红色荧光;当线粒体膜电位较低时,JC-1为单体,产生绿色荧光。故可通过荧光颜色的转变来检测线粒体膜电位的变化。结果见表1,图1。结果表明随着秦皮乙素浓度的增加,细胞线粒体膜电位下降,且呈剂量依赖性。与对照组比较差异显著 (P<0.05)。
表1 秦皮乙素对人肝癌细胞SMMC-7721线粒体膜电位降低的影响 (n=5,±s)Tab.1 Aesculetin effects on reducing mitochondrial membrane potential of human hepatoma SMMC-7721(n=5,±s)
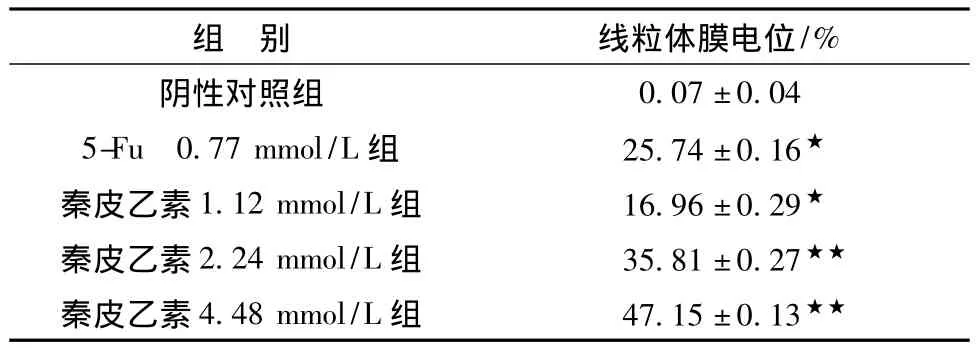
表1 秦皮乙素对人肝癌细胞SMMC-7721线粒体膜电位降低的影响 (n=5,±s)Tab.1 Aesculetin effects on reducing mitochondrial membrane potential of human hepatoma SMMC-7721(n=5,±s)
注:与对照组相比,★P<0.05,★★P<0.01。
组 别 线粒体膜电位/%0.07±0.045-Fu 0.77 mmol/L组 25.74±0.16★秦皮乙素1.12 mmol/L组 16.96±0.29★秦皮乙素2.24 mmol/L组 35.81±0.27★★秦皮乙素4.48 mmol/L组 47.15±0.13阴性对照组★★
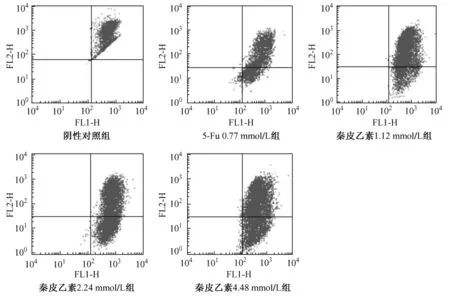
图1 秦皮乙素对人肝癌细胞SMMC-7721线粒体膜电位的影响 (n=5)Fig.1 Effect of aesculetin on mitochondrial membrane potential in human hepatoma SMMC-7721(n=5)
3.2 秦皮乙素对人肝癌细胞SMMC-7721 Caspase-3、Caspase-8、Caspase-9活性的影响 秦皮乙素(1.12、2.24、4.48 mmol/L)作用人肝癌细胞SMMC-7721细胞24 h后,Caspase-3、Caspase-9活性升高,并呈剂量依赖性。与对照组比较差异有统计学意义,P<0.05。Caspase-8活性基本无变化。结果见表2。
表2 秦皮乙素对人肝癌细胞SMMC-7721Caspase活性的影响 (n=5,±s)Tab.2 Effects of aesculetin on Caspase activity in human hepatoma SMMC-7721(n=5,±s)
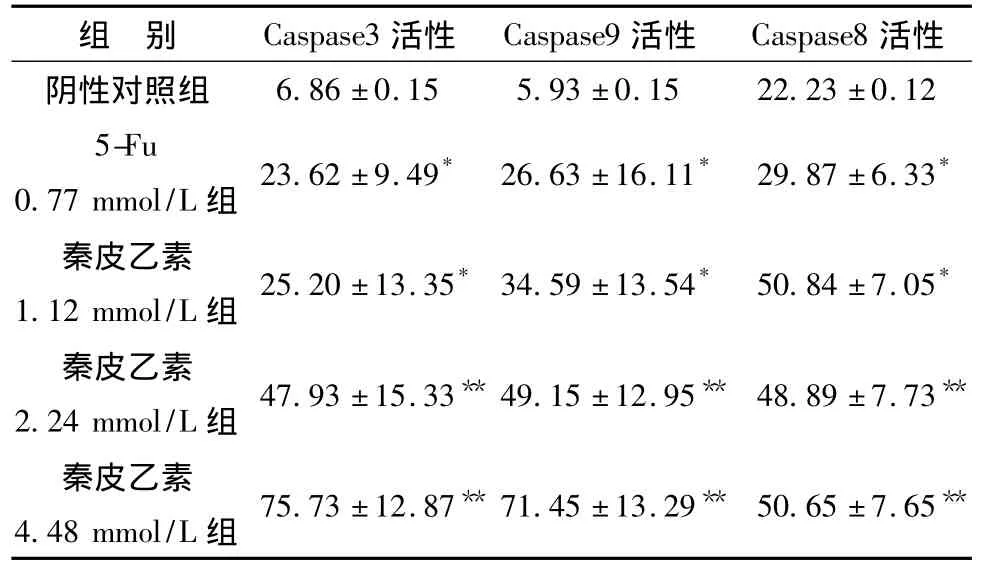
表2 秦皮乙素对人肝癌细胞SMMC-7721Caspase活性的影响 (n=5,±s)Tab.2 Effects of aesculetin on Caspase activity in human hepatoma SMMC-7721(n=5,±s)
注:与对照比较,*P <0.05,**P <0.01。
6.86 ±0.15 5.93 ±0.15 22.23 ±0.125-Fu 0.77 mmol/L 组 23.62 ±9.49* 26.63 ±16.11* 29.87 ±6.33*活性阴性对照组组 别 Caspase3活性 Caspase9活性 Caspase8秦皮乙素1.12 mmol/L 组 25.20 ±13.35* 34.59 ±13.54* 50.84 ±7.05*秦皮乙素2.24 mmol/L 组 47.93 ±15.33** 49.15 ±12.95** 48.89 ±7.73**秦皮乙素4.48 mmol/L 组 75.73 ±12.87** 71.45 ±13.29** 50.65 ±7.65**
3.3 Western blot法检测SMMC-7721细胞中Bax、Bcl-2、Caspase9蛋白的表达 秦皮乙素 (1.12、2.24、4.48、8.96 mmol/L)作用人肝癌SMMC-7721细胞24 h后,Bcl-2蛋白表达降低,Bax蛋白表达增加,Caspase-9蛋白表达也随着秦皮乙素浓度的增加而增强。见图2。
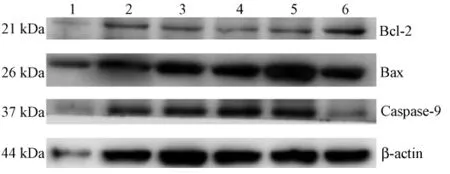
图2 秦皮乙素对人肝癌细胞 SMMC-7721 Bax、Bcl-2、Caspase-9蛋白表达的影响Fig.2 Effects of aesculetin on expressions of protein Bax,Bcl-2 and Caspase-9 in human hepatoma SMMC-7721
3.4 免疫荧光法检测 Bax、Bcl-2、Caspase-9、Caspase-3蛋白的表达 秦皮乙素 (1.12、2.24、4.48 mmol/L)作用人肝癌SMMC-7721细胞24 h后,Bax蛋白的表达增加,Bcl-2蛋白的表达降低,因此Bax/Bcl-2比例显著升高,进而活化Caspase-9、Caspase-3,使 Caspase-9、Caspase-3活性增加。见表3。
表3 秦皮乙素对人肝癌细胞SMMC-7721凋亡调控蛋白Bax、Bcl-2、Caspase-3、Caspase-9表达的影响 (n=5,±s)Tab.3 Effects of aesculetin on expressions of apoptosis protein Bax,Bcl-2,Caspase-3 and Caspase-9 in human hepatoma SMMC-7721(n=5,±s)
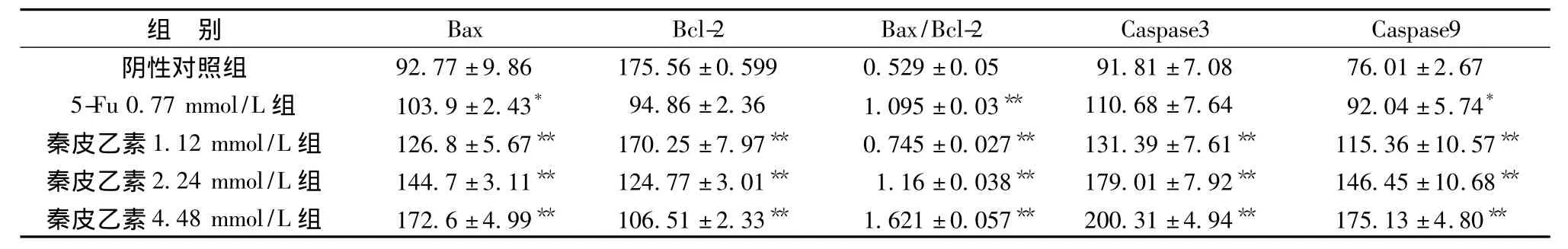
表3 秦皮乙素对人肝癌细胞SMMC-7721凋亡调控蛋白Bax、Bcl-2、Caspase-3、Caspase-9表达的影响 (n=5,±s)Tab.3 Effects of aesculetin on expressions of apoptosis protein Bax,Bcl-2,Caspase-3 and Caspase-9 in human hepatoma SMMC-7721(n=5,±s)
注:与对照组相比,*P <0.05,**P <0.01。
.08 76.01 ±2.675-Fu 0.77 mmol/L组 103.9±2.43* 94.86±2.36 1.095±0.03** 110.68±7.64 92.04±5.74*秦皮乙素1.12 mmol/L组 126.8±5.67** 170.25±7.97** 0.745±0.027** 131.39±7.61** 115.36±10.57**秦皮乙素2.24 mmol/L组 144.7±3.11** 124.77±3.01** 1.16±0.038** 179.01±7.92** 146.45±10.68**秦皮乙素4.48 mmol/L组 172.6±4.99** 106.51±2.33** 1.621±0.057** 200.31±4.94** 175.13±4.80阴性对照组 92.77±9.86 175.56±0.599 0.529±0.05 91.81±7**Bax Bcl-2 Bax/Bcl-2 Caspase3 Caspase9组 别
4 讨论
原发性肝癌是常见的恶性肿瘤之一,据世界卫生组织统计,最近10年全球肝癌发病率及死亡率增长了约22%。细胞凋亡与肿瘤的关系备受重视。正常细胞通过增生和凋亡来维持自身稳定,若两者失衡,则可导致肿瘤发生。
Chu、Wang等[3-4]初步探讨了秦皮乙素对人类白血病细胞和胸部肿瘤的抗肿瘤机理。主要机理为促进细胞色素C从线粒体中释放,活化Caspase-9诱导凋亡,并且具有浓度和时间的依赖性。此外秦皮乙素是 Caspase-3的底物,它可通过激活Caspase-3,促使细胞凋亡。秦皮乙素作用9 h后,可将Bcl-2蛋白的表达减少至58%,秦皮乙素作用24 h后可剪切腺苷二磷酸核糖聚合酶 (ADP-ribose)。在前期的研究中,通过MTT法及流式细胞仪检测细胞周期和细胞凋亡,已经初步证明秦皮乙素可抑制肝癌细胞的生长并诱导其凋亡[7]。
细胞凋亡是一种程序性细胞死亡过程。目前已知两种信号途径可以诱导细胞凋亡发生,即由死亡受体介导的外源性途径和由线粒体介导的内源性途径。两种途径通过分别特异性活化Caspase-8和Caspase-9,最后都作用于Caspase-3,诱导细胞凋亡。在内源性途径中,线粒体膜电位降低是细胞凋亡过程中的首要事件。在线粒体内、外膜交界处存在膜渗透性转换通道,该通道的开放会引起线粒体膜电位的下降,呼吸链断裂,诱导细胞凋亡[8]。本试验采用荧光探针JC-1检测线粒体膜电位的变化,结果显示,秦皮乙素作用24 h后,呈浓度依赖性地使人肝癌细胞SMMC-7721线粒体膜电位下降。表明线粒体参与了秦皮乙素诱导人肝癌细胞SMMC-7721凋亡发生。
Bcl-2家族蛋白是细胞通过内源性途径促进凋亡的重要调节因子,决定细胞能否通过改变线粒体膜电位激活Caspase家族,最终发生凋亡。为此本试验通过蛋白印迹法和免疫荧光法研究秦皮乙素对Bax,Bcl-2蛋白表达的影响。结果表明,秦皮乙素在抑制Bcl-2蛋白表达的同时使Bax蛋白的表达增加。进一步的研究发现,秦皮乙素可通过活化Caspase-3,Caspase-9而激活Caspase级联反应。
可见,秦皮乙素能够降低人肝癌细胞SMMC-7721线粒体膜电位,同时抑制Bcl-2蛋白表达,升高Bax/Bcl-2比例。活化Caspase-3,Caspase-9。通过内源性途径诱导人肝癌细胞SMMC-7721凋亡。
本实验对于秦皮乙素抗肿瘤机制的研究还不够深入,只是探讨了其对肿瘤细胞凋亡方面的影响,秦皮乙素能否增强机体免疫;对肿瘤相关的癌基因与抑癌基因的表达是否有影响;对肿瘤细胞的黏附、生长、转移是否有抑制作用等,都需要更深入的探讨。
[1]汪国松,杨亚滨,李璠等.秦皮的研究进展[J].国外医药:植物药分册,2007,22(3):108-111.
[2]方莲花,吕 扬,杜冠华.秦皮的药理作用研究进展[J].中国中药杂志,2008,33(23):2732-2736.
[3]Chu C Y,Tsai Y Y,Wang C J,et al.Induction of apoptosis by esculetin in human leukemia cells[J].Eur J Pharmacol,2001:416(1-2):25-32.
[4]Wang C J,Hsieh Y J,Chu C Y,et al.Inhibition of cell cycle progression in human leukemia HL-60 cells by esculetin[J].Cancer Lett,2002,183(2):163-168.
[5]司徒镇强,吴军正.细胞培养[M].西安:世界图书出版西安公司,2004:195-367.
[6]曲 佳,郭坤元,吴秉毅等.冬凌草甲素诱导人多发性骨髓瘤ARH-77凋亡及其可能机制[J].中国肿瘤生物治疗杂志,2010,17(2):134-138.
[7]王 晶,王洪新,李红玉.秦皮乙素的制备及对人肝癌细胞SMMC-7721体外增殖的影响[J].中国现代应用药学,2009,26(6):439-442.
[8]宋少华,郭闻渊,傅志仁,等.丹参多酚酸盐通过线粒体途径诱导人肝癌SMMC-7721细胞的凋亡[J].中国肿瘤生物治疗杂志,2010,17(1):62-66.
[9]林 箐,彭华毅.黄葵素诱导小鼠黑色素瘤B-16细胞凋亡的研究[J].中国药理学通报,2010,26(12):1630-1634.
[10]Noguchi M,Earashi M,Minami M,et al.Effects of piroxicam and esculetin on the MDA-MB-231 human breast cancer cell line[J].Prosaglandins Lenkot Essent Fatty Acids,1995,53(5):325-329.
[11]Harada K,Bando T,Yoshida H,et al.Characteristics of antitumour activity of cepharanthin against a human adenosquamous cellcarcinoma cell line[J].Oral Oncol,2001,37(8):643-651.
[12]江国松,杨亚萍.秦皮研究进展[J].国外医药:植物药分册,2007,22(3):108-111.

