吸入一氧化氮治疗新生儿低氧性呼吸衰竭19例临床观察
高红霞,刘东海,易 彬
(甘肃省妇幼保健院新生儿科,兰州 730050)
低氧性呼吸衰竭(hypoxic respiratory failure,HRF)是目前新生儿呼吸系统疾病治疗中最为棘手的一个问题,是导致新生儿,特别是早产儿机械通气的主要原因[1]。同时,也是导致新生儿死亡的重要原因。传统治疗方法下HRF的死亡率仍相当高。体外膜肺(extracorporeal membrane oxygenation,ECMO)为最终的治疗选择,但技术复杂,价格昂贵,且有严重的并发症,难以在临床推广应用。吸入一氧化氮(inhaled nitric oxide,iNO)技术易于掌握,监测手段容易获得,且无严重并发症,它在治疗新生儿HRF方面近年来一直是临床研究的热点。本研究对19例HRF患儿采取了机械通气联合iNO治疗的方法,取得了很好的疗效,现报道如下。
1 资料与方法
1.1 研究对象 19例病例均来源于甘肃省妇幼保健院新生儿重症监护中心,其中男13例,女6例;胎龄(37.42±2.69)周,胎龄≤34周4例,胎龄≥34周15 例;体质量(2885.26 ±695.89)g。原发疾病:肺透明膜病5例,胎粪吸入综合征4例,湿肺3例,肺炎1例,肺出血1例,气胸1例,原发性肺动脉高压3例,先天性心脏病1例。所有患儿均经床旁心脏超声检查排除复杂先天性心脏疾病,其中13例患儿存在肺动脉压力增高,6例正常。开始应用NO时间(37.68 ±54.96)h,持续时间(64.79 ±29.96)h,NO 累积暴露量(697.00 ±398.02)ppm/h。所有疾病诊断均依据金汉珍等主编的《实用新生儿学》第4版及2007年中国新生儿呼吸危重病协作网iNO研究协作组的诊断标准。
1.2 治疗方法 所有患儿入院后均给予纠正酸中毒、吸高浓度氧、过度通气、常频/高频机械通气、使用PS等常规传统治疗方法,出现以下情况时改变治疗方案。常频通气疗效不佳或无效,FiO2≥60%,PIP≥24 cm H2O时联合iNO;联合iNO效果仍不佳、无效或并发气胸时,改用HFOV联合iNO。HFOV初设参数MAP 13~14 cm H2O,呼吸频率10~12 Hz,振幅30%。iNO方法:在呼吸机治疗同时,将医用NO气体接入供气回路,并经空气/氧气混合气体气流稀释,在生理需要水平达到特殊呼吸治疗作用,接受治疗的初始浓度为15 ppm,除非患儿病情发生急性恶化,在试验开始的最初1 h内不改变机械通气装置和模式,以便于观察治疗反应。根据患儿对NO治疗的反应逐步调整。iNO后1 h PaO2增加>20 mmHg被定义为完全有效反应;若在10~20 mm-Hg之间,定义为部分有效反应;若<10 mmHg,定义为无效。若为完全有效反应,且SpO2>85%,PaO2>50 mmHg,可尝试将NO浓度减量至10 ppm;如果能耐受,以后可每6~12 h减小2 ppm,至96 h后撤离NO吸入。如减量过程中出现病情反复或恶化(PaO2下降>20 mmHg),重复先前浓度治疗。若为部分有效反应或无反应者,提高NO浓度至20 ppm吸入1 h,再观察治疗反应;若为完全有效反应,按前述方法减量;若仍为部分有效反应或无效,将NO浓度调回至10 ppm,持续吸入3 d后,逐渐减量。在MAP下降>基础值(NO治疗前)的30%;PaO2下降>基础值的25%,或氧饱和度下降>10%;尽管降低了iNO浓度,NO2浓度仍>2~5 ppm的情况下需中止NO吸入。
1.3 观察指标 记录治疗 0 h、1 h、6 h、12 h、24 h、48 h、72 h 的血气分析的 pH、PaO2、PaCO2值、机械通气模式、PIP、PEEP、MAP、FiO2、心率、呼吸、血压和经皮血氧饱和度,并MAP×FiO2×100/PaO2计算氧合指数(oxygenation index,OI)、动脉血氧分压/吸入氧浓度比值(PaO2/FiO2);治疗前后检查血常规、床旁头颅及心脏超声。
1.4 统计学方法 采用SPSS 19.0统计软件分析。数值以表示,各指标前后的比较采用配对t检验。P<0.05表示差异有统计学意义。
2 结果
19例患儿心率、血压治疗前后比较无统计学意义(P >0.05),治疗后血小板数量下降(P <0.05)。给予iNO治疗后,全部患儿氧合均明显改善,各项指标治疗前后比较均有显著统计学意义(P<0.001)。PaO2/FiO2治疗1 h已较治疗前明显上升,并持续至72 h;FiO2、OI治疗后1 h已有显著改善,并持续至72 h。MAP也有改善,但无其他指标改善显著,直到治疗12 h才有明显统计学意义。除4例48 h家属放弃治疗死亡外,其余15例患儿均痊愈出院。2例并发气胸,5例并发颅内出血,无1例并发支气管肺发育不良及动脉导管未闭。结果见表1及表2。
表1 患儿心率、血压、血小板的变化()
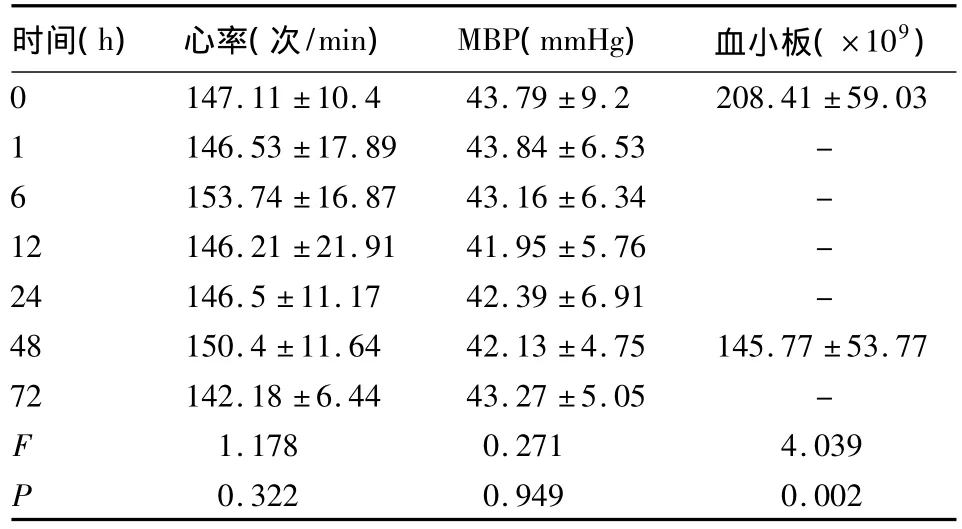
表1 患儿心率、血压、血小板的变化()
表 2 患儿 FiO2,PaO2/FiO2,OI,MAP,PAP 的变化()
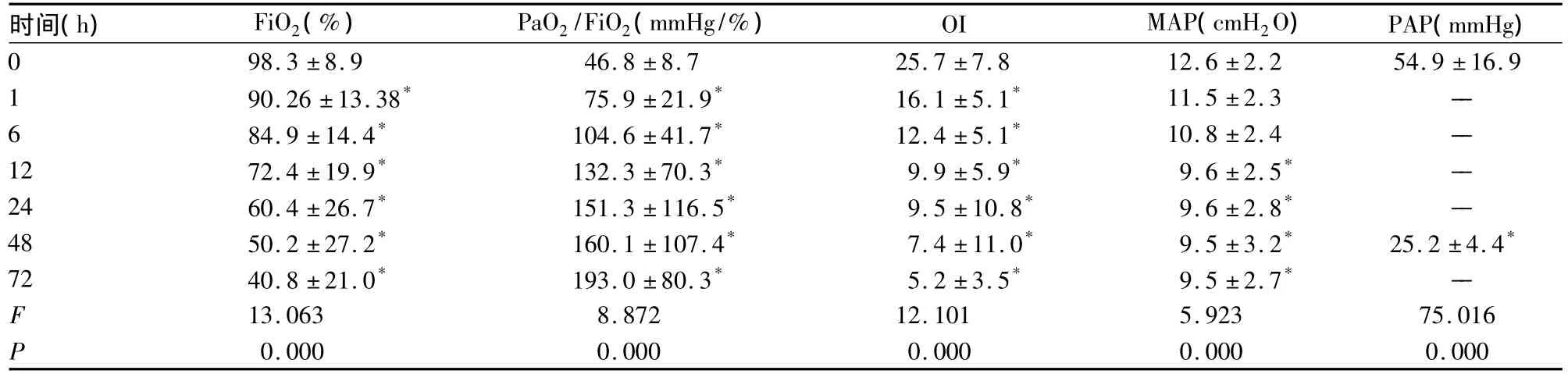
表 2 患儿 FiO2,PaO2/FiO2,OI,MAP,PAP 的变化()
注:治疗前后比较,*P <0.001;--表示未检测
3 讨论
一氧化氮(nitric oxide,NO)是由血管内皮细胞产生和释放的血管活性物质,对肺血管平滑肌有选择性舒张作用。iNO可以激活鸟苷酸环化酶,产生环鸟苷一磷酸而使支气管平滑肌舒张[2]。自1987年Moncada等人发现以来,作为一种强大的选择性肺血管扩张剂已为大家普遍所认识。新生儿出生后24 h呼出气NO的体积分数在3~5 ppm,1周后下降,主要来自于鼻窦,提示出生早期自身NO对于调节肺血管张力起过渡性生理代偿作用,出生后立即气管插管机械通气的新生儿可能存在自身吸入和利用NO的障碍,故可考虑将 iNO作为替代治疗[3]。目前,国内外大量研究显示在足月儿及胎龄>34周的早产儿中,iNO的疗效肯定,但在iNO治疗的最佳浓度、方式以及远期预后几个方面仍无定论。对于胎龄≤34周的早产儿iNO的疗效仍无定论,目前的研究主要针对改善氧合、降低血液降低(BPD)、颅内出血(ICH)等并发症的发生率方面。
我院自2008年引入吸入一氧化氮技术,应用于传统治疗效果欠佳或无效的HRF患儿,明显提高了该类患儿的治疗水平及治愈率。本组资料结果显示,在给予吸入起始15 ppm浓度的NO后,患儿的氧合情况得到了明显的改善,PAP、OI、FiO2下降明显,PaO2/FiO2明显上升,均在治疗1 h就有显著统计学差异(P<0.001),并持续至72 h。MAP变化较慢,直至治疗12 h才有显著统计学意义(P<0.001)。以上结果同国内余章斌等[4]对吸入一氧化氮治疗足月或近足月儿低氧性呼吸衰竭的循证学评价结果相符。目前NO治疗的起始浓度有2、5、10、20、80 ppm[5-10],未见其他浓度的报道。是否存在一个更适当的NO浓度,即可以降低NO的浓度,又不降低NO治疗的效果目前还没有定论。Davidson 等[5]和 Tworetzky 等[7]对 0、5、20 和 80 ppm 的iNO治疗,结果显示20 ppm的iNO治疗氧合改善明显,副作用发生率低。NINOS[6]采用20 ppm的初始浓度对235名OI>25的HRF患儿治疗后发现,20 ppm的iNO治疗能够迅速改善氧合、降低ECMO的使用率。Konduri等[9]的研究显示5 ppm的初始剂量治疗能够改善患儿氧合。Finer等[8]的研究则显示2 ppm的iNO治疗在改善患儿氧合方面与20 ppm具有同样的效果。2008年新生儿呼吸与危重病协作网进行的全国多中心研究采用了10 ppm的起始治疗浓度的研究,发现可以很好的改善HRF患儿的氧合[10]。本组资料采用起始浓度15 ppm的NO吸入,同样获得了理想的改善氧合的效果。
目前的研究显示,iNO治疗新生儿HRF是安全的,但NO仍然存在一定的毒性作用,高浓度NO治疗能够增加出血倾向、肺损伤以及高铁血红蛋白血症的发生。NO可以抗血小板(PLT)黏附和聚集,抑制其功能,延长出血时间[11],故临床应用需严密监测出血倾向,明显出血倾向患者慎用。本组资料给予吸入15 ppm,最大20 ppm浓度的NO治疗后PLT呈下降趋势(P=0.002),4例患儿治疗24 h后PLT<100×109/L,其中3例患儿行头颅超声检查发现ICH,24 h复查头颅超声ICH吸收,72 h复查PLT恢复正常,临床虽无明显出血倾向,但仍提示我们需对NO影响出凝血时间的副作用需要进一步加强相关检查及临床观察。本组病例无1例支气管肺发育不良及动脉导管未闭发生,考虑可能与iNO可在短时间内很快改善患儿氧合,提高动脉血氧水平,促进动脉导管关闭,同时iNO很快改善了氧合,降低了吸入氧浓度及机械通气压力相关,提示iNO可能促进动脉导管关闭,降低支气管肺发育不良的发生率。
本组资料中男性明显多于女性,平均胎龄37周及体质量2880 g,放弃后死亡4例,占到21.1%,这些数据均与国内外同类研究有较大差异,考虑与我院地处西部经济相对落后地区,危重患儿、低出生体重儿有高的放弃率及死亡率相关。
综上所述,吸入起始15 ppm低浓度的一氧化氮治疗新生儿HRF可以获得理想的疗效,且无明显副作用发生,可以早期促进动脉导管关闭,早期应用可能预防支气管肺发育不良的发生,值得临床推广使用,但基于本组资料样本量少,尤其早产儿数量少,还需严格设计的大样本多中心临床随机对照研究进一步验证。
[1]Ersch J,Roth-Kleiner M,Baeckert P,Bucher HU.Increasing incidence of respiratory distress in neonates[J].Acta Paediatr,2007,96(11):1577-1581.
[2]Jiang L,Quarck R,Janssens S,et al.Effect of adenovirus-mediated gene transfer of nitric oxide synthase on vascular reactivity of rat isolated pulmonary arteries[J].Pflugers Arch,2006,452(2):213-221.
[3]孙 波.呼吸机治疗低氧性呼吸衰竭吸入一氧化氮的作用[J].Chin J Pract Pediat,2010,25(2):110-114.
[4]余章斌,韩树萍,郭锡熔.吸入一氧化氮治疗足月或近足月儿低氧性呼吸衰竭的循证医学证据[J].中国当代儿科杂志,2008,10(2):125-129.
[5]Davidson D,Barefield E S,Kattwinkel J,et al.Inhaled nitric oxide for the early treatment of persistent pulmonary hypertension of the term newborn:a randomized,double-masked,placebo-controlled,dose-response,multicenter study[J].Pediatrics,1998,101(3):325-334.
[6]The Neonatal Inhaled Nitric Oxide Study Group.Inhaled nitric oxide in full-term and nearly full-term infants with hypoxic respiratory failure[J].N Engl J Med,1997,336(9):597-604.
[7]Tworetzky W,Bristow J,Moore P,et al.Inhaled nitric oxide in neonates with persistent pulmonary hypertension [J].Lancet,2001,357(9250):118-120.
[8]Finer N N,Sun J W,Rich W,et al.Randomized prospective study of low-dose versus high-dose inhaled nitric oxide in the neonate with hypoxic respiratory failure[J].Pediatrics,2001,108(4):949-955.
[9]Konduri G G,Solimano A,Sokol G M,et al.A randomized trial of early versus standard nitric oxide therapy interm and near-termin fants with hypoxic respiratory failure[J].Pediatrics,2004,113(3):559-564.
[10]Wang Y F,Liu C Q,Gao X R,et al.Effects of inhaled nitric oxide in neonatal hypoxemic respiratory failure from a multicenter controlled trial[J].Chin Med J(Engl),2011,124(8):1156-1163.
[11]蔡俊伟,秦玉明,贪晓明.吸入一氧化氮对持续肺高压新生儿血小板聚集功能的影响[J].中国当代儿科杂志,2003,5(1):35-36.

