卵巢上皮性癌中MMP-7、E-钙黏蛋白的表达及临床意义
叶世勤,杨秀珍,张芸中
(1.兰州大学第二医院妇产科;2.兰州市安宁区万里医院妇产科,兰州 730030)
卵巢癌是妇科常见的恶性肿瘤之一,居女性恶性肿瘤死亡率的首位。由于卵巢癌极易发生转移,且缺乏可靠有效的早期诊断方法,一旦发现,大多已成晚期。因此,通过各种方法寻找卵巢癌的特异性标志物,以进行早期诊断及防治其早期扩散、转移和复发,就成为关键。本研究采用免疫组化的方法检测基质金属蛋白酶-7(matrix metalloproteinase-7,MMP-7)、E-钙黏蛋白(E-cadherin,E-cad)在卵巢上皮性癌中的表达,旨在探讨MMP-7和E-cad与卵巢癌生物学行为及预后的关系。
1 材料与方法
1.1 一般资料 收集兰州大学第二医院近4年存档的53例手术切除的卵巢上皮性肿瘤组织的石蜡包埋标本及其完整的临床资料。按WHO(1999年)分类标准进行肿瘤分型,按FIGO修订的手术病理分期标准进行分期,良性肿瘤20例(浆液性11例,黏液性9例),恶性肿瘤33例(浆液性15例,黏液性18例)。卵巢癌Ⅰ~Ⅱ期14例,Ⅲ~Ⅳ期19例。按组织学分级,高、中分化16例,低分化17例。正常对照组选取行宫颈癌根治术时所切的正常卵巢组织石蜡包埋标本10例,均无癌转移。患者年龄23~70岁,平均年龄46.7岁。所有病例术前均未行化疗或放疗。所有标本用10%甲醛液固定,常规石蜡包埋,连续切片4μm,H·E染色,实验前再次阅片,明确诊断。
1.2 主要试剂及方法 E-cad(克隆系:4A2C7);MMP-7(克隆号1D2);S-P免疫组化染色试剂盒,以上试剂均购自北京中杉金桥生物技术有限公司。染色方法按试剂盒说明进行。石蜡切片经二甲苯脱蜡和梯度乙醇水化,用高压锅进行热抗原修复,修复液为pH 6.0的柠檬酸缓冲液,经DAB显色,苏木素复染,中性树胶封固。实验分别设阳性、阴性和缺省对照。
1.3 结果判定 MMP-7以细胞质内出现棕黄颗粒着色为阳性标记,E-cad的阳性表达于细胞膜,部分胞浆着色,以细胞膜出现棕黄颗粒着色为阳性标记。每张切片高倍镜下选10个高倍视野,每个高倍视野计数100个肿瘤细胞,计算出每张切片的阳性细胞百分数,分为3个等级:阳性细胞数﹤25%为阴性(-),26% ~50%为(+),> 51%为(++)。
1.4 统计学方法 数据用SPSS 12.0统计软件包进行统计学处理。采用χ2检验、秩和检验,两两比较采用Bonferroni矫正检验水准α,Fisherman精确概率检验,P<0.05差异有统计学意义,Spearman等级相关分析。
2 结果
2.1 MMP-7、E-cad在不同卵巢癌组织中的表达MMP-7从正常(10.0%)、良性(30.0%)到恶性(63.6%)组,其阳性表达率呈递增趋势(H=14.645,P=0.001),P < 0.05;E-cad 从 正 常(100.0%)、良性(65.0%)到恶性(54.5%)组,其阳性表达率成递减的趋势(H=6.741,P=0.034),P<0.05。结果分别见图1~4。
2.2 MMP-7、E-cad的表达与卵巢癌临床病理参数的关系 MMP-7、E-cad的表达与患者的发病年龄,病理类型无关,而与卵巢癌的组织分级、临床分期及侵袭转移能力密切相关(表1)。
2.3 MMP-7、E-cad及在卵巢癌组织中表达的相关性 在33例卵巢癌中,MMP-7与E-cad表达共同阳性的为10例,共同阴性的为4例,二者单独阳性分别为11例和8例,经Spearman等级相关分析,表明MMP-7与E-cad的表达没有相关性(r=-0.184,P=0.305)(表 2)。
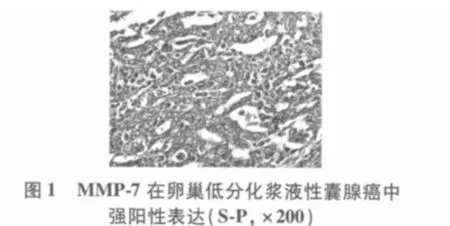
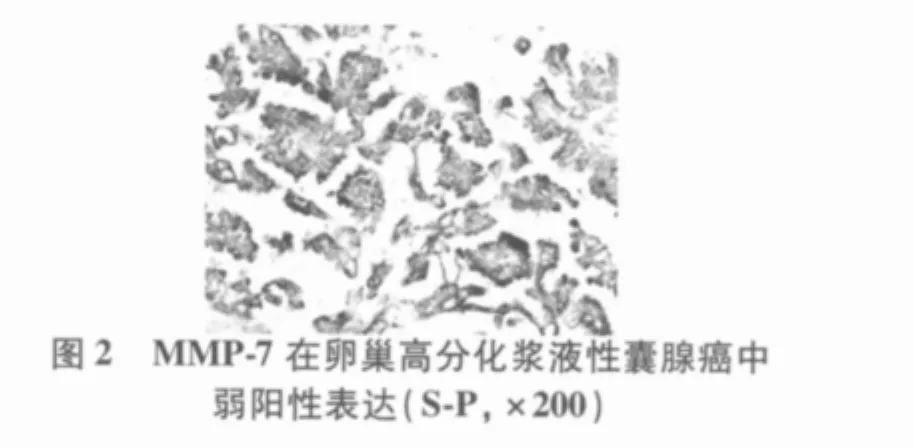

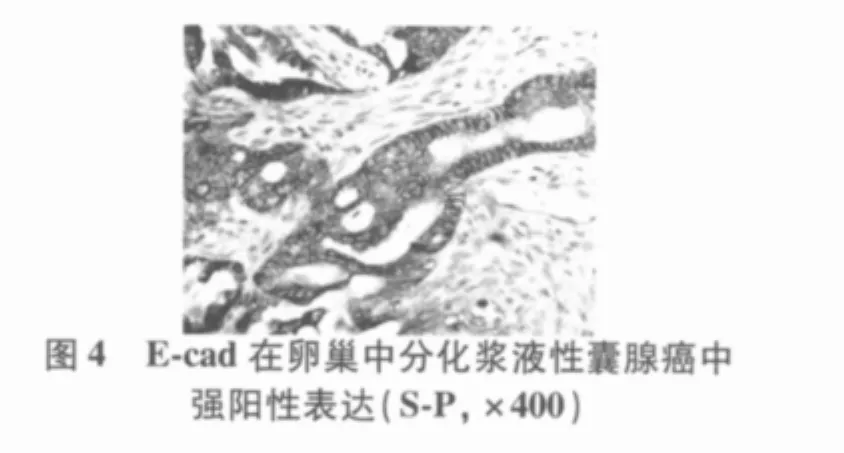
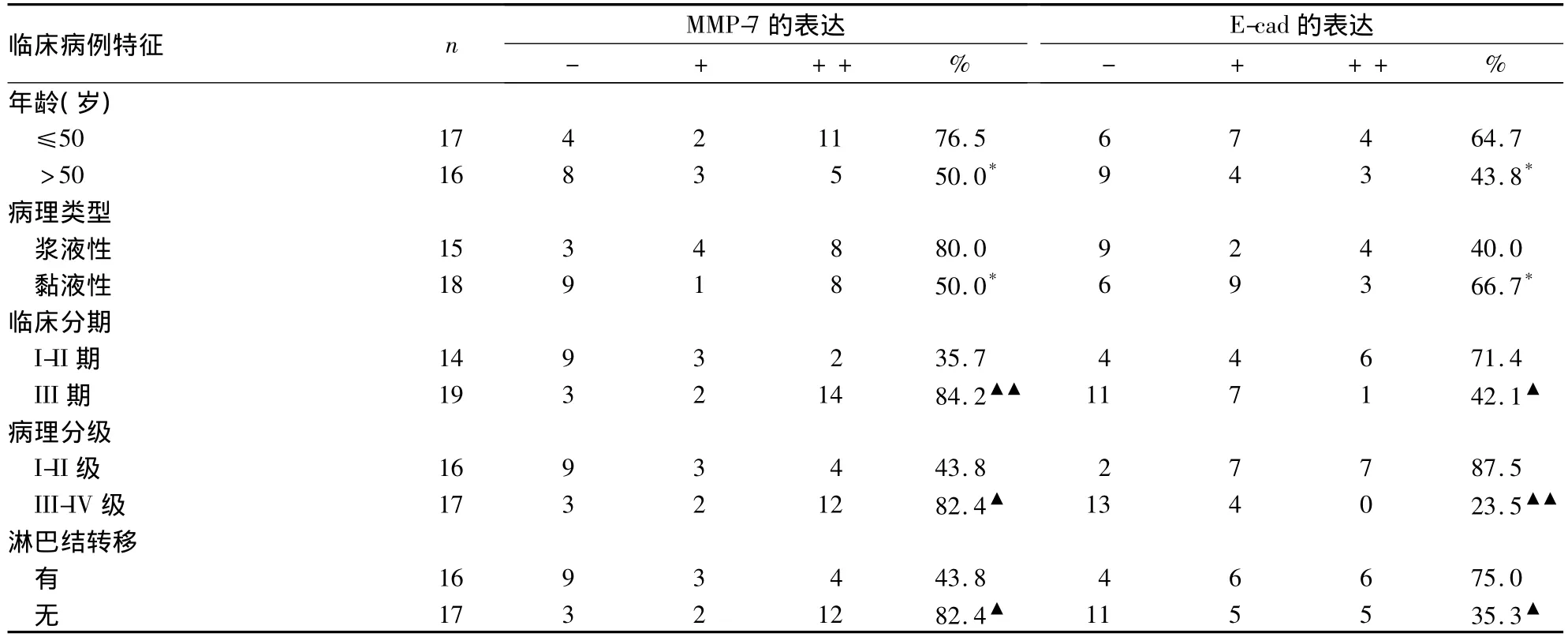
表1 MMP-7、E-cad的表达与卵巢癌临床病理参数的关系
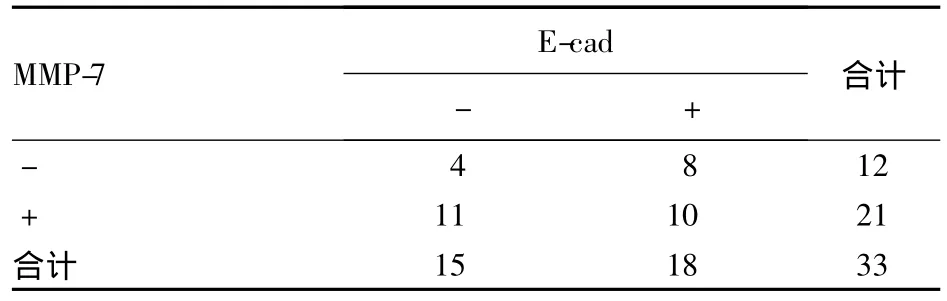
表2 MMP-7与E-cad在卵巢癌组织中表达的相关性
3 讨论
基质金属蛋白酶(MMPs)是一组Zn2+依赖性的可降解细胞外基质(extracellar matrix,ECM)的内肽酶,由多个结构和功能上与细胞外基质(ECM)结构蛋白和生长因子的功能单位具有同源性的区段所组成。MMP-7是基质金属蛋白酶家族成员之一,MMP-7基因是在用人基质分解素-1探针研究人肿瘤cDNA文库时发现的[1]。具有和其他MMP相似的理化性质,如:同其他MMP一样具有降解ECM和基底膜的作用。和其他MMP不同的是,MMP-7不含类血红素结合区[2]。在多种肿瘤的研究中发现,若MMP-7的表达明显增强,则提示 MMP-7在肿瘤的发展与转移中起着重要作用[3]。MMP-7通过降解ECM,破坏机体防御肿瘤浸润的自然屏障,增加癌细胞的侵袭性,而促进肿瘤浸润与转移。MMP-7还通过调节细胞的黏附能力,促进肿瘤血管和淋巴管的生成,为肿瘤细胞转移提供门户。
目前,据国内外有关MMPs在肿瘤侵袭与转移中的报道,所得结果并不一致,存在诸多争议。Sillanpaa等[4]通过对248例原发性卵巢癌肿瘤组织的检测及其患者的预后随访表明,MMP-7在肿瘤细胞的高表达是卵巢癌的一个独立预后预测因子。胡晓霞等[5]应用RT-PCR方法发现,MMP-7及TIMP-3在卵巢恶性及良性肿瘤中阳性表达率明显高于正常卵巢(P<0.000),但它们在卵巢恶性肿瘤中的表达水平与患者的临床病理特征及预后无相关性。俞岚等[6]应用核酸原位杂交和免疫组化发现,MMP-7、MMP-2 mRNA及蛋白的表达阳性率在卵巢癌组均显著高于良性肿瘤组(P﹤0.05),多因素分析,PTNM分期,两者的表达是影响卵巢癌根治术后患者预后的独立因素。
本研究表明,MMP-7在卵巢癌组织阳性表达率明显高于正常组及良性组(P﹤0.05);随着卵巢癌临床分期的增加、组织分化程度降低和有网膜或淋巴结的转移,MMP-7的表达呈明显上升的趋势。这提示,MMP-7可能在卵巢上皮性癌的发生、发展以及浸润转移中起着重要作用,并有望成为卵巢癌患者独立预后的指标。
E-钙黏蛋白是一种介导同种细胞相互黏附的钙依赖性跨膜糖蛋白。主要分布于上皮组织,是与癌细胞侵袭转移密切相关的上皮细胞分布性黏附分子。近年的研究表明,E-cad的减少、异质性和非极性分布使细胞间的黏附减弱,癌细胞易于脱落,是癌转移的首要环节。在大多数恶性肿瘤中,如结肠癌、乳腺癌、肝癌、胃癌、前列腺癌等都存在E-cad介导的细胞-细胞黏附功能的削弱或丧失[7]。E-cad表达失常或缺失的恶性肿瘤多为分化差、分期高、转移及预后差[8]。本研究表明,卵巢癌组织中E-cad阳性表达明显低于正常组及良性组(P<0.05),且随临床分期的增加、组织分化程度降低、有淋巴结的转移阳性表达率均呈下降的趋势。这些结果与上述国内外文献报道基本一致。
在癌基因的研究中,许多学者提出了基因协同作用假说,认为在恶性肿瘤发生、发展和转移的各个阶段,至少有两个或两个以上功能不同的异常及获得基因各自发挥不同的作用,并在时间和空间上相互配合,协同促进了细胞的癌变。Noe等[9]证实MMP-7 降解细胞表面的 E-钙黏素,Mcguire 等[10]也证明了MMP-7能使E-钙黏素在体内发生脱落,在用博来霉素治疗后的野生型小鼠支气管肺泡灌洗液中,脱落的E-钙黏素可以被检测到。同等条件下的MMP-7基因敲除小鼠的肺中E-钙黏素却不能被检测到。高雪等[11]在乳腺癌的研究中证实,E-cad的表达下调及MMP-7表达上调是基底细胞样型高侵袭转移力的发生机制之一。徐桂芳等[12]研究胃癌组织中的E-cad低表达与MMP-9的高表达与患者的预后密切相关。MMP-7可以抑制E-cad表达水平,MMP-7以E-cad为底物进行降解,从而破坏细胞之间的正常连接,导致细胞分化能力和肿瘤浸润能力增强。我们在蛋白水平未得出MMP-7与E-cad之间的相关性(r=-0.184,P=0.1305),可能与本实验样本量较少有关系。
综上所述,本组资料表明,MMP-7的高表达、E-cad的低表达与卵巢癌的生长、浸润和转移等恶性生物学行为密切相关。故联合检测MMP-7、E-cad可作为卵巢癌生物学行为的重要指标。
[1]Muller D,Breathnach R,Engelmann A,et al.Expression of collagenase relatcd mctalloproteinases genes in human lung or head and neck tumors[J].Int J Cancer,1991,48:550-556.
[2]徐 飞,王志新.基质溶解素和肿瘤的关系[J].国外医学·肿瘤学分册,2004,31(11):817-821.
[3]McDonnell S,Navre M,Coffey R J,et al.Expression and localization of the matrix metalloproteinase pump-1(MMP-7)in human gastric and colon carcinomas[J].Mol Carcinog,1991,4:527-533.
[4]Sillanpaa S M,Anttila M A,Voutilainen K A,et al.Prognostic significance of matrix metalloproteinase-7 inepithelial ovarian cancer and its relation to beta-catenin expression[J].Int J Cancer,2006,119(8):1792-1799.
[5]胡晓霞,李 力,黎丹戎,等.卵巢肿瘤中基质金属蛋白酶-7及其抑制剂-3 基因的表达[J].广西医学,2006,28(3):329-332.
[6]俞 岚,汪万英,甘怀勇,等.MMP-2、MMP-7在卵巢癌中的表达及其临床意义[J].中国组织化学与细胞化学杂志,2011,4(20):325-330.
[7]Naora H,Montell D J.Ovarian cancermetastasis integrating in sights from disparate model organisms[J].Nat Rev Cancer,2005,5(5):355-366.
[8]Valizadeh A,Karayiannakis A J,Ei-Hariry Z,et al.Expression of E-cadherin-associated molecules(a-,β-,and r-cadenin and p12)incolore-ctal polys[J].Am J Pathol,1997,150:1977-1984.
[9]Noe V,Fingleton B,Jacobs K,et al.Release of an invasion promoter E-cad-herin fragment by matrilysin and stromelysin-1[J].J Cell Sci,2001,114(1):111-118.
[10]Mcguire J K,Li Q,Parks W C.Matrilysin(matrix metalloproteinase-7)mediates E-cadherin ectodomain shedding in injured lung Epithelium[J].Am J Pathol,2003,162(6):1831-1843.
[11]高 雪,关宏伟,蔡 欣,等.上皮钙粘蛋白和基质金属蛋白酶-7在乳腺癌基底细胞样型和Her-2高表达型中的表达及其意义[J].中华普通外科杂志,2010,25(4):318-321.
[12]徐桂芳,张建东,赵海滨,等.E-钙粘蛋白和MMP-9在胃癌组织中的表达及其临床意义[J].东南国防医药,2010,12(4):308-321.

