补体在百草枯急性中毒肺损伤中的作用研究
安莹波,王汉斌,吴小红,熊锡山,孙世惠,周育森
补体在百草枯急性中毒肺损伤中的作用研究
安莹波,王汉斌,吴小红,熊锡山,孙世惠,周育森
目的:研究补体在百草枯(PQ)急性中毒肺损伤中的作用。方法:采用20mg/kg PQ染毒小鼠,染毒后0 h、4 h、12 h、24 h、48 h检测血清C3c水平、肺组织C3、C5a和C1q沉积和分布;选用PQ染毒剂10mg/kg、20mg/kg分别在染毒前48 h、36 h、24 h腹腔内注射眼镜蛇毒因子(CVF)2.5μg/200μl,染毒后48 h留取支气管肺泡灌洗液(BALF)、肺组织,与未注射CVF以相同剂量染毒小鼠比较BALF总蛋白浓度、髓过氧化物酶(MPO)活性、组织病理以及存活率差异。结果:20mg/kg PQ染毒小鼠血清C3c水平在染毒后12 h升高,24 h达到高峰,持续至48 h;免疫组化显示染毒后4 h C3在肺组织沉积,12 h开始C3沉积减少;C5a、C1q自染毒后4 h开始在肺组织沉积,且随病程延长,着色逐渐加重;CVF阻断补体后染毒小鼠肺组织损伤减轻,炎性细胞浸润减少,且存活时间显著延长。结论:在小鼠PQ中毒急性肺损伤早期,补体即被激活,并发挥重要作用,采用CVF进行补体抑制或阻断,可以有效减轻组织病理损伤。
百草枯;急性肺损伤;补体;眼镜蛇毒因子
R 996
百草枯(paraquat,PQ)是目前使用广泛的有机杂环类除草剂,对人畜有很强的毒性,病死率高达51.7%[1]。PQ进入机体后,2 h血浆浓度达高峰,而肺内浓度是血浓度的20~90倍,易导致肺损伤,多数中毒患者死于呼吸衰竭。目前PQ中毒导致急性肺损伤机制不完全清楚,大多数学者认为与氧化还原反应所产生的毒性产物作用有关。近年来国内外研究表明,在PQ中毒导致急性肺损伤的早期,有大量细胞因子,趋化因子参与[2]。PQ中毒导致肺损伤具有急性肺损伤(ALI)典型的临床表现,其炎症反应表现为肺上皮细胞和血管内皮细胞膜受损,血管通透性增加,多形核白细胞浸润。
多种因素导致的ALI,补体即被激活,补体激活产物(如C3a,C5a)是中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞、单核巨噬细胞在肺内聚集引起肺部炎症损伤的重要趋化因子,并与许多细胞因子与趋化因子相互作用参与组织损伤[3]。本实验通过建立小鼠PQ中毒导致急性肺损伤模型,研究血清C3c及补体成分C3、C5a和C1q在肺组织的表达。初步探讨补体在PQ中毒导致急性肺损伤中的作用,为临床干预治疗提出新的思路,以便提供有效的防治措施。
1 材料及方法
1.1 材料上海先正达投资有限公司提供20%百草枯浓缩液;碧云天生物技术研究所提供Bradford蛋白浓度测定试剂盒;南京建成生物工程研究所提供髓过氧化物酶(MPO)检测试剂盒;徐在海教授惠赠羊抗人补体C3抗体、金黄色葡萄球菌A蛋白(SPA)、过氧化物酶-抗过氧化物酶复合物(PAP);思达生物医学研究所提供大鼠抗小鼠抗补体1q抗体(C1q);郭仁峰教授惠赠兔抗小鼠C5a多克隆抗体;北京中山生物有限公司提供生物素化兔抗大鼠IgG、生物素化山羊抗兔IgG、辣根酶标记链霉卵白素工作液、DAB显色剂。
1.2 动物实验分组BALB/c雌性小鼠,8~12周龄,清洁级,平均体重20 g,军事医学科学院动物中心提供。(1)选择40只BALB/c雌性小鼠,随机分为5组,每组8只。对照组0 h组,小鼠腹腔内注射生理盐水0.5ml。染毒组将PQ浓缩液按不同浓度以生理盐水稀释至0.5 ml后腹腔内注射,以20 mg/kg PQ进行染毒,染毒后4 h、12 h、24 h、48 h组。(2)选择72只BALB/c雌性小鼠,随机分为8组。10mg/kg染毒组2组:P10-1组8只、P10-2组10只;20mg/kg染毒组2组:P20-1组8只、P20-2组10只。动物在PQ染毒前48 h、36 h、24 h腹腔内注射眼镜蛇毒因子(CVF)溶液2.5μg/200μl。CVF+10 mg/kg染毒组2组:C10-1组8只、C10-2组10只;CVF+20mg/kg染毒组2组:C20-1组8只、C20-2组10只。其中P10-2、C10-2、P20-2、C20-2,用以观察存活率,其余小鼠染毒后48 h处死。
1.3 标本采集不同时间点给不同组小鼠腹腔内注射0.5ml氯胺酮溶液深度麻醉后,打开胸腔直接用1ml注射器经小鼠右心室取血;剪开气管,用微量移液器抽取0.8ml生理盐水,注入小鼠肺部,反复灌洗3次,回收支气管肺泡灌洗液(BALF);留取肺组织,分别用于病理学分析、髓过氧化物酶(MPO)活性测定、免疫组化检测。
1.4 检测方法MPO、Bradford蛋白检测:严格按照MPO、Bradford蛋白浓度测定试剂盒规定对小部分肺组织及BALF实施操作。病理标本制备:部分肺组织经4%中性甲醛固定后,按梯度乙醇脱水、石蜡包埋、切片(厚度5μm),苏木素-伊红染色(HE染色),观察病理变化。C3c水平测定:小鼠右心室采血后室温放置30 min,放入4℃冰箱1 h,离心4000 g×10min,分离血清,测定C3c水平。小鼠血清C3c水平以不同时间点的测定值与正常对照之间的比值来表示。补体免疫组化检测:大部分肺组织放入盛有冷冻包埋剂(OCT)的冻存管中,经-196℃液氮速冻后,6μm冰冻连续切片,常规方法进行补体成分的免疫组化检测。取冰冻切片磷酸盐缓冲液(TBS)浸洗5min×2次;滴加一抗,37℃孵育过夜;次日取出,室温放置10min,TBS浸洗5min×3次;滴加二抗,37℃孵育30min,TBS浸洗5 min×3次;滴加PAP标记链霉卵白素工作液,37℃孵育30min,TBS浸洗5min×3次;DAB显色、苏木素衬染、乙醇脱水、二甲苯透明、中性树胶封片,显微镜下观察。阳性结果为细支气管上皮基底膜、血管内皮及肺间质棕褐染色。着色程度分为强阳性(++)、阳性(+)、弱阳性(±)及阴性(-),分别以3、2、1、0表示,进行半定量分析。
1.5 统计学分析用SPSS10.0统计软件分析,计量资料以(s)表示,采用单因素方差分析。P<0.05为差异显著,P<0.01为差异非常显著。
2 结果
2.1 PQ 染毒小鼠血清C3c动态水平变化染毒后4 h血清C3c水平与正常相近;12 h升高明显,到24 h达高峰,一直持续到48 h。12 h、24 h和48 h与 0 h组之间差异非常显著(P<0.01)。见表1。
2.2 染毒后不同时间点补体成分在肺内表达与0 h对照组(图1,A)相比,小鼠染毒后4 h补体C3在肺间质、细支气管上皮及血管内皮表达最强(图1,B),着色逐渐变淡。C5a在肺组织表达增强,染毒后24 h C5a在血管内皮着色显著(图1,C),在肺间质的表达48 h最明显。C1q在染毒后4 h肺血管内皮及间质略有沉积,12 h肺血管内皮着色显著,48 h在肺间质、细支气管上皮基底膜和肺血管内皮均有特异性着色,且最强(图1,D)。见图1。
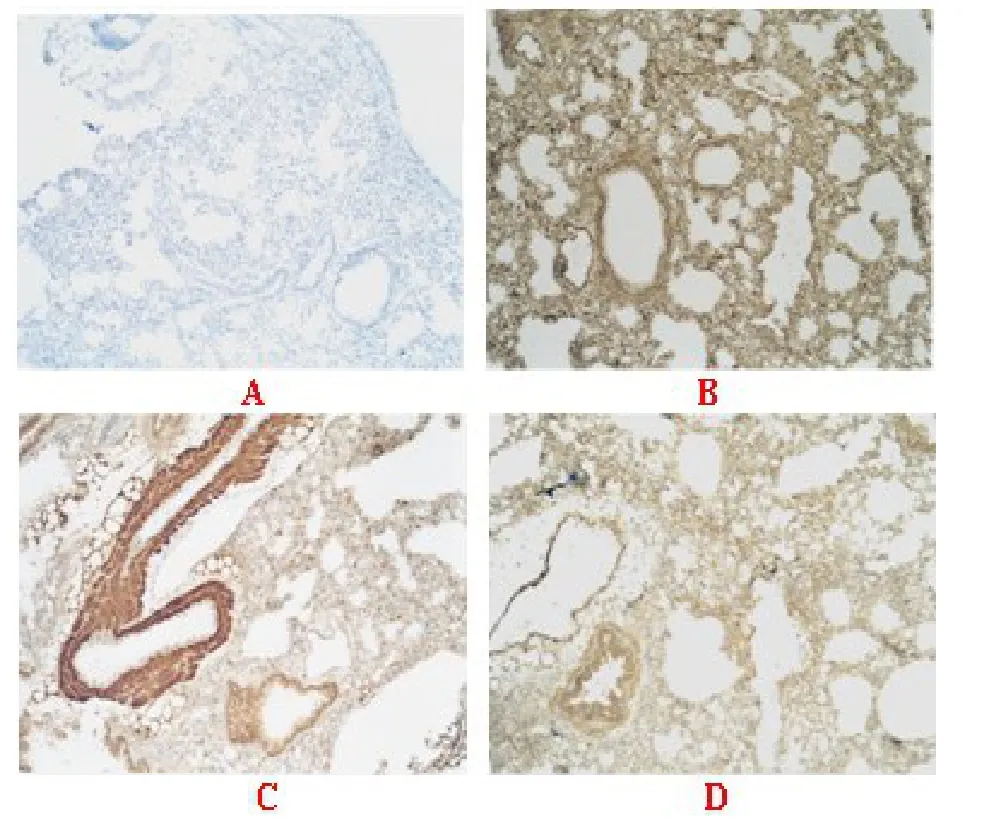
图1 小鼠肺组织补体成分免疫组化检测(显微镜倍数×20)
2.3 补体抑制后染毒对小鼠中毒表现与存活率的情况染毒后第3天P10组部分小鼠出现皮毛疏松、活动度差,呼吸略显急促,体重下降。随病程延长,症状加重,存活率为20%;C10组小鼠无明显中毒表现,且长期存活。P20组小鼠比P10组症状明显加重,第3天P20-2组存活率为0;C20组小鼠中毒表现与P20组相似,但第3天C20组存活率为70%,第4天40%,到第5天为0。可见补体耗竭后10mg/kg染毒小鼠可长期存活,20mg/kg染毒可以延长生存时间。见图2。
表1 染毒后不同时间点各补体成分在肺内表达情况(±s)

表1 染毒后不同时间点各补体成分在肺内表达情况(±s)
注:染毒组与0 h组比较,*P<0.05,**P<0.01
表2 补体耗竭后PQ 染毒小鼠肺系数、BALF 总蛋白含量和肺组织MPO活性(±s)

表2 补体耗竭后PQ 染毒小鼠肺系数、BALF 总蛋白含量和肺组织MPO活性(±s)
注:C10-1与P10-1组、C20-1与P20-1组比较,*P<0.05,**P<0.01
?

图2 补体耗竭后PQ 染毒对小鼠存活率的影响
2.4 补体抑制对PQ 中毒小鼠肺系数、BALF总蛋白含量和肺组织MPO 活性的情况补体耗竭后即在无补体参与情况下,C10-1与P10-1组,C20-1与P20-1组肺系数、BALF总蛋白含量和肺组织MPO活性均有所下降,组间比较,差异显著(P<0.05,P<0.01)。见表2。
2.5 补体抑制后染毒小鼠肺组织病理学观察染毒后48 h P10-1组小鼠肺泡上皮细胞变性脱落,肺泡腔少量渗出液,血管周围轻度组织水肿,支气管上皮细胞轻度变性,炎细胞浸润(图3,A);而C10-1组小鼠肺损伤明显减轻,表现为肺泡上皮细胞基本完好,血管和支气管上皮细胞正常,少量炎细胞浸润(图3,B);P20-1组小鼠肺泡上皮细胞变性脱落,肺泡腔增大,渗出较多,血管周围组织水肿,支气管上皮变性,间隔明显增宽,大量炎细胞浸润(图3,C);C20-1组小鼠肺损伤程度较前者略轻,主要表现在肺泡内腔渗出较少,血管、支气管周围及肺间质炎细胞浸润减少,肺间隔呈局灶性增宽(图3,D)。见图3。
3 讨论
补体为机体非特异性免疫中的重要分子物质,作为机体自我保护的第一道防线,是炎症反应的主要调节机制。但补体过度激活可引起病理损伤。急性肺损伤发病早期,首先是补体系统被激活。补体活化通过经典、旁路替代和凝集素三条主要途径,都以C3活化作为枢纽。本实验采用免疫组化检测补体C3在肺组织的表达,小鼠染毒后4 h补体C3在肺间质、细支气管上皮及血管内皮表达最强,着色逐渐变淡,到48 h则低于正常小鼠。已知C3转化酶裂解C3,产生C3a和C3b,C3b半衰期很短(不到100μs),因子I裂解C3b形成iC3b和可溶性片段C3f,iC3b进一步分裂成C3dg附着于细胞膜,而释放C3c[4]。本实验检测血清C3c水平发现,染毒后4 h血清C3c水平与正常相近;到12 h升高明显,24 h达高峰,一直持续到48 h,C3c增多表明有补体的活化[5]。此结果与相关研究一致[6-7],发现在多发性创伤和脓毒血症患者发生ALI早期表现为C3下降,C3被裂解、消耗,故裂解产物升高。C3裂解产物C3a虽然比C5a活性小10~100倍,其含量却是C5a的20倍,它可以引起血管通透性增强、刺激粒细胞脱颗粒,并可引起杯状细胞黏液分泌[8]。

图3 CVF 耗竭补体染毒小鼠肺组织HE染色(显微镜倍数×20)
PQ染毒后C1q在肺间质、细支气管上皮基底膜及肺血管内皮特异性着色逐渐增强。Mooly等[9]研究表明脂多糖诱发急性肺损伤时,C1q在发病4 h升高,到48 h开始下降。C1是补体系统经典激活途径的起始成分,C1q为具有识别作用的亚单位,在肺组织高表达,说明PQ中毒导致急性肺损伤可能有补体经典途径激活;C1q本身还可以与相应的受体结合,吞噬细胞、粒细胞、内皮细胞、血管平滑肌细胞等都可表达C1q-R;C1q可刺激中性粒细胞、嗜酸性粒细胞等产生过氧化物,可能加重组织损伤[8]。
本实验发现,小鼠染毒后肺组织内C5a表达增强。C5a作为补体激活产物,具有广泛的生物活性,在急性肺损伤的发病中起着非常重要的作用。它是有效的髓系细胞激活剂,尤其是中性粒细胞表达很高的C5aR,趋化作用大大加强,多形核中性粒细胞在肺血管内聚集,释放氧自由基、蛋白溶解酶,导致肺毛细血管内皮细胞、肺间质及肺泡上皮细胞损伤,从而引起通透性肺水肿[10]。另外,中性粒细胞产生的氧自由基、蛋白水解酶、弹性蛋白酶、丝氨酸蛋白酶以及某些细胞因子(如IL-6)等可使C5转化为C5a,引起组织损伤。非髓系细胞如细支气管、肺上皮细胞、血管内皮细胞和平滑肌细胞均表达C5aR,并与C5a发生反应[11]。C5a对血管内皮的作用包括产生炎症因子(如IL-8家族和趋化因子等)和损伤产物(如组织因子有显著的凝血酶原活性),可造成血管内凝血[12]。
CVF作为旁路补体激活物,与B因子结合成CVFB复合物,在D因子作用下裂解为CVFBb复合物,类似于哺乳动物的补体转化酶C3Bb,具有裂解补体C3和C5的作用。CVFBb较C3Bb稳定,半衰期可达7 h,因此可更为持久地裂解C3、C5,直至最后耗竭[12]。本实验给小鼠连续腹腔内注射小剂量CVF后再PQ染毒,结果显示肺系数、BALF总蛋白含量、肺组织MPO活性均有所下降,后两者差异非常显著(P<0.01)。肺组织病理观察C10、C20组小鼠肺组织损伤减轻,以C10组最为显著。小鼠在没有补体参与下染毒,肺组织中性粒细胞浸润减少,肺血管通透性减轻,损伤减轻,存活时间延长,这说明补体在PQ中毒导致急性肺损伤中可能具有促进作用,抑制补体活性可以减轻肺组织损伤。
到目前为止,PQ中毒导致急性肺损伤发病机制尚未完全阐明。长期以来,大多数学者认为氧自由基是其中毒基础,然而采取的一系列针对性治疗措施均未能使死亡率有所下降,本实验通过成功建立小鼠PQ中毒导致急性肺损伤模型,研究补体成分C3、C5a和C1q在中毒后肺组织中的表达情况,并对补体在急性肺损伤中的作用进行了初步探讨,结果发现补体在PQ中毒小鼠导致急性肺损伤早期即被激活,并可能在肺损伤中发挥重要的促进作用。然而,PQ中毒导致急性肺损伤中补体如何被激活,通过哪条途径激活及如何发挥致病作用,还需要深入研究。
[1]张锡刚,汤雪萍,李光,等.早期大剂量甲泼尼松龙联合环孢素A冲击治疗对口服百草枯中毒患者预后的影响[J].解放军医学杂志,2007,32(12):1296-1298.
[2]Cho JH,Yang DK,Kim L,et al.Inhaled nitric oxide improves the survival of the paraquat-injured rats[J].Vascul Pharmacol,2005,42(4):171-178.
[3]Milan Basta,Fredric Van Goor,Stefano Luccioli,et al.F(ab)2-mediated neutral ization of C3a and C5a anaphylatoxins:a novel ef fector function of immunoglobulins[J].Nature medicine,2003,9(4):431-438.
[4]赵修竹,龚非力.补体学[M].武汉:湖北科学技术出版社,1998:16-70.
[5]李影林.中华医学检验全书[M].北京:人民卫生出版社,1997:2069-2081.
[6]Stöve S,Wel te T,Wagner TO,et al.Circulating complement proteins in patients with sepsis or systemic inf lammatory response syndrome[J]. Cl inical and Diagnostic Laboratory Immunology,1996,3(3):175-183.
[7]Kang HJ,Bao L,Xu Y,et al.Increased serum C3 level in Cr ry t ransgenic mice par tial ly abrogates its complement inhibitory ef fects[J]. Cl in Exp Immunol,2004,136(2):194-199.
[8]金伯泉.细胞和分子免疫学[M].北京:科学出版社,2001:240-276.
[9]Bolger MS,Ross DS,Jiang H,et al.Complement leveld and activity in the normal and LPS-injuried lung[J].Am J Physiol Lung Cel l Mol Physiol,2007,292(3):L748-759.
[10]Whitehead GS,Grasman KA,Kimmel EC.Lung function and airway inf lammation in rats fol lowing exposure to combustion products of carbon-graphite/epoxy composite material:comparison to a rodent model of acute lung injury[J].Toxicology,2003,183(1-3):175-197.
[11]Schmid RA,Zol linger A,Singer T,et al.Ef fect ofsoluble complement receptor type 1 on reper fusion edema and neutrophi l migration af ter lung al lot ransplantation in swine[J].J Thorac Cardiovasc Surg,1998,116(1):90-97.
[12]Younger JG,Sasaki N,Delgado J,et al.Systemic and lung physiological changes in rats af ter int ravascular activation of complement[J].J Appl Physiol,2001,90(6):2289-2295.
基金编号:国家自然科学基金(NSFC1071538,30972616)
100085北京,北京市海淀医院急诊科(安莹波);解放军307医院肾内科(王汉斌,熊锡山);军事医学科学院五所(吴小红,孙世惠,周育森)
周育森,E-mai l:yszhou@nic.bmi.ac.cn
2012-08-06)

