新城疫病毒感染活化的人肝星状细胞系LX-2
李亚琳
(渭南师范学院化学与生命科学学院,陕西渭南 714000)
新城疫病毒(newcastle disease virus,NDV)是单股负链RNA病毒,具有天然的在肿瘤细胞选择性复制的特点。现在有一种观点认为,NDV也可以在活化的非正常转化细胞中高效复制。早在1976年就有报道,NDV能够在活化的T细胞中复制,并导致活化T细胞的死亡;后来又有报道证明,NDV能够在非正常转化细胞中高效复制[1]。
肝星状细胞(hepatic stellate cell,HSC)是肝脏的非实质细胞,其活化是肝纤维化发生的主要原因,而肝纤维化是肝癌前病变的重要病理阶段。因此着眼于活化HSC的靶向治疗是抑制肝纤维化,改善肝癌状况的一个新的研究热点[2]。由于活化HSC也是一种非正常的、具有增殖能力的转化细胞,本实验以该细胞为出发点,探讨溶瘤NDV在活化HSC中的复制情况,为肝纤维化治疗以及肝癌的预防提供理论基础。
1 材料与方法
1.1 细胞与病毒
人肝星状细胞系LX-2(美国Mount Sinai医学院Scott L.Friedman教授馈赠);重组NDFLtag-EGFP和溶瘤株 NDV-Italien(德国癌症研究中心 Volker Schirrmacher教授馈赠)。NDFLtag-EGFP是由NDV LaSota株经过反向遗传技术获得,能够表达增强型绿色荧光蛋白(enhanced green fluorecence protein,EGFP)。
1.2 主要试剂
DMEM培养基(Hycolon公司);新生牛血清(中国杭州四季青公司);Trizol试剂(Invitrogen公司);ReverTra Ace-α-TM(Toyobo公司);Taq DNA 聚合酶(TaKaRa公司);α-SMA、COLLAGENⅠ、TGF-β1 以及GAPDH引物(上海生工生物工程技术服务有限公司合成);重组人 TGF-β1(PeproTech Asia公司);鸡抗NDV-HN一抗和兔抗鸡IgY-FITC二抗(USBiological公司)。
1.3 方法
1.3.1 细胞培养及条件培养基的制备:LX-2和小鼠原代培养HSC于37℃、5%CO2及饱和湿度下分别用DMEM(含5%或10%NBCS、100 U/mL青霉素和100 mg/L链霉素)在培养箱中培养。
1.3.2 病毒的制备:将10 000 HU的NDV-Italien和NDFLtag-EGFP,按104~106倍稀释,接种9~10日龄(温度37℃,湿度60% ~65%的孵箱孵育9~10日)的无特异病原体(specific pathogens free,SPF)鸡胚(梅里亚维通实验动物技术有限公司,北京),每只鸡胚注射100 μL病毒到尿囊腔。继续在温箱中孵育3~4 d,每天翻蛋2次。第4天,将所有的鸡胚置于4℃冰箱过夜以便于鸡胚中的血液凝固,利于病毒收获。
从4℃冻存的鸡胚中吸出尿囊液,经低速离心,弃去沉渣,含NDV的上清液再经超速蔗糖密度梯度离心纯化病毒。沉淀物用PBS重悬,血凝法测定NDV的滴度,并调整为5 000 HU,分装,-70℃保存备用。
1.3.3 NDV的感染:细胞按一定密度接种在培养板中,过夜,待细胞完全贴壁后,用不含血清的培养液洗细胞2次,然后加入一定稀释浓度的NDV,置培养箱中1 h。弃掉病毒液,再用不含血清的培养液洗细胞2次,换新鲜培养液继续培养。
1.3.4 MTT检测TGF-β对LX-2细胞的促增殖效应:LX-2细胞以5×103个/孔接种于96孔板,培养24 h后,换成含0.5%NBCS的DMEM培养基饥饿24 h。TGF-β1用含有2%NBCS的 DMEM 分别稀释成 2、1.5、1、0.5 和0.25 μg/L。对照孔不含TGF-β1。饥饿24 h后,细胞换上以上不同稀释浓度的TGF-β1,每个浓度做3个复孔。继续培养24 h后,每孔加5 g/L的 MTT[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide]溶液10 μL,4 h后,弃掉培养上清,每孔加100 μL的 DMSO,溶解形成的甲臢结晶,于490 nm分光光度法检测细胞的吸光度值,并计算细胞增殖率,公式为:细胞增殖率=(实验组细胞吸光度值-对照组细胞吸光度值)×100%/对照组细胞吸光度值。
1.3.5 半定量RT-PCR分析LX-2细胞的基因表达:LX-2细胞接种于6孔板中,按上述方法用含0.5%NBCS的DMEM培养基饥饿后,再用2 μg/L TGF-β1 刺激。24 h后,每孔加1 mL Trizol,置冰上裂解细胞5~10 min,收集裂解液到1.5 mL Eppendorf管中。根据Protocol提取总RNA,并用紫外分光光度计测定260 nm和280 nm处的吸光度值,计算RNA的含量和纯度。
采用两步法 RT-PCR检测 α-SMA、COLLAGENⅠ和 TGF-β1的表达。首先每个样品取2 μg RNA,Oligo(dT)为引物,反转录体系为20 μL,用 ReverTra Ace-α-TM试剂盒反转录形成第1股cDNA。运行条件是:42℃延伸30 min,99℃终止5 min。然后用rTaq polymerase和特异性引物(表1)进行PCR扩增。每个样品取2 μL的反转录产物为模板进行PCR,反应体系25 μL,运行条件是:94℃ 预变性3 min,94℃变性30 s,不同退火温度下引物结合30 s,72℃ 延伸30 s,35 个循环后,再72℃ 延伸10 min。甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参。

表1 RT-PCR引物Table 1 Primer sequences for RT-PCR
1.3.6 荧光显微镜技术观察NDFLtag-EGFP在LX-2及原代培养的小鼠HSC细胞中的复制:HSC细胞在传代培养过程中会自发活化,因此实验用NDFLtag-EGFP(1∶100稀释)感染不同传代的LX-2细胞和原代分离以及传代的小鼠HSC细胞,观察NDV在细胞中的复制情况。两种细胞以1×105个/孔接种到6孔板(预铺盖玻片)。24 h贴壁后或用2 μg/L TGF-β1预刺激后,按照上述方法进行NDFLtag-EGFP感染,细胞继续培养24 h,然后用荧光显微镜直接观察NDV在细胞中的复制情况。1.3.7 流式细胞术定量NDFLtag-EGFP和NDVItalien在 LX-2细胞中的复制:NDFLtag-EGFP(1∶100稀释)感染不同传代的LX-2细胞,然后用流式细胞仪(flow cytometry,FACS)检测荧光强度以定量NDV在细胞中的复制。对于NDV-Italien的感染,需要将 LX-2细胞以1×105个/孔接种到6孔板。24 h贴壁后,用含有0.5%NBCS的DMEM培养基饥饿24 h。然后用2 μg/L TGF-β1预刺激LX-2细胞使其活化,再用NDV-Italien(1∶500稀释)感染细胞,24 h后消化细胞,并用鸡抗NDV-HN一抗和FITC标记的兔抗鸡二抗检测NDV-Italien在LX-2细胞中的表达,并用流式细胞仪(flow cytometry,FACS)检测NDV在细胞中的复制。
1.4 统计学分析
2 结果
2.1 TGF-β1对LX-2细胞的增殖影响
不同浓度的TGF-β1刺激LX-2细胞24 h后,MTT检测细胞的增殖。TGF-β1促进LX-2细胞的增殖,且具有剂量依赖性,当其浓度为2 μg/L时,细胞增殖率为24.6%(图 1A)。用2 μg/L TGF-β1 刺激 LX-2 细胞,RT-PCR 检测显示,细胞中 TGF-β1、α-SMA和COLLAGENⅠmRNA的表达均显著上调 (P<0.05)(图1 B)。RT-PCR电泳条带的灰度扫描结果(表2),数字为3次独立实验的平均值(±s)。

表2 RT-PCR电泳条带的灰度扫描结果Table 2 The result of gray scanning for RT-PCR electrophoretic band
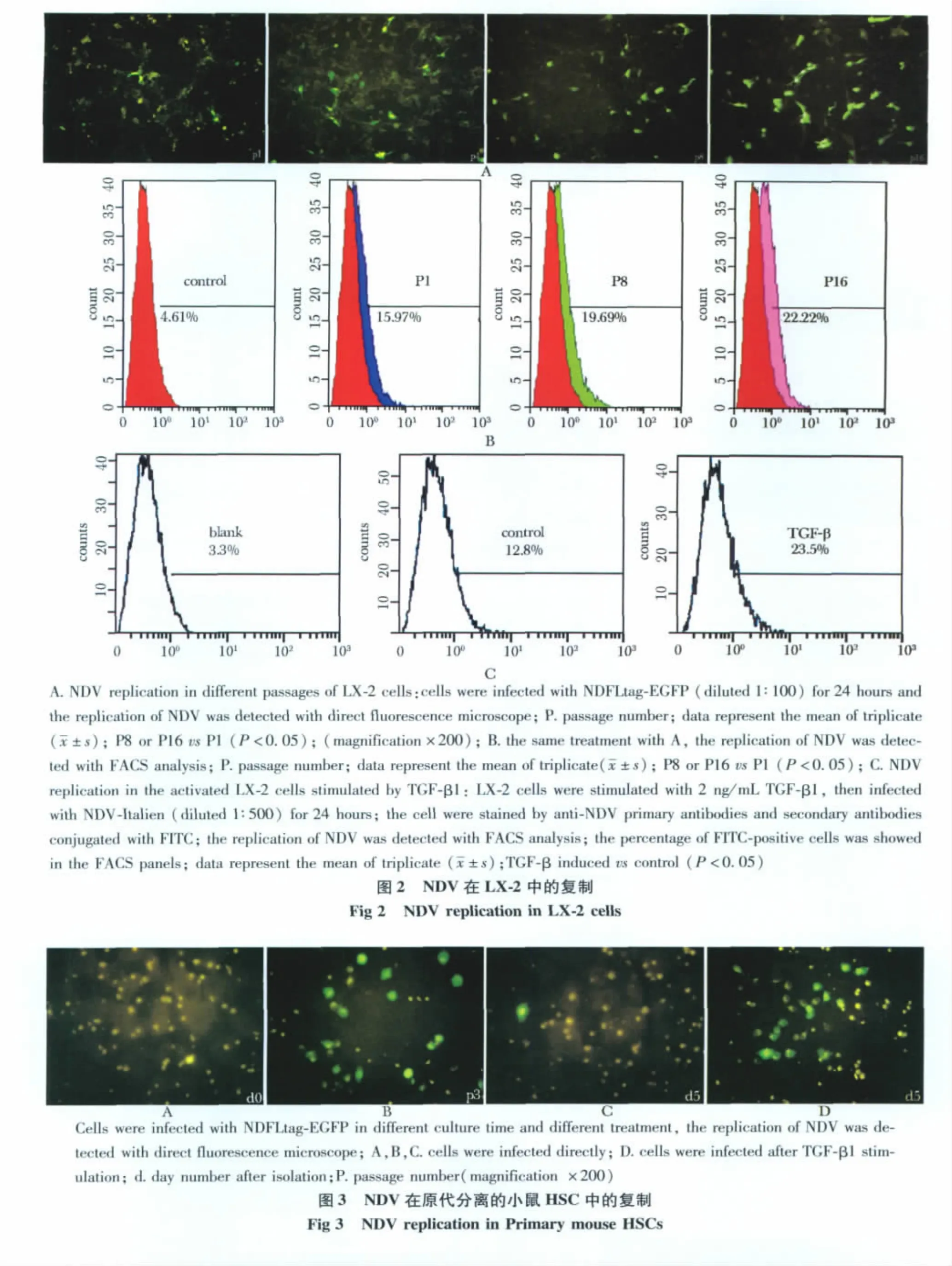
2.2 NDV在LX-2细胞中的复制
用NDFLtag-EGFP感染不同传代的LX-2细胞,荧光显微镜观察发现,在传代次数多的细胞中病毒复制率高,而在传代次数少的细胞中病毒复制率低(图2A)。FACS分析显示,NDV复制率从P1代的15.65%±0.92%增加到P16代的23.05% ±1.5%(图2B)。进一步用FACS检测了NDV-Italien在活化 LX-2细胞中的复制。LX-2细胞经2 μg/L TGF-β1刺激活化后,NDV在细胞中的复制率增加了1.8倍,NDV复制率从12.8% ±1.4% 增加到22.7% ±1.7%(图2C)。

图1 TGF-β1促进LX-2的活化Fig 1 TGF-β1 stimulated LX-2 cells to be activated
2.3 NDV在原代分离的小鼠HSC中的复制
用NDV感染分离的原代培养的小鼠HSC。结果显示,随着原代分离细胞培养时间的延长和传代次数的增加以及 TGF-β1的刺激,细胞趋于活化,NDFLtag-EGFP在细胞中复制的效率也逐渐增加(图3)。
3 讨论
本实验用到了两株NDV,NDV-Italien和 NDFLtag-EGFP。NDV-Italien为野生型强毒株;NDFLtag-EGFP来源于弱毒株NDV-LaSota,其F基因进行了定点突变,并将EGFP基因插入在NP基因的上游,因此能够直接通过荧光显微镜观察病毒在细胞中的复制情况[3]。
肝组织中HSC细胞的活化是肝纤维化发生的关键。肝癌和肝硬化患者的肝组织中,α-SMA阳性的HSC大量浸润也充分说明活化HSC在肝癌和肝硬化发展中的重要作用[4-5]。因此,靶向HSC的抗纤维化治疗是一个重要的阻止肝癌肝硬化发生的有效途径[6-7]。
HSC的活化有许多诱发因素,但受损的肝细胞分泌许多细胞因子来刺激其活化却是最主要的原因之一。这些细胞因子中,最主要的是 PDGF和TGF-β1。TGF-β1主要是在HSC由静止状态到活化状态的成肌纤维细胞的转型过程中起作用,诱导HSC活化并产生过量的ECM进而形成肝纤维化[8]。因此本实验用TGF-β1刺激LX-2使其活化。
实验用不同的方法调查了NDV在LX-2细胞中的复制情况。因为LX-2细胞在培养的过程中可以随着传代培养时间的延长而自发的活化[9-10],因此用NDFLtag-EGFP感染不同传代的LX-2细胞,然后用荧光显微镜直接观察或者用FACS分析NDV在细胞中的复制。结果证明,在传代次数多的LX-2细胞中NDV的复制率越高,反之亦然。TGF-β1刺激LX-2细胞使其活化后,NDV-Italien在活化的LX-2细胞中的复制效率也大幅度提高。
为了进一步验证这个结论,本实验用NDFLtag-EGFP感染原代分离的小鼠HSC,也得出了一致的结果,即随着培养时间的延长以及TGF-β1的刺激,细胞越趋于活化,NDV的复制效率也越高。所有这些结果证实了我们的假设,活化的HSC细胞更有利于NDV的感染,说明HSC细胞的活化易化了NDV在其中的复制。
NDV在临床治疗中因极少产生负面不良效应而成为肿瘤生物治疗的一个安全平台[11]。它能够在肿瘤细胞和转化细胞中选择性复制的主要原因是能够诱导内质网的应激压力从而引起P53非依赖的细胞凋亡[12]。曾经有关于NDV能在活化的T细胞中复制并促进活化的T细胞凋亡的报道。本实验虽然证明了活化的非正常转化的LX-2细胞是NDV复制的一个靶标,但未能解释HSC的活化之所以能够易化NDV复制的机制,这是以后研究中有待解决的问题。
[1]Fábián Z,Csatary CM,Szeberényi J,et al.P53-independent endoplasmic reticulum stress-mediated cytotoxicity of a Newcastle disease virus strain in tumor cell lines[J].J Virol,2007,81:2817 -2830.
[2]扈彩霞,郑加生,王玉珍,等.大鼠肝纤维化组织内ROCK-Ⅰ、磷酸化MBS Thr-697和α-SMA表达增强[J].基础医学与临床,2010,30:355-359.
[3]Al-Garib SO,Gielkens AL,Gruys E,et al.Tissue tropism in the chicken embryo of non-virulent and virulent Newcastle diseases strains that express green fluorescence protein[J].Avian Pathol,2003,32:591 -596.
[4]Kurogi M,Nakashima O,Miyaaki H,et al.Clinicopathological study of scirrhous hepatocellular carcinoma[J].J Gastroenterol Hepatol,2006,21:1470 -1477.
[5]何文艳,刘静,刘树贤.肝纤维化大鼠骨髓间充质干细胞体外诱导为类肝细胞[J].基础医学与临床,2009,29:277-282.
[6]Kinoshita K,Iimuro Y,Otogawa K,et al.Adenovirus-mediated expression of BMP-7 suppresses the development of liver fibrosis in rats[J].Gut,2007,56:706 -714.
[7]Campbell JS,Johnson MM,Bauer RL,et al.Targeting stromal cells for the treatment of platelet-derived growth factor C-induced hepatocellular carcinogenesis[J].Differentiation,2007,75:843-852.
[8]Breitkopf K,Haas S,Wiercinska E,et al.Anti-TGF-beta strategies for the treatment of chronic liver disease[J].Alcohol Clin Exp Res,2005,29:121 -31.
[9]Taimr P,Higuchi H,Kocova E,et al.Friedman S,Gores GJ.Activated stellate cells express the TRAIL receptor-2/death receptor-5 and undergo TRAIL-Mediated Apoptosis[J].Hepatology,2003,37:87-95.
[10]Xu L,Hui AY,Albanis E,et al.Human hepatic stellate cell line,LX-1 and LX-2:new tools for analysis hepatic fibrosis[J].Gut,2005,54:142 -151.
[11]Kelly E,Russell SJ.History of oncolytic viruses:genesis to genetic engineering[J].Mol Ther,2007,15:651 -659.
[12]Zorn U,Dallmann I,Grosse J,et al.Induction of cytokines and cytotoxicity against tumor cells by Newcastle disease virus[J].Cancer Biother,1994,9:225-235.

