肝门部胆管癌49 例手术并发症分析
金昌国,张利刚,欧阳才国,董家鸿
肝门部胆管癌(hilar cholangiocarcinoma ,HCC)又称Klatskin 瘤,是指发生于胆囊管开口以上肝总管与左、右二级肝管起始部之间胆管的癌,约占肝外胆管癌的58% ~75%。曾被认为是一种发病率低、诊断困难、难以治愈的疾病。目前随着影像学技术的发展及围术期管理及手术技巧的提高,手术切除率及存活率不断提高[1,2]。但由于肝门部胆管癌特殊的解剖位置和早期侵犯周围血管、神经、淋巴组织及邻近肝组织的生物学特性,及合并黄疸、凝血异常、胆管炎等病理状态,致使其手术难度增大,术后并发症发生率仍很高[3,4]。本研究回顾性分析2000-06 至2010-05 在航天中心医院进行外科手术治疗的肝门胆管癌患者手术并发症,以期进一步探寻手术并发症影响因素。
1 对象与方法
1.1 对象 共49 例,男30 例,女19 例,男女比例1.58∶1,平均57 岁(28 ~80 岁),病程14 ~60 d,平均37 d。血清总胆红素17 ~634 μmol/L,平均251.3 μmol/L,总胆红素≥400 μmol/L 者18 例,<400 μmol/L 者31 例。血清白蛋白21 ~44 g/L,平均34.1 g/L,均有不同程度的升高。术前凝血酶原时间异常者7 例,49 例均行B 超及腹部CT 检查,24例行磁共振胆胰管成像,9 例行内镜逆行胰胆管造影,所有病例均见不同程度的肝内胆管扩张,45 例显示肝门部肿物。肿瘤根据Bismuth 分型可分为:Ⅰ型11 例,Ⅱ型16 例,Ⅲa 型8 例,Ⅲb 型12 例,Ⅳ型2 例。术前胆道引流16 例(经皮肝穿刺胆管引流12 例,鼻胆管引流4 例),术前合并胆管炎6 例,术前均未行门静脉栓塞。
1.2 手术方式 所有病例均行根治性手术治疗。胆管局部切除+胆肠吻合术17 例(针对Ⅰ型及部分Ⅱ型),联合肝切除32 例。针对大部分Ⅱ型病变联合局限性肝切除,其中行肝方叶切除5 例,肝方叶加尾状叶切除3 例,肝方叶加右前叶下段加尾状叶切除2例;针对Ⅲ型以上病变联合大范围肝切除,左半肝切除+尾状叶切除11 例,右半肝切除+尾状叶切除8例,肝中叶切除3 例;联合血管切除重建7 例。所有患者均行肝十二指肠韧带淋巴结骨骼化清除。
1.3 统计学处理 选取术前、术中临床及病理指标针对并发症发生率进行单因素分析,选择显著性因素进行多因素分析。统计学处理采用SPSS 17. 0软件,单因素分析采用χ2检验或Fisher 精确检验(当n <5 时),多因素分析采用Logistic 回归模型(后退法)。以P <0. 05 为差异有统计学意义。
2 结果
手术时间140 ~980 min(平均480 min),术中失血量180 ~4650 ml(平均983 ml)。术中输注红细胞23 例(46.9%),输注红细胞量400 ~3200 ml(平均673 ml)。术后病理证实R0 切除(肉眼及组织学病理检查切缘均无癌残留)40 例(81.6%),R1切除(肉眼下切缘无癌残留;组织学病理检查可见切缘癌残留)6 例(12.2%),R2 切除(肉眼可见切缘癌残留)3 例(6.1%)。术后病理类型高分化腺癌18 例(36. 7%),中分化腺癌14 例(28. 6%),低分化腺癌12 例(24. 5%),乳头状腺癌5 例(10.2%)。术后发生并发症23 例(46.9%),共发生32 例次(平均每人1.4 例次),其中以胆漏(9 例,28.1%)、腹腔感染(6 例,18. 8%)、胸腔积液(5例,15.6%)、切口感染(4 例,12.5%)为主。按Dindo – Clavien 术后并发症分级[5],Ⅴ级3 例(6.1%),Ⅲb 级1 例(2.0%),Ⅲa 级4 例(8.2%),Ⅱ级6 例(12.2%),Ⅰ级9 例(18.4%),其中Ⅲ级以上占8 例(16.3%)。围术期死亡3 例,1 例死于肝衰竭,1 例死于应激性溃疡致多器官功能障碍,1例死于肺部感染致呼吸窘迫综合征。腹腔出血患者经再次手术治愈,其余并发症经非手术治疗治愈,包括3 例腹腔穿刺引流、1 例胸腔穿刺抽液。术后平均住院日18 d(9 ~52 d)。
与术后并发症发生有关的临床病理指标的单因素分析见表1,其中联合肝切除(P=0.017)、血管切除重建(P=0.026)、手术时间(P =0.033)、Bismuth分型(P=0.001)、术中失血量(P =0.003)、术中输红细胞量(P=0.017)组间差异有统计学意义。进一步对显著指标进行多因素分析见表2,联合肝切除(P=0.011)、手术时间(P=0. 027)、术中失血量(P=0. 022)是影响肝门部胆管癌术后并发症的3个独立危险因素。
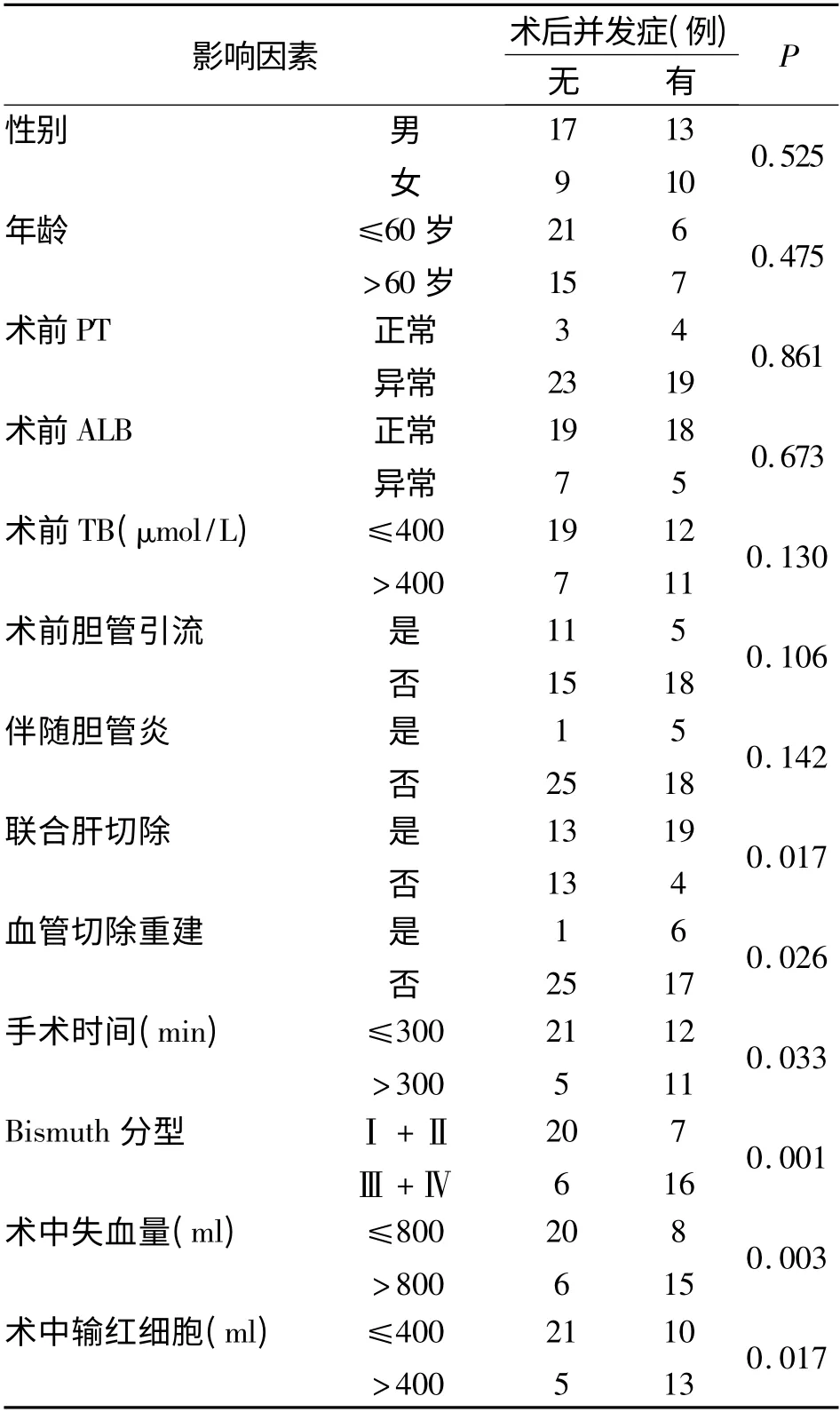
表1 49 例肝门部胆管癌手术患者并发症单因素分析

表2 49 例肝门部胆管癌手术并发症多因素分析
3 讨论
自从认识到切缘癌残留是远期疗效的独立危险因素以来[6-8],在全世界范围普遍采取了更加激进的手术方式,包括大范围肝切除及血管切除重建、联合胰十二指肠切除等。随着手术切除范围的扩大,手术根治度得到了明显提高,但远期疗效似乎并未明显提高。一方面是由于手术范围的扩大增加了手术病死率,从而间接抑制了总体生存率的改善;另一方面是术后并发症抑制了机体免疫状态[9],促进了潜在的微转移肿瘤加速生长,导致肿瘤的局部复发及远处转移。一些研究[10,11]已经证实,术后感染并发症对实体瘤术后远期疗效有显著的负面影响。因而近一段时间内肝门部胆管癌外科治疗中亟需解决的问题是控制术后并发症的发生。目前对肝门部胆管癌术后并发症的对比研究很少,原因是尚无统一的并发症分级评价标准。本研究采用了Dindo –Clavien 分级,Ⅰ~Ⅱ级为轻度并发症,Ⅲ~Ⅴ级为重度并发症。本组总的术后并发症发生率为46.9%,类似于文献[3,4]报道40% ~65%,重度并发症发生率为16.3%,低于Chauhan 等[12]报道[其重度(Dindo – ClavienⅢ~Ⅴ级)并发症发生率为47%],可能是因为本组大范围肝切除病例比例较少(22/49),而Chauhan 组大范围肝切除病例比例较多(39/51)所致,需进一步研究评价。
Hasegawa[6]在肝门部胆管癌术后并发症相关围术期因素分析发现术中失血量、手术时间、手术范围与术后并发症显著相关,与本研究结果相同。本研究中手术失血量>800 ml 组术后并发症发生率为71.4%(15/21)明显高于≤800 ml 组28.6% (8/28),差异有统计学意义(P =0.003)。手术时间>300 min 组并发症发生率为68.8%(11/16)明显高于≤300 min 组36.4%(12/33),差异有统计学意义(P = 0.033)。联合肝切除组并发症发生率为59.4%(19/32),明显高于未联合肝切除组23.5%(4/17),差异有统计学意义(P=0.017)。
肝功能衰竭是肝门部胆管癌术后最严重并发症之一,也是导致患者术后死亡的主要原因。目前较为公认的术后肝功能衰竭的定义是术后5 d 之后血清总胆红素超过100 mg/L。保留的功能性肝体积不足是术后肝功能衰竭的主要原因,因此在涉及极量肝切除术中,一般需要经过术前处理。(1)术前行门静脉栓塞。该措施为由Makuuchi 等于1990 年提出,手术前患侧(多为右侧)行经皮门静脉栓塞,待对侧肝脏代偿性增生后手术。目前东西方医学界对此并未达到共识。支持者称门静脉栓塞可以使被栓塞段肝脏细胞凋亡,未栓塞段肝脏大量增殖,增加预留肝体积可减少术后并发症的发生[13,14]。而反对者认为门静脉栓塞不能有效预防术后肝功能衰竭,同时存在操作上及导管相关性并发症和潜在促肿瘤生长作用[15,16],故不主张术前门静脉栓塞。因本组病例无门静脉栓塞病例,对此不能做出评价。(2)术前胆管引流减黄。肝门部胆管癌大部分伴有梗阻性黄疸,黄疸可使胆管癌患者的肝功能受到不同程度的损害,增加手术风险,尤其在极量肝切除时会出现致死性肝衰竭。因此术前应先行胆管引流,将血清胆红素降到安全水平后再行手术。对术前减黄目前国际上存在争议,日本学者提倡术前进行保留侧胆管引流,4 ~6 周后血清胆红素降至20 mg/L时手术,在大范围肝切除上取得了良好的效果[13],而西方学者认为术前减黄不能有效减少手术风险,而胆道引流招致感染并发症,增加住院费用[6]。我国黄志强[17]提出只在施行广泛的肝切除手术或不宜早期手术且TBIL >400 μmol/L 时术前才行减黄。陈孝平[18]认为,不宜常规行术前胆管引流,仅在黄疸时间超过4 周以上而且血清总胆红素超过200 μmol/L 时进行。笔者借鉴了陈孝平的观点,仅在胆红素超过20 mg/L 且黄疸时间超过4 周以上病例选择性进行了术前减黄。(3)最大限度地保留功能性肝组织。采用保留肝组织的限制性肝切除术,保证切缘无癌残留的前提下保留了充足的功能性肝组织,避免或缓解术后肝功能不全的发生。陈孝平[18]和van Gulik[19]经过筛选合适的病例采用了保留肝组织的限制性肝切除治疗肝门部胆管癌取得良好的近远期疗效。本组局限性肝切除10 例,其中3例发生了术后并发症(30%),均为Dindo – ClavienⅠ级,远期疗效需进一步随访评价。
综上所述,肝门部胆管癌手术应尽量避免联合肝切除,术前精确评估、围术期精心管理、改进手术技术、减少手术时间及术中失血,采取合适的手术范围,可明显降低肝门部胆管癌术后并发症发生率。
[1] 黄志强. 肝门部胆管癌的外科治疗与发展[J]. 中国普外基础与临床杂志,2003,10(5):425-428.
[2] Grandadam S,Compagnon P,Arnaud A ,et al.Role of preoperative optimization of the liver for resection in patients with hilar cholangiocarcinoma type Ⅲ[J].Ann Surg Oncol,2010,17(12):3155-3161.
[3] Giuliante F,Ardito F,Vellone M,et al. Liver resections for hilar cholangiocarcinoma[J].Eur Rev Med Pharmacol Sci,2010,14(4):368-370.
[4] Paik K Y,Choi D W,Chung J C ,et al.Improved survival following right trisectionectomy with caudate lobectomy without operative mortality:surgical treatment for hilar cholangiocarcinoma[J].J Gastrointest Surg,2008,12(7):1268-1274.
[5] Dindo D,Demartines N,Clavien P A,et al.Classification of surgical complications:a new proposal with evaluation in a cohort of 6336 patients and results of a survey[J].Ann Surg,2004,240(2):205-213.
[6] Hasegawa S,Ikai I,Fujii H ,et al.Surgical resection of hilar cholangiocarcinoma:analysis of survival and postoperative complications[J].World J Surg,2007,31(6):1256-1263.
[7] Kawasaki S,Imamura H,Kobayashi A,et al.Results of surgical resection for patients with hilar bile duct cancer:application of extended hepatectomy after biliary drainage and hemihepatic portal vein embolization[J].Ann Surg,2003,238(1):84-92.
[8] Ito F,Cho C S,Rikkers L F,et al.Hilar cholangiocarcinoma:current management[J].Ann Surg,2009,250(2):210-218.
[9] Balkwill F,Mantovani A.Inflammation and cancer:back to Virchow?[J].Lancet,2001,357(9255):539-545.
[10] Chok K S,Ng K K,Poon R T,et al.Impact of postoperative complications on long-term outcome of curative resection for hepatocellular carcinoma[J].Br J Surg,2009,96(1):81-87
[11] Farid SG,Aldouri A,Morris-Stiff G,et al.Correlation between postoperative infective complications and longterm outcomes after hepatic resection for colorectal liver metastasis[J].Ann Surg,2010,251(1):91-100.
[12] Chauhan A,House M G,Pitt H A,et al.Post-operative morbidity results in decreased long-term survival after resection for hilar cholangiocarcinoma[J].HPB (Oxford),2011,13(2):139-147.
[13] Seyama Y,Masatoshi M. Current surgical treatment for bile duct cancer[J]. Word J Gastroenterol,2007,13(10):1505-1515.
[14] Hong Y K,Choi S B,Lee K H,et al.The efficacy of portal vein embolization prior to right extended hemihepatectomy for hilar cholangiocellular carcinoma:a retrospective cohort study[J].Eur J Surg Oncol,2011,37(3):237-244.
[15] Abdalla E K,Hicks M E,Vauthey J N ,et al.Portal vein embolization:rationale,technique and future prospects[J].Br J Surg,2001,88(2):165-175.
[16] Kokudo N,Tada K,Seki M ,et al.Proliferative activity of intrahepatic colorectal metastases after preoperative hemihepatic portal vein embolization[J].Hepatology,2001,34(2):267-272.
[17] 黄志强. 肝门部胆管癌外科治疗面临的问题与出路[J]. 中华实验外科杂志,2004,21 (7):773-775.
[18] Chen X P,Lau W Y,Huang Z Y,et al.Extent of liver resection for hilar cholangiocarcinoma[J].Br J Surg,2009,96(10):1167-1175.
[19] van Gulik T M,Ruys A T,Busch O R,et al.Extent of liver resection for hilar cholangiocarcinoma (klatskin tumor):how much is enough?[J].Dig Surg,2011,28(2):141-147.

