两种拟南芥MYB51突变体的鉴定与初步分析
李梦莎,石 璐,国 静
(东北林业大学盐碱地生物资源环境研究中心,东北油田盐碱植被恢复与重建教育部重点实验室,哈尔滨 150040)
芥子油苷又称硫代葡萄糖苷(Glucosinolate,GS),是一类含氮、含硫的植物次生代谢产物。芥子油苷及其降解产物具有多种生化活性,其在植物防御方面的作用已经引起人们的广泛关注。根据氨基酸来源的不同,芥子油苷通常分为脂肪族、芳香族和吲哚族三大类[1-5]。
对植物芥子油苷代谢调控的研究发现,多个R2R3-MYB家族转录因子成员对芥子油苷合成具有直接调控作用。ATR1/MYB34、HIG1/MYB51和HIG2/MYB122为吲哚族芥子油苷合成途径中的正向调控因子,其中,MYB34和MYB122调节吲哚族芥子油苷和吲哚乙酸(IAA)代谢之间的平衡[6-8],而MYB51(AT1G18570)特异地调控吲哚族芥子油苷合成及与其相关的初生代谢途径[9-11]。尽管MYB51在吲哚族芥子油苷合成调控中的作用已有报道,但对其介导的吲哚族芥子油苷环境调控机制了解的并不透彻。为深入分析MYB51在环境因子调控吲哚族芥子油苷合成过程中的作用,本研究组从拟南芥生物资源中心(Arabidopsis Biological Resource Center,ABRC,Ohio State University,USA)购 买AT1G18570的两种T-DNA插入突变体SALK_045103和SALK_059771,分别通过基因型分析筛选得到了纯合突变体。进一步利用半定量RT-PCR及高效液相色谱方法对其在转录水平及代谢水平进行了检测,结果显示,两种突变体中MYB51基因的表达水平与野生型相比显著下调,且受其调控的吲哚族芥子油苷含量与野生型相比也显著降低,表明由于T-DNA的插入,致使SALK_045103和SALK_059771纯合突变体中MYB51转录因子的功能显著降低,表明这两种纯合突变体均可作为功能缺失突变体用于分析MYB51的功能。该研究为进一步分析MYB51转录因子在环境因子调控拟南芥吲哚族芥子油苷合成过程中的作用奠定了材料基础。
1 材料与方法
1.1 植物材料及生长条件
野生型拟南芥(Arabidopsis thaliana)为Columbia-0(Col-0)型,AT1G18570的T-DNA插入突变株SALK_045103和SALK_059771的种子购自ABRC。种子经75%酒精消毒10 min后,用无菌水冲洗3~5次,并于4℃避光条件下处理3 d后逐粒播于盛有草炭土与蛭石混合物(体积比1∶2)的花盆中,在人工培养室中培养(温度19~23℃,人工光照8 L/16 D,光子通量密度约150 μmol·m-2·s-1,空气相对湿度50%~70%)。
1.2 基因组DNA的提取
总DNA的提取方法参照陈庆山等的方法进行[12]。当植株生长至6周时,从待检植株上剪取1片绿叶,用液氮处理并研磨成粉末,加入500 μL CTAB提取液;65℃水浴30 min后加入500 μL氯仿∶异戊醇(24∶1);离心,上清液中加入500 μL异丙醇,混匀,静置10 min;4℃离心,沉淀真空吸干后加入30 μL灭菌ddH2O(含RNase A),37℃处理30 min,-20℃保存备用。
1.3 纯合突变体的鉴定
参照李敏等的方法[13],以所提取植株的基因组DNA为模板,进行PCR扩增。PCR所用引物出自SIAGnAL(http://signal.salk.Edu/isectprimers.html),引物分别为LBb1.3:5'ATTTTGCCGATTTCGGAAC 3';SALK_045103-LP:5'AAAGGGGGTTGTTCTCAAGT G 3';SALK_045103-RP:5'CATGGAAACGTACCT TTGTGG 3';SALK_059771-LP:5'AAATTTTGGTC AAGAATCGGG 3';SALK_059771-RP:5'AAAGGG GGTTGTTCTCAAGTG 3'。
1.4 半定量RT-PCR
总RNA的提取参照谭丽丽等的方法进行[14]。使用DNAase(TaKaRa Inc.)对RNA中所含痕量基因组DNA进行消化。使用NanoDrop 1000型(Nano-Drop Technologies Inc.)分光光度计检测RNA纯度及浓度。按照Transcriptor First Strand cDNA synthesis kit(TaKaRa Inc.)试剂盒说明书合成cDNA第一链,去离子水稀释10倍作为半定量RT-PCR的模板。
按照TAIR数据库(Eurogentec,Seraing,Belgium)提供的基因序列,使用Primer 5.0软件设计MYB51基因的特异引物。引物序列分别为MYB51-LP:5'CTACAAGTGTTTCCGTTGACTCTGAA 3'和MYB51-RP:5'ACGAAATTATCGCAGTACATTAGA GGA 3';以ACTIN基因作为内参,其引物序列分别为:ACTIN-LP:5'ATTCAGATGCCCAGAAGTCT TGTTCC 3'和ACTIN-RP:5'ACCACCGATCCAGAC ACTGTACTTCC 3'。引物由上海生工有限公司合成。
半定量RT-PCR反应参照董晓丽等的方法[15]。扩增ACTIN的PCR反应程序为:94℃预变性3 min;94℃20 s,55℃30 s,72℃30 s,24个循环,每个样品做3个重复;MYB51基因的PCR反应程序为:94℃预变性3 min;94℃ 20 s,55℃ 30 s,72℃30 s,30个循环,每个样品做3个重复。扩增产物用1.0%琼脂糖凝胶电泳进行分析。
1.5 芥子油苷的提取及测定
芥子油苷提取及测定按照Pang等的方法[16]。
2 结果与分析
2.1 T-DNA插入纯合突变体的鉴定
根据 TAIR(http://www.arabidopsis.org/)提供的信息,SALK_045103为反向插入突变体,SALK_059771为正向插入突变体,T-DNA插入位点均为MYB51基因起始密码子上游1 000 bp的启动子内(见图1)。

图1 拟南芥MYB51基因结构及其突变体示意Fig.1 MYB51 gene structure and mutants sketch map of Arabidopsis thaliana
使用SIAGnAL(http://signal.salk.edu/tdnaprimers.2.html)提供的SALK_045103和SALK_059771突变体的前向引物SALK_045103-LP和SALK_059771-LP及反向引物SALK_045103-RP和SALK_059771-RP,以候选植株的基因组DNA为模板,进行PCR鉴定。若植株为野生型植株,因无T-DNA插入,用前向引物和反向引物可扩增出1 000 bp左右的特异DNA片段;若植株为纯合体,由于T-DNA的插入,前向引物和反向引物之间的片断长度远远超过当前PCR条件下的PCR扩增长度,无法扩增出DNA片段,而用T-DNA左边界引物LBb1.3与基因反向引物进行PCR扩增,则能扩增出约500 bp的DNA片段;若植株为杂合体,用基因前向引物和反向引物进行PCR扩增,能够扩增出约1 000 bp的DNA片段,同时,用T-DNA左边界引物与基因反向引物进行PCR扩增,也能够扩增出约500 bp的DNA片段。
图2所示为突变体SALK_045103的PCR鉴定结果。结果显示,3号植株用基因前向引物和反向引物扩增出约1 000 bp的DNA条带,而T-DNA左边界引物LBb1.3与基因反向引物未扩增出DNA带,这与野生型植株基因组DNA的PCR带型一致,表明3号植株中没有T-DNA插入。1、2、4、5号植株用T-DNA左边界引物LBb1.3与基因反向引物扩增出约500 bp的DNA条带,而基因前向引物和反向引物未扩增出DNA条带,表明1、2、4、5号植株为纯合突变体。筛选出的纯合突变体分别留种、繁种备用。
图3所示为突变体SALK_059771的PCR鉴定结果。结果表明,5号植株用基因前向引物和反向引物扩增出约1 000 bp的DNA条带,同时T-DNA左边界引物LBb1.3与基因反向引物扩增出500 bp的DNA条带,表明5号植株为杂合突变体。1、2、3、4号植株用T-DNA左边界引物LBb1.3与基因反向引物扩增出500 bp的DNA条带,而基因前向引物和反向引物未扩增出DNA条带,表明1、2、3、4号植株为纯合突变体。筛选出的纯合突变体分别留种、繁种备用。

图2 SALK_045103突变体PCR鉴定电泳检测Fig.2 Electrophoresis results of SALK_045103 mutants via PCR detection

图3 SALK_059771突变体PCR鉴定电泳检测Fig.3 Electrophoresis results of SALK_059771 mutants via PCR detection
2.2 纯合突变体中MYB51基因的表达
基因启动子中T-DNA插入往往会导致基因表达水平下调甚至不表达[17]。利用半定量RT-PCR技术对上述纯合突变体后代植株莲座叶中MYB51基因的表达量进行了分析。
如图4所示,两种突变体与野生型拟南芥植株中均检测到了MYB51基因的表达,但与野生型相比,两种突变体植株中MYB51基因表达水平显著降低,表明T-DNA的插入导致SALK_045103和SALK_059771纯合突变体中MYB51基因的表达量显著下调。

图4 MYB51基因表达的RT-PCR分析Fig.4 MYB51 gene expression by RT-PCR
2.3 突变体中芥子油苷的组成及含量
拟南芥SALK_045103和SALK_059771纯合突变体莲座叶中共检测出9种芥子油苷,其中脂肪族芥子油苷5种,包括3-甲基亚磺酰丙基芥子油苷(3-methylsulphinylp ropyl glucosinolate,3MSOP)、4-甲基亚磺酰丁基芥子油苷(4-methylsulphinyl-butyl glucosinolate,4MSOB)、5-甲基亚磺酰戊基芥子油苷(5-methylsulphinylpentyl glucosinolate,5MSOP)、6-甲基亚磺酰己基芥子油苷(6-methylsulphinylhexyl glucosinolate,6MSOH)和8-甲基亚磺酰辛基芥子油苷(8-methyl-sulphinyloctyl glucosinolate,8MSOO);吲哚族芥子油苷4种,包括:4-羟基吲哚基-3-甲基芥子油苷(4-ydroxyin-dol-3-ylmethyl glucosinolate,4OH-I3M)、吲哚基-3-甲基芥子油苷(Indol-3-ylmethyl glucosinolate,I3M)、4-甲氧吲哚基-3-甲基芥子油苷(4-methoxyindol-3-ylmethyl glucosinolate,4MT-I3M)和1-甲氧吲哚基-3-甲基芥子油苷(1-Methoxyindol-3-ylmethylglucosinolate,1MT-I3M),未检测到芳香族芥子油苷。这与野生型拟南芥莲座叶中芥子油苷组分一致。表明SALK_045103和SALK_059771纯合突变体莲座叶中芥子油苷的组成未发生变化。
对SALK_045103和SALK_059771纯合突变体莲座叶中芥子油苷的含量进行分析表明,两种突变体中总芥子油苷含量和脂肪族芥子油苷总量与野生型相比变化均不显著,而吲哚族芥子油苷总量与野生型相比显著降低,其中,SALK_059771纯合突变体莲座叶中吲哚族芥子油苷总量与SALK_045103纯合突变体相比降低幅度更大(见图5)。进一步对两种纯合突变体中四种吲哚族芥子油苷组分的含量进行了分析。表明,I3M、1MT-I3M和4MT-I3M三种组分含量均显著低于野生型中的含量。如图6所示,除4OHI3M以外,几种吲哚族芥子油苷的含量在突变体中都有明显的下降。表明SALK_045103和SALK_059771纯合突变体中由于MYB51基因的突变导致吲哚族芥子油苷的生物合成受到影响。

图5 拟南芥莲座叶中吲哚族芥子油苷总量Fig.5 Content of total indolic gluconsinolates in Arabidopsis thaliana rosette leaves
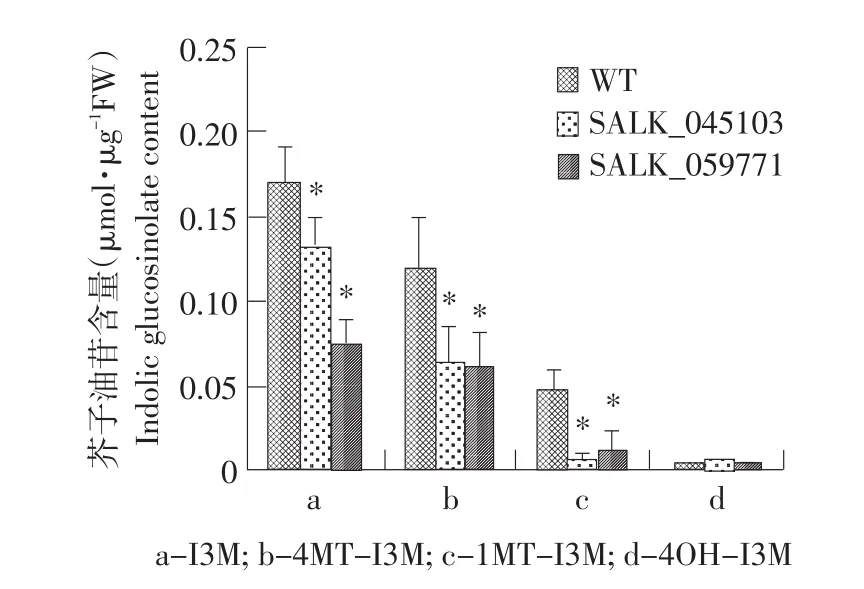
图6 拟南芥莲座叶中吲哚族芥子油苷各组分含量Fig.6 Content of indolic glucosinolates in Arabidopsis thaliana rosette leaves
3 讨论
拟南芥作为模式植物,被国内外学者广泛应用于各种基因功能的研究[18]。为深入研究MYB51转录因子介导的吲哚族芥子油苷环境调控机制,本研究鉴定获得了拟南芥MYB51的两种T-DNA插入纯合突变体SALK_045103和SALK_059771。通过半定量RT-PCR技术对两种突变体中MYB51基因的表达进行了初步分析,结果显示,尽管两种纯合突变体中MYB51基因的表达与野生型相比均显著降低,但T-DNA的插入并没有使MYB51基因表达量完全消失(见图4),这可能与T-DNA在MYB51基因启动子上的插入位置有关,两种突变体中TDNA均插入到MYB51基因起始密码子上游1 000 bp的启动子内(见图1),该位置可能位于MYB51核心启动子的上游,使这两种突变体中MYB51基因核心启动子完整存在,从而导致MYB51的泄露表达。这表明在这两种纯合突变体中,MYB51转录因子的功能可能并未完全缺失。由于MYB51为吲哚族芥子油苷生物合成的正向调控因子,其功能的缺失会导致吲哚族芥子油苷含量下降,因此,只有当SALK_045103和SALK_059771纯合突变体中吲哚族芥子油苷的含量显著低于野生型植株中的含量,才可用于后续基因功能分析。高效液相色谱分析结果显示,SALK_045103和SALK_059771纯合突变体中吲哚族芥子油苷的含量与野生型相比均显著下降,且SALK_059771纯合突变体中吲哚族芥子油苷总量的下降幅度大于SALK_045103纯合突变体(见图5),这与半定量RT-PCR的结果SALK_059771纯合突变体中MYB51基因表达量低于SALK_045103纯合突变体一致(见图4),进一步表明吲哚族芥子油苷含量的降低是由于MYB51的表达受T-DNA插入影响造成的。因此,SALK_045103和SALK_059771纯合突变体可作为MYB51的功能缺失突变体进行后续基因功能研究。
4 结论
本研究筛选获得了拟南芥MYB51的T-DNA纯合突变体SALK_045103和SALK_059771。半定量RT-PCR及高效液相色谱分析结果显示两种突变体中MYB51基因的表达显著下调且吲哚族芥子油苷的生物合成受到影响,暗示SALK_045103和SALK_059771可作为MYB51的功能缺失突变体进行后续基因功能研究。
[1]陈亚州,阎秀峰.芥子油苷在植物-生物环境关系中的作用[J].生态学报,2007,27(6):2584-2593.
[2]陈亚州,陈思学,阎秀峰.环境对植物芥子油苷代谢的影响[J].生态学报,2008,28(6):2828-2834.
[3]Yan X,Chen S.Regulation of plant glucosinolate metabolism[J].Planta,2007,226:1343-1352.
[4]Halkier B A,Gershenzon J.Biology and biochemistry of glucosinolates[J].Plant Biology,2006,57:303-333.
[5]Kliebenstein D J,Kroymann J,Mitchell-Olds T.The glucosinolatemyrosinase system in an ecological and evolutionary context[J].Plant Biology,2005(8):264-271.
[6]Smolen G,Bender J.Arabidopsis cytochrome P450 cyp83B1 mutations activate the tryptophan biosynthetic pathway[J].Genetics,2002,160:323-332.
[7]Celenza J L,Quiel J A,Smolen G A,et al.The Arabidopsis ATR1 Myb transcription factor controls indolic glucosinolate homeostasis[J].Plant Physiology,2005,137:253-262.
[8]李一蒙,陈亚州,阎秀峰.植物中的吲哚族芥子油苷与生长素代谢途径的关系[J].植物生理学通讯,2009,45(2):195-201.
[9]Gigolashvili T,Berger B,Mock H P,et al.The transcription factor HIG1/MYB51 regulates indolic glucosinolate biosynthesis in Arabidopsis thaliana[J].Plant Journal,2007,50:886-901.
[10]Malitsky S,Blum E,Less H,et al.The transcript and metabolite networks affected by the two clades of Arabidopsis glucosinolate biosynthesis regulators[J].Plant Physiology,2008,148:2021-2049.
[11]Bender J,Celenza J L.Indolic glucosinolates at the crossroads of tryptophan metabolism[J].Phytochemistry Reviews,8:25-37.
[12]陈庆山,刘春燕,吕东,等.大豆DNA提取基本原理的探讨[J].东北农业大学学报,2004,35(2):129-134.
[13]李敏,杨双,阮燕晔,等.拟南芥T-DNA插入突变体atsuc3的PCR鉴定[J].植物生理学通讯,2006,42(1):91-94.
[14]谭丽丽,燕正民,徐亚英,等.番茄叶片总RNA提取方法的比较[J].东北农业大学学报,2010,41(4):29-32.
[15]董晓丽,王加启,卜登攀,等.免疫刺激后小鼠肝脏内参基因稳定性研究[J].东北农业大学学报,2009,40(5):80-85.
[16]Pang Q,Chen S,Li L,et al.Characterization of glucosinolatemyrosinase system in developing salt stress Thellungiella halophila[J].Physiologia Plantarum,2009,136(1):1-9.
[17]周玉萍,陈琼华,林丽丽,等.拟南芥突变体lac8-2和lac8-3的鉴定[J].广州大学学报,2009,8(6):87-90.
[18]钟海秀,陈亚州,阎秀峰.植物芥子油苷代谢及其转移[J].生物技术通报,2007(3):44-48.

