烧结温度对LiNi0.8Co0.2O2电化学性能的影响
向小春,刘兴泉,刘宏基,王 超
(电子科技大学微电子与固体电子学院,电子薄膜与集成器件国家重点实验室,四川成都 610054)
与 LiCoO2[1]、LiMn2O4和三元正极材料相比,正极材料LiNi0.8Co0.2O2对烧结温度更为敏感。LiNiO2具有类似于LiCoO2的α-NaFeO2层状结构,虽然成本较低、能量密度较高,但稳定性略差,且合成困难[2]。LiNi0.8Co0.2O2是 LiCoO2和LiNiO2的固溶体,具有α-NaFeO2层状结构且兼具两者的优点,是LiCoO2的理想代替品。对LiNi0.8Co0.2O2的研究,主要集中于制备方法的改进和掺杂包覆改性[3-4],以提高容量和循环稳定性,对材料烧结工艺的研究鲜有报道,特别是在烧结温度对材料结构和电化学性能的影响方面。
本文作者采用共沉淀法合成LiNi0.8Co0.2O2,对烧结温度的影响进行了详细的考察研究。
1 实验
1.1 材料的制备
将NiSO4◦6H2O(成都产,AR)和 CoSO4◦7H2O(成都产,AR)配制成混合溶液,n(Ni)∶n(Co)=4∶1,以 1.0 mol/L NaOH(成都产,AR)为沉淀剂,氨水(成都产,AR)为络合剂,在50℃、pH值为11的条件下剧烈搅拌,采用并流共沉淀法,同时滴入反应容器中进行反应,反应完成后得到Ni、Co共沉淀物,经过静置陈化2 h,抽滤,再用50℃的去离子水洗涤至无SO42-(用0.1 mol/L BaCl2溶液检测,无浑浊)。将沉淀物在80℃下干燥6 h,研磨后,再用50℃的去离子水洗涤至无SO42-,并在105℃下二次干燥6 h,在玛瑙碾钵中研磨成D50约为8 μ m 的细粉,得到Ni0.8Co0.2(OH)2前驱体。按n(Ni+Co)∶n(Li)=1.00∶1.11,将前驱体与 LiOH◦H2O(天津产,AR)混合,以无水乙醇(成都产,AR)为分散剂,在QM-3SP2行星式球磨机(南京产)上以400 r/min的转速球磨(料球比 8∶1)5 h,在 80℃下干燥后,将得到的混合粉末置于敞口的管式电阻炉中,采用两段一步式方法烧结,即先在600~700℃下预烧9 h,再继续在700~760℃下烧结12 h,得到一系列的LiNi0.8Co0.2O2正极材料。升温速度在450℃前、后分别为5℃/min、2℃/min。
1.2 性能测试
将制得的 LiNi0.8Co0.2O2、导电剂乙炔黑(成都产,99.9%)和粘结剂聚四氟乙烯乳液(成都产,工业级)按质量比85∶10∶5混合成浆状,滚压在20 μ m 厚的铝箔集流体(成都产,99.5%)上,制成直径为10 mm的圆形正极片(约含5 mg活性物质)。正极片在120℃下真空(真空度约为133 Pa)干燥12 h后,在充满氩气的手套箱中,以金属锂片(四川产,99.5%)为负极,Celgard 2400膜(美国产)为隔膜,1 mol/L LiPF6/EC+DEC+DMC(体积比 1∶1∶1,韩国产,99.9%)为电解液,装配模拟扣式电池,尺寸为φ 10 mm×2.5 mm。
用Q-50型热重分析仪(美国产)对 Ni0.8Co0.2(OH)2前驱体与LiOH◦H2O的混合物进行TG-DTG分析,空气气氛,升温 速率为 20℃/min,温度 为 50~800 ℃。在 Pro M PDDY1291型粉末衍射仪(荷兰产)上进行X射线衍射分析,CuKα,λ=0.154 06 nm,管压40 kV、管流40 mA。在 DC-5型全自动电化学性能测试仪(上海产)上进行电化学性能测试,测试温度为室温 25℃,电流为0.2 C,电压为2.7~4.3 V。在CS350电化学工作站(武汉产)上进行循环伏安测试,电压为2.7~4.5 V,扫描速率为 0.1 mV/s。
2 结果与讨论
2.1 TG分析
Ni0.8Co0.2(OH)2前驱体与LiOH◦H2O混合物的TG曲线见图1。

图1 Ni0.8Co0.2(OH)2前驱体与LiOH◦H2O混合粉体的TG曲线Fig.1 TG curves of the mixture powders of LiOH◦H2O and Ni0.8Co0.2(OH)2precursor
从图1可知,在 50~200℃,混合物有一定的质量损失(3.43%),主要原因是常温放置下 Ni0.8Co0.2(OH)2与 LiOH◦H2O的吸附水的挥发;在200~350℃,TG曲线最陡峭,质量损失最大,达 12.35%,原因是Ni0.8Co0.2(OH)2前驱体的氧化分解失水;在350~600℃,LiOH熔融并与前驱体氧化物充分浸渍,混合物质量有微小的损失(0.22%),主要归结于LiOH的分解和Li2O的微量挥发;在600~700℃,TG曲线上出现了0.80%的失重,主要原因是LiOH的分解和生成LiNi0.8Co0.2O2;在 720℃以后,TG曲线变化小,属反应完成、结构完善的阶段,0.26%的质量损失归结于Li2O的挥发。
要得到结构完美、性能优异的LiNi0.8Co0.2O2正极材料,宜采用两段控温的烧结方式。在温度从350℃升至600℃的过程中,宜采用缓慢的升温速率,以便LiOH完全熔融并与前驱体充分浸渍,对反应阶段Li+的扩散有利。600℃以上属于LiNi0.8Co0.2O2的生成和结构完善的阶段,宜采用两段控温的方法,烧结合成LiNi0.8Co0.2O2正极材料。
2.2 第一段烧结温度的影响
根据TG分析得出的结果,在烧结环境、升温速率和烧结时间等条件不变的情况下,将600℃后的烧结温度分为两段区间:600~700℃为第一段,720~760℃为第二段。分别对这两个温度区间进行考察。在考察第一段温度区间时,第二段固定为720℃。
图2为不同第一段烧结温度烧结合成样品的XRD图。

图2 不同第一段烧结温度合成样品的XRD图Fig.2 XRD patterns of samples prepared at different first sintering temperature
从图2可知,所有样品的晶面衍射峰基本相同,且各特征峰与文献[5]报道的LiNi0.8Co0.2O2的图相符,没有杂相,衍射峰强而尖锐,表明合成的LiNi0.8Co0.2O2样品具有完整的α-NaFeO2层状六方结构。(003)与(104)峰的强度比I(003)/I(104)、晶胞参数比 c/a、(006)/(102)和(108)/(110)峰的分裂程度,是代表层状结构的重要指标[6]。c/a越大,越有利于Li+在层间的脱嵌;I(003)/I(104)越高,表明阳离子的混排程度越小,一般认为,该值大于1.2才不会出现Ni2+占据Li位、造成阳离子混排的情况[7]。由XRD数据计算可知,3种样品的 c/a较大,分别为4.942 9(600℃)、4.943 2(650℃)和4.940 4(700℃),I(003)/I(104)分别为 1.282(600℃)、1.328(650 ℃)和1.353(700 ℃),均大于1.2,说明材料的层状结构发育良好,没有明显的阳离子混排现象;I(003)/I(104)随着温度的升高而增大,说明升高烧结温度,有利于材料层状结构的形成及降低阳离子混排程度。当第一段烧结温度为 700℃时,I(003)/I(104)最大,为 1.353,说明在考察温度区间内,该温度下烧结出的样品具有最规整的层状结构,预示着具有良好的电化学性能。从图2可知,(006)/(102)峰和(108)/(110)峰的分裂明显,也表明层状结构完整。
不同第一段烧结温度合成样品的首次充放电曲线见图3。

图3 不同第一段烧结温度合成样品的首次充放电曲线Fig.3 Initial charge-discharge curves of samples prepared at different first sintering temperature
从图3可知:不同第一段烧结温度烧结所得样品的首次放电曲线均较光滑,在3.0~4.3 V处有明显放电的平台。当第一段烧结温度为650℃和700℃时,样品的首次放电比容量较高且有较好的放电平台,说明这两个温度下合成的样品,首次放电性能良好。
不同第一段烧结温度合成样品的循环性能见图4。

图4 不同第一段烧结温度合成样品的循环性能Fig.4 Cycle performance of samples prepared at different first sintering temperature
从图4可知,第一段烧结温度为600~700℃时,随着温度的升高,正极材料的首次放电比容量升高。当第一段烧结温度分别为600℃、650℃和 700℃时,LiNi0.8Co0.2O2样品的首次放电比容量分别为116.00 mAh/g、152.60 mAh/g和152.10 mAh/g。当第一段烧结温度为650℃和700℃时,首次放电比容量较高,表明这两个温度下合成的LiNi0.8Co0.2O2样品电化学性能较好。600℃、650℃下合成的样品,层状结构不稳定,循环性能明显较差。因此,合成层状结构稳定、性能良好的LiNi0.8Co0.2O2,最佳的第一段烧结温度为700℃,与第一段烧结温度烧结样品的XRD分析结果一致。
2.3 第二段烧结温度的影响
固定第一段烧结温度为700℃,在720~760℃内,再以10℃为温度间隔,考察第二段烧结温度对样品的影响。
图5为不同第二段烧结温度烧结合成样品的XRD图。

图5 不同第二段烧结温度合成样品的XRD图Fig.5 XRD patterns of samples prepared at different second sintering temperature
从图5可知,合成的样品都具有良好的α-NaFeO2层状结构,属于R3m空间群。由XRD数据计算可知,在第一段温度固定不变的条件下,在720~760℃烧结合成的样品,c/a分别为 4.943 2(720 ℃)、4.949 2(730 ℃)、4.943 6(740℃)、4.943 2(750℃)和4.938 0(760℃),I(003)/I(104)分别为1.353(720 ℃)、1.428(730 ℃)、1.621(740 ℃)、1.658(750℃)和1.637(760 ℃),均大于1.2,(006)和(102)峰、(108)和(110)峰尖锐且分裂明显。随着温度升高至750℃,(006)和(102)峰、(108)和(110)峰越来越尖锐,分裂越来越清晰,I(003)/I(104)越来越大,当温度升高到760℃时,c/a和I(003)/I(104)都降低,表明烧结温度的微小变化(10℃),对 LiNi0.8Co0.2O2结构的影响很大,适当提高烧结温度,有利于LiNi0.8Co0.2O2层状结构的发育和提高阳离子有序度,但不宜高于750℃。这除了与锂挥发有关外,还与高温下LiNiO2易向活性差的立方相结构转变有关。实验结果表明,在750℃下烧结出的样品层状结构最完美,预示着具有最好的电化学性能。
不同第二段烧结温度合成样品的首次充放电曲线如图6所示。

图6 不同第二段烧结温度合成样品的首次充放电曲线Fig.6 Initial charge-discharge curves of samples prepared at different second sintering temperature
从图6可知,所有样品的首次放电曲线均为平滑的曲线,有明显的放电平台,其中750℃和760℃烧结的样品,首次放电平台比其他样品更平坦,表明这两个温度烧结的样品具有较高的初始比容量。
不同第二段烧结温度合成样品的循环性能见图7。

图7 不同第二段烧结温度合成样品的循环性能Fig.7 Cycle performance of samples prepared at different second sintering temperature
从图 7可知,当第二段烧结温度为 720℃、730℃、740℃、750℃和760℃时,LiNi0.8Co0.2O2样品的首次放电比容量分别为 152.10 mAh/g、134.00 mAh/g、149.70 mAh/g、152.20 mAh/g和151.70 mAh/g。样品的首次放电比容量和第20次循环的容量保持率,均随着烧结温度升高呈先增大,后减小的趋势。当第二段烧结温度为750℃时,样品的首次放电比容量最高,为152.20 mAh/g,第20次循环的放电比容量为131.60 mAh/g,容量保持率达86.5%。烧结温度继续升高到760℃时,材料的循环性能有所降低,可能是温度过高导致Li的挥发严重,使阳离子出现混排,同时使LiNi0.8Co0.2O2向活性差的立方结构转变。这个结果与XRD分析的结果基本相符。第二段烧结温度的微小变化(10℃),对材料结构和电化学性能有很大的影响,因此,在合成LiNi0.8Co0.2O2的过程中,稳定的烧结温度十分重要。
综上所述,得出在其他条件不变情况下,制备结构完美、性能优异的LiNi0.8Co0.2O2的最佳两段式烧结温度条件:第一段烧结温度为700℃,第二段烧结温度为750℃。
将最佳烧结条件下合成的正极材料装配成模拟电池,在2次充放电后进行循环伏安测试,所得循环伏安曲线见图8。
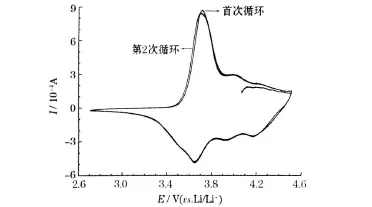
图8 最佳烧结温度条件下合成的LiNi0.8Co0.2O2样品的循环伏安曲线Fig.8 CV curves of LiNi0.8Co0.2O2samples prepared at the Optimum sintering temperature
从图8可知,首次和第2次的循环伏安曲线,均出现了尖锐、清晰的氧化还原峰,主要氧化还原峰的电位为3.71 V、3.65 V,与Ni3+/Ni4+的氧化还原反应相对应[8];两次循环伏安的曲线基本重合,峰电位相当接近。这说明该条件下烧结出的样品具有良好的电化学可逆性和循环性能。此外,循环伏安曲线上还存在其他两对小峰。曲线上的一个峰对应于材料的一个相变过程,这两对峰分别对应于材料的相变M(属单斜相区)-H2(属六方相区)和H2-H3(属六方相区),这两种相变是导致LiNi0.8Co0.2O2结构不稳定、容量保持率降低的主要原因[9],Co取代LiNiO2中的Ni,抑制了充放电过程中的相变[10]。图8中,这两对峰很弱,说明合成的样品在充放电过程中的结构相变极小,具有良好的电化学可逆性。
3 结论
采用空气中两段控温的烧结方式,能够合成出综合电化学性能较佳的 LiNi0.8Co0.2O2样品。在所考察的温度范围内,得到了在其他条件(氧流量、升温速率、烧结保温时间等)不变时,制备性能优良的LiNi0.8Co0.2O2样品的最佳烧结条件:第一段烧结温度为700℃,第二段烧结温度为750℃。通过对考察的LiNi0.8Co0.2O2样品进行XRD分析和电化学性能测试,证实了LiNi0.8Co0.2O2样品的结构和性能对烧结温度表现出极强的敏感性。
[1]GUO Bing-kun(郭炳),XU Hui(徐徽),WANG Xian-you(王先友),et al.锂离子电池[M].Changsha(长沙):Central South University Press(中南大学出版社),2002.93.
[2]Fergus J W.Recent developments in cathode materials for lithium ion batteries[J].J Power Sources,2010,195(4):939-954.
[3]DU Ke(杜柯),WU Bin(伍斌),HU Guo-rong(胡国荣),et al.两步固相法制备正极材料LiNi0.8Co0.2O2[J].Battery Bimonthly(电池),2011,41(5):264-267.
[4]Chung Y M,Ryu S H,Ju J H,et al.A Surfactant-based method for carbon coating of LiNi0.8Co0.15Al0.05O2cathode in Li ion batteries[J].Bull Korean Chem Soc,2010,31(8):2 304-2 308.
[5]Gong Z L,Liu H S,Guo X J,et al.Effects of preparation methods of LiNi0.8Co0.2O2cathode materials on their morphology and electrochemical performance[J].J Power Sources,2004,136(1):139-144.
[6]Morales J,Vicente C P,Tirado J L.Cation distribution and chemical deintercalation of Li1-xNi1+xO2[J].Mater Res Bull,1990,25(5):623-630.
[7]Wang G X,Bewlay S,Yao J,et al.Multiple-ion-doped lithium nickel oxides as cathode materials for lithium-ion batteries[J].J Power Sources,2003,119(1):189-194.
[8]Tan K S,Reddy M V,Subba R G V,et al.Effect of AlPO4-coating on cathodic behaviour of Li(Ni0.8Co0.2)O2[J].J Power Sources,2005,141(1):129-142.
[9]LIU Xin-yan(刘欣艳),XIA Ding-guo(夏定国),ZHAO Yu-juan(赵煜娟).充放电过程中正极材料的结构变化[J].Battery Bimonthly(电池),2005,35(1):75-77.
[10]Levi E,Levi M D,Salitra G,et al.Electrochemical and in-situ XRD characterization of LiNiO2and LiCo0.2Ni0.8O2electrodes for rechargeable lithium cells[J].Solid State Ionics,1999,126(1-2):97-108.

