溶胶-凝胶法制备超级电容器用二氧化锰
王佳伟,陈白珍,陈 亚,范瑞娟
(中南大学冶金科学与工程学院,湖南长沙 410083)
过渡金属氧化物用作电极材料是超级电容器研究的热点之一,最初研究的金属氧化物电极材料主要是二氧化钌(RuO2)。J.P.Zheng等[1]在150℃下热处理制备前驱体,得到的RuO2◦H2O的比电容可达768 F/g。RuO2的成本太高,且污染环境,难以广泛应用。MnO2具有与RuO2类似的特点,且价格低廉、对环境友好,拥有多种氧化价态,尤其是纳米级MnO2,电化学性能良好[2]。S.C.Pang等[3]用KMnO4氧化高氯酸锰,合成 MnO2溶胶-凝胶(pH值约为 10.5),用浸沾和滴覆法制备MnO2电极,同时以电沉积法直接在基体上电镀MnO2。浸沾法所得材料的比电容可达698 F/g,而滴覆法和电沉积法所得材料的比电容只有浸沾法的2/3。闪星等[4]用KMnO4在碱性条件下氧化MnSO4,制得纳米 MnO2,组装的混合电容器在工作电压为0.85 V时,比电容为177.5 F/g。C.C.Hu等[5]将α-MnO2◦nH2O电沉积在石墨基体上,产物的比电容为265~320 F/g,结构的稳定性受电解液pH值的影响。Y.L.Hee等[6]对 KMnO4进行热分解,制得无定形 MnO2,在550℃时可获得最大比电容240 F/g,电解液pH值为 7时,电极最稳定,库仑效率最高。
本文作者以醋酸锰和柠檬酸为原料,用溶胶-凝胶法合成纳米MnO2,研究不同pH值和焙烧温度时制得的MnO2的结构与形貌。在水系电解液0.5 mol/L Na2SO4中,通过循环伏安和恒流充放电实验研究产物的电容特性。
1 实验
1.1 MnO2超级电容器材料的制备
按化学计量比将柠檬酸(广东产,AR)加到四水合乙酸锰[Mn(AC)2◦4H2O,天津产,AR]溶液中,搅拌溶解,形成均匀透明的溶液。用25%氨水(广东产,AR)调节混合溶液的pH值,分别为6.0、8.0和9.0。溶液由淡粉色转变为橙黄色后,放到水浴锅中,在80℃下加热成湿凝胶。将湿凝胶在干燥箱中、100℃下干燥,制成干凝胶。用玛瑙碾钵将干凝胶研磨成粉状,再放入电阻炉中,在300℃、350℃、400℃、450℃或500℃下焙烧10 h。将焙烧后的产物再次研磨,称取5 g,加入 50 ml 2 mol/L H2SO4(湖南产,AR)中酸化2 h。对酸化后的材料进行抽滤,并用去离子水反复洗涤,直至滤液呈中性。将滤渣放入干燥箱中,在100℃干燥后,再次研磨,最终得到产物MnO2材料。
1.2 材料的热分析和微观组成
用D/m550VB+18kW转靶X射线衍射仪(日本产)进行XRD分析,Cukα,管压 40 kV、管流 300 mA,扫描速度为8(°)/min,步宽为0.02°。用JSM-5600LV扫描电子显微镜(日本产)对样品的表面形貌进行观察。用SDT Q600 V7.0 Build 84型热分析仪进行热重/差热分析(TG/DTA),氩气保护,升温速率为10℃/min,温度为20~1 000℃。
1.3 MnO2电极的制备
用涂压法制备MnO2电极。将所得 MnO2、乙炔黑(上海产,AR)和聚偏氟乙烯(上海产,AR)按质量比70∶25∶5混匀,加入N-甲基-2-吡咯烷酮(湖南产,AR,约6 ml/g),搅拌至糊状,并均匀涂覆于尺寸为1 cm×1 cm的集流体泡沫镍(带极耳,长沙产,1.5±0.05 mm厚,面密度为 280±30 g/m2,≥95%)上。将涂好的极片放入干燥箱中,在100℃下干燥1 h,最后以20 MPa的压力,压至约0.1 mm厚。
1.4 电化学性能测试
在CHI66B电化学工作站(上海产)上进行循环伏安测试,采用三电极体系,三电极分别为:工作电极(MnO2电极)、辅助电极(Pt电极)和参比电极(Ag/AgCl电极),电解液为0.5 mol/L Na2SO4(广东产,AR)。电位为-0.2~0.4 V,扫描速率为5 mV/s。
在BTS-5 V/2 mA电池测试系统(深圳产)上进行恒流充放电测试,电流为66.5 mA/g,电压为 0~0.8 V。用自制电容器模具(内径为1.6 cm,高为2.1 cm)组装对称型电容器,第一层为MnO2电极,第二层为隔膜102中速滤纸(杭州产),第三层为MnO2电极,在隔膜上滴加一滴电解液。
用恒流充放电的数据计算电极活性物质的比电容Cm:

式(1)中:i为放电电流;t为一个放电周期的持续时间;m为活性物质质量;ΔU为放电电压降低平均值。实际计算时,ΔU用放电起始电压和终止电压之差来代替。
硬水(Hard Water)是指含有较多可溶性钙、镁化合物的水,与之相对应的软水(Soft Water)则是指不含或含较少可溶性钙、镁化合物的水。硬水与人们的生产、生活关系比较密切,现对其相关知识做一简单介绍。
2 结果与讨论
2.1 pH值的影响
选择干凝胶的焙烧温度为350℃,分析pH值对MnO2电化学性能的影响,筛选最优的pH值。
图1为pH值为6.0和8.0时制备的MnO2的XRD图。
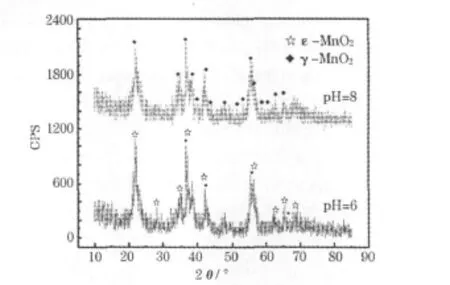
图1 pH值为6.0和8.0时制备的MnO2的XRD图Fig.1 XRD patterns of MnO2prepared at pH value of 6.0 and 8.0
从图1可知,不同pH值制备的MnO2的衍射峰有明显的差异。当 pH值为 8.0时,样品基本上都是直锰矿型MnO2,没有其他晶型的锰的化合物。当pH值为6.0时,制备的MnO2的衍射峰宽化且基底不平滑,存在Mn2O3的衍射峰,还有六方软锰矿型MnO2的衍射峰,说明纯度不高。
图2为不同pH值时制备的MnO2的SEM图。

图2 不同pH值时制备的MnO2的SEM图Fig.2 SEM photographs of MnO2prepared at different pH value
从图 2可知,当pH值为 8.0时,制备的MnO2颗粒表面形貌为纤维丝状,团聚较少,结构较疏散,能提供更多的电化学反应活性点,材料的利用率高;颗粒内部孔洞较大,为电解液迅速进入提供了重要的通道,有利于电子传输和离子扩散。当pH值为9.0时,颗粒分布不均匀,结构密实,局部团聚较严重。当pH值为6.0时,形貌为纤维丝状,与pH值为8.0时相比,出现软团聚,二次颗粒尺寸增大,使得结构密实,降低了活性物质利用率,不利于电子传输和离子扩散。
不同pH值时制备的MnO2的循环伏安曲线见图3。

图3 不同pH值时制备的MnO2的循环伏安曲线Fig.3 CV curves of MnO2prepared at different pH value
从图3可知,除了pH值为6.0时制备的 MnO2外,其他材料的曲线对称性都较好,也没有明显的氧化还原峰,说明电极以恒定的速率充放电时,电极和电解液之间的电荷交换速率是恒定的,电极具有良好的可逆性,电容性较佳。随着pH值的增加,曲线的面积增大,电容也会随之增加;但当pH值超过8.0时,曲线面积减小,电极的电容相应减小。pH值为8.0时,曲线的面积最大,说明电容性最好。
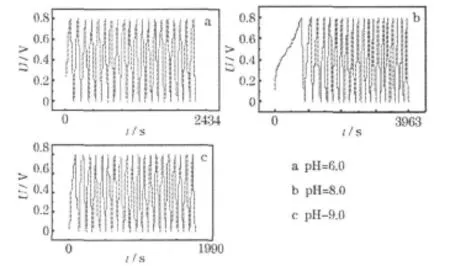
图4 不同pH值时制备的MnO2的恒流充放电曲线Fig.4 Galvanostatic charge-discharge curves of M nO2prepared at different pH value
从图4可知,在pH值为8.0时制备的MnO2,充、放电时间较长,说明该材料拥有最大的比电容(计算可知,比电容为169.05 F/g)。这与循环伏安测试的结果一致。
在不同pH值时制备的MnO2,恒流充放电曲线都有较好的线性特征(电压与时间呈线性关系),但首次循环的充电时间都比较长,造成首次循环不对称,原因可能是在充电开始时,阴、阳极离子的迁移速度不同[7]。在经历首次循环后,各电容器的充放电曲线都有较好的线性特征,充电曲线和放电曲线对称性较好,说明在不同的pH值下制备的材料都有较好的电容性能,但经过多次充放电后,容量会有所降低,可能是因为电容器本身有一定的电阻,会消耗部分能量。
2.2 焙烧温度的影响
选择pH值为8.0时得到的干凝胶焙烧制备MnO2。为了初步确定焙烧的温度范围,首先对该干凝胶进行TG/DTA分析,结果见图5。

图5 pH值为8.0时得到的干凝胶的TG/DTA曲线Fig.5 TG/DTA curves of the dry-gel prepared at pH=8
从图5可知,当焙烧温度上升到约300℃后,反应基本结束,质量不变,热量变化趋于稳定,说明当温度为300℃时,焙烧反应已发生完全,反应的程度不会影响焙烧产物,因此,选择焙烧温度为300℃、350℃、400℃、450℃和 500℃进行研究。
图6为焙烧温度为350℃和500℃时制备的MnO2的XRD图。
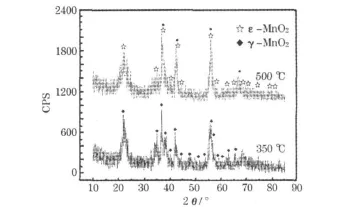
图6 焙烧温度为350℃和500℃时制备的MnO2的XRD图Fig.6 XRD patterns of MnO2prepared under the calcination temperature of 350℃and 500℃
从图6可知,两种样品的衍射峰宽化且基底不平滑,表明有一定的非晶结构。当焙烧温度为350℃时,有较明显的衍射峰,且晶型唯一,为直锰矿型,没有杂质;当焙烧温度为500℃时,也有较明显的衍射峰,但除了直锰矿型MnO2外,还有六方软锰矿型MnO2。
图7为焙烧温度为350℃和500℃时制备的MnO2的SEM图。

图7 焙烧温度为350℃和500℃时制备的MnO2的SEM图Fig.7 SEM photographs of MnO2prepared under the calcination temperature of 350℃and 500℃
不同焙烧温度时制备的MnO2的循环伏安曲线见图8。

图8 不同焙烧温度时制备的MnO2的循环伏安曲线Fig.8 CV curves of MnO2prepared under different calcination temperatures
从图8可知,当焙烧温度为350℃时,曲线的面积最大、对称性最好,说明比电容最大。当焙烧温度为500℃时,曲线的面积最小,说明制备的MnO2比电容最小。350℃时制备的MnO2的曲线面积最大,可定性说明电容性能最好。
不同焙烧温度时制备的MnO2的恒流充放电曲线见图9。
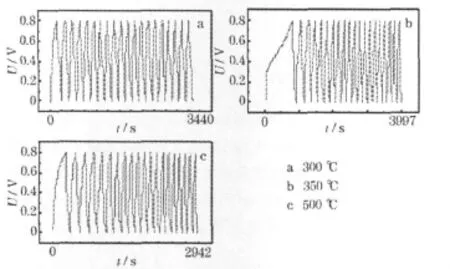
图9 不同焙烧温度时制备的MnO2的恒流充放电曲线Fig.9 Galvanostatic charge-discharge curves of M nO2prepared under different calcination temperatures
从图9可知,各曲线都有比较好的线性关系,但首次充放电时依旧有不对称性。这可能是因为在首次充电时,阴、阳离子的迁移速度不同。在循环多次后,电容会有所下降,可能是超级电容器本身有一定的内阻,消耗了部分电能,同时也有漏电的现象,失去部分电能。当焙烧温度为350℃时,制备的MnO2拥有较长的充放电时间,且曲线的对称性较好,比电容计算可知为169.05 F/g。当焙烧温度为 500℃时,充放电时间有所缩短,说明此时制备的MnO2的电容有所下降,计算可知为104.21 F/g。
3 结论
用溶胶-凝胶法制备MnO2,考察了pH值、干凝胶焙烧温度对制备的MnO2结构和性能的影响。
以在pH值为8.0、焙烧温度为350℃的条件下制备的MnO2为电极活性物质组装的电容器(电解液为0.5 mol/L Na2SO4),以66.5 mA/g的比电流在 0~0.8 V充放电,比电容可达169.05 F/g。循环伏安实验进一步证实,该条件下所制备的材料电容性最好。
[1]Zheng J P,Jow T R,Cygan P J,et al.Hydrous ruthenium oxide as an electrode material for electrochemical capacitors[J].J Electrochem Soc,1995,142(8):2 699-2 703.
[2]Nurmaimaiti(努尔买买提),XIA Xi(夏熙).纳米α-MnO2的制备及其性能研究[J].Journal of Inorganic Materials(无机材料学报),2000,15(5):802-806.
[3]Pang S C,Marc A A,Thomas W C.Novel electrode materials for thin-film ultrocapacitors:comparison of electrochemical properties of sol-gel-derived and electrodeposited manganese dioxide[J].J Electrochem Soc,2000,147(2):444-450.
[4]SHAN Xing(闪星),ZHANG Mi-ling(张密林),DONG Guo-jun(董国君),et al.纳米M nO2的制备及在超大电容器中的应用[J].Dianyuan Jishu(电源技术),2002,26(2):92-94.
[5]Hu C C,Tsou T W.Ideal capacitive behavior of hydrous manganese oxide prepared by anodic deposition[J].Electrchem Commun,2002,4(2):105-109.
[6]Hee Y L,Manivawnnan V,Goodenough J B.Electrochemical Capacitors with KCl Electrolyte[M].C.R.Acad.Sci.Paris 1999,2(SerieⅡ).565-577.
[7]LI Xue-liang(李学良).储电能源纳米材料的制备及性能研究[D].Hefei(合肥):Hefei University of Technology(合肥工业大学),2007.

