何首乌、骨碎补和淫羊藿的植物雌激素作用研究
杨利娟,黄君梅,王飞
雌激素是人体内一种重要的内源性物质, 在生殖、免疫、骨骼、心血管和中枢神经系统中发挥重要作用,在临床上广泛应用于预防和治疗绝经后骨质疏松症(postmenopausal osteoporosis,PMOP)。但是长期应用会导致乳腺癌和子宫内膜癌发病率上升等副作用[1]。因此,迫切需要寻求具有雌激素作用,但临床副作用更小,更为安全的药物。本研究在充分认识骨质疏松症发病机理的基础上,以中医“肾主骨”理论为指导,选取补肾中药何首乌Polygonum multiflorumThunb、骨碎补Drynaria fartunei(Kunze)J.Sm.和淫羊藿Epimedium brevicornu Maxim.为研究对象,拟分别评价何首乌、骨碎补和淫羊藿粗提物及其主要成分对雌激素受体ERα和ERβ的选择性激动作用,为其临床应用于骨质疏松作用机制研究提供理论依据。
1 材料与方法
1.1 药品
何首乌(70%乙醇提取)、骨碎补(50%乙醇提取)、淫羊藿(水提取)浸膏由河北以岭制药厂提供,大黄素、大黄酸、大黄酚、二苯乙烯苷、淫羊藿苷、柚皮苷(纯度99%以上)均购自中国药品生物制品检定所。药品用DMSO溶解备用。
1.2 试剂与仪器
DMEM高糖培养液、新生小牛血清、活性炭处理去内源激素新生小牛血清、10%青链霉素液、胰酶购自成都哈里生物有限公司。DMSO购自美国Amresco公司。OPTI-MEM®I培养液购自GIBCO。17 β-Estradiol (E2)购自Sigma公司。转染试剂Liprfectamine2000购自Invitrogen公司。XDS-1B型倒置相差显微镜(COIC);二氧化碳培养箱(美国Thermo);Varioskan F型全波长扫描式多功能读数仪(美国Thermo)。
1.3 细胞培养
宫颈癌细胞(HeLa细胞)培养于含10%新生小牛血清、1%双抗(青霉素,链霉素)的DMEM高糖培养基中,置于培养箱中孵育,每周传代一次。
1.4 质粒
pCIneo-hERα质粒、pIRES-hERβ质粒、pGL3-5×ERE-Luc报告质粒由本实验室自行构建,pSV-βgal内参质粒购自promega公司。
1.5 转染
用含10%活性炭处理去内源激素新生小牛血清无抗生素的DMEM培养液将HeLa细胞接种于24孔板中,待细胞密度达到70%~90%时,按Lipofectamin2000操作步骤把0.4 μg pCIneo-hERα质粒或pIRES-hERβ、0.2 μg pGL3-5×ERE-Luc报告质粒、0.2 μg pSV-β-gal共转染进HeLa细胞中,6 h后换成新鲜含10%活性炭处理去内源激素新生小牛血清无抗生素的DMEM培养液。24 h后对照组(DMSO)和不同浓度药物组加入相应的孔中诱导报告基因Luc的表达。24 h后弃去细胞培养液,用PBS洗三次,每孔加入细胞裂解液200 μL。充分裂解细胞后,于4000 g离心2 min,并将上清液转入干净EP管,混匀后取50 μL加入荧光素酶底物检测荧光素酶的活性,另取100 μL加入β-gal的反应底物ONPG(邻硝基苯-β-D-吡喃半乳糖苷),于37 ℃孵育反应30 min后,加入Na2CO3(1 mol.L-1)终止反应,各吸取200 μL加入96孔板中用酶标仪检测420 nm波长吸光度值;通过标准曲线计算β-gal的浓度对转染效率进行校正。
1.6 统计学方法
采用GraphPad Prism 5.0统计软件处理实验数据,所得数据以x±SD表示,多组比较采用单因素方差分析进行比较, P<0.05为差异有统计学意义。
2 结果
2.1 何首乌、骨碎补和淫羊藿粗提物对ERα 和 ERβ的选择性激动作用
为了排除何首乌、骨碎补和淫羊藿粗提物对ERE报告基因的影响,用不同浓度的中药粗提物处理瞬时转染pGL3-5×ERE-Luc 的HeLa细胞。结果显示,与对照组(DMSO处理)相比,不同浓度的中药粗提物对ERE报告基因的转录并无影响(见表1)。为了研究何首乌、骨碎补和淫羊藿粗提物对ERα 和 ERβ的选择性激动作用,将ERα或ERβ分别与pGL3-5×ERE-Luc共转染HeLa细胞后,加入不同浓度的中药提取物。结果显示,与对照组相比,各中药提取物均可诱导ERE报告基因转录激活,并且骨碎补(100 μg.mL-1)和淫羊藿(100 μg.mL-1)对过表达ERβ的HeLa细胞作用更明显,说明这两种中药提取物对ERβ的选择性更高。
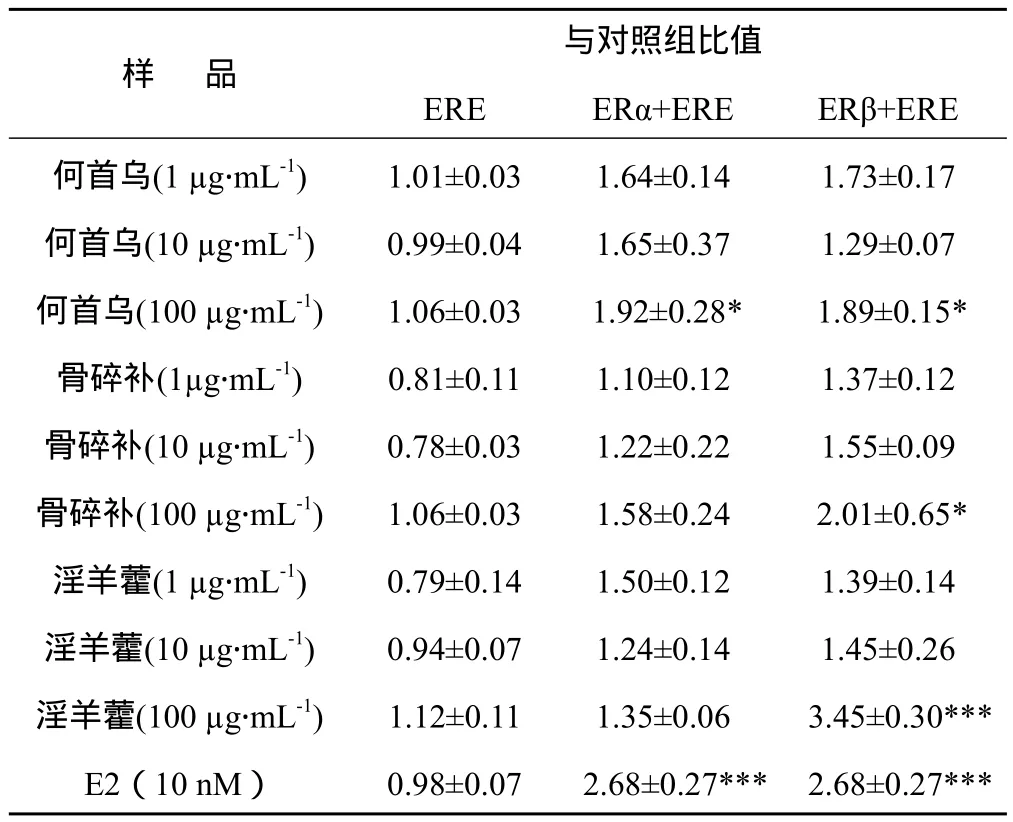
表1 三种中药粗提物对ERE报告基因的转录激活作用
2.2 几种中药中主要单体分对ERα和ERβ的选择性激动作用
为了排除何首乌、骨碎补和淫羊藿主要单体成分对ERE报告基因的影响,用不同浓度的单体化合物处理瞬时转染pGL3-5×ERE-Luc 的HeLa细胞。结果显示,与对照组(DMSO处理)相比,不同浓度的单体化合物对ERE报告基因的转录并无影响(见表2)。为了研究何首乌、骨碎补和淫羊藿主要单体成分对ERα 和 ERβ的选择性激动作用,将ERα或ERβ分别与pGL3-5×ERE-Luc共转染HeLa细胞后,加入不同浓度的单体化合物。结果如表2所示,与对照组比较,发现何首乌的主要成分大黄素、骨碎补的主要成分柚皮苷和淫羊藿的主要成分淫羊藿苷能显著诱导ERE报告基因转录激活,并且对过表达ERβ的HeLa细胞作用更明显。

表2 三种中药主要单体成分对ERE报告基因的转录激活作用
3 讨论
由于目前临床上治疗骨质疏松症主要应用的是化学合成药物,这些化学合成药物均存在一定的副作用,利用天然中草药及其制剂治疗该病已成为医药界研究的热点。在用于治疗骨质疏松的中药中,补肾中药淫羊藿、骨碎补和何首乌在临床上应用较广, 但其作用机制尚不明确。研究已经证实,雌激素在骨代谢平衡中起重要的调节作用,它可直接抑制造血干细胞和单核细胞产生刺激破骨细胞前增殖的细胞因子而且能直接抑制成熟破骨细胞分化, 促进破骨细胞的凋亡从而抑制骨吸收[11]。鉴于这些理论基础,我们研究何首乌、骨碎补和淫羊藿抗骨质疏松中药中的植物雌激素作用物质成分,从而为这三种中药临床应用于骨质疏松作用机制研究提供重要的理论依据。
雌激素的经典作用机制认为 ,雌激素首先与激素受体上的配体结合区(ligand binding domain,LBD)结合使得受体分子形成二聚体 ,从而使得ER的DNA结合区(DNA binding domain,DBD)与基因启动上的雌激素反应元件结合,启动基因转录。研究表明,ERα和ERβ与雌激素或选择性雌激素调节剂结合后,能激活不同基因的转录,这可能就是在成骨细胞和破骨细胞中,ERα和ERβ发挥不同作用来治疗骨质疏松症的原因[12]。Cvoro等人发现,ERβ受体的选择性激活作用能抑制乳腺癌细胞的增殖,这样选择性结合ERβ受体的植物雌激素更加有助于减少治疗骨质疏松的副作用[13]。
本研究中,首先在缺乏ER的HeLa细胞中分别加入何首乌、淫羊藿和骨碎补这三种中药的粗提物,结果表明这三种中药的粗提物对ERE报告基因并没有转录调节作用,而在过表达ERα或ERβ的HeLa细胞中,各中药提取物均可诱导ERE报告基因转录激活,说明何首乌、骨碎补和淫羊藿中具有植物雌激素作用的物质成分。为了进一步证实这三种中药中植物雌激素的主要物质成分是哪几种化合物,我们按照同样的方法分别考察了何首乌、骨碎补和淫羊藿中的主要活性物质,结果显示何首乌主要活性成分大黄素、骨碎补中的柚皮苷和淫羊藿中的淫羊藿苷均能显著产生植物雌激素作用。其中,淫羊藿苷对ERβ的作用更强,表明对ERβ的选择性可能是这些中药在临床上具有治疗骨质疏松作用,但是副作用较小的原因之一。对何首乌、骨碎补和淫羊藿治疗骨质疏松的作用机制上具有重要的参考价值。
[1] Scheibor MD, Rebar RW.Isof l avones and postmenopausabone health:A Viable Alternative to Estrogen Therapy?[J].Menopause,1999,6(3):233.
[2] 罗瑞芝,贾伟,赵利斌,等.何首乌研究进展[J].中草药,2005,36(7):7901.
[3] 朱铁英.何首乌化学成分研究进展[J].时珍国医国药,2006,17(2):172.
[4] 高颖,房德敏.骨碎补黄酮类化合物的研究进展与开发前景[J].中草药,2009,40(2):323.
[5] Matsuda H,Shimoda H,Morikawa T,et al.Phytoestrogen from the roots of polygonum cuspidatum( Polygonaceae):structure-Requirement of hydroxyanthraquinones for estrogenic activity[J].Bioorg Med Chem Lett ,2001 ,11 :1839.
[6] Usui T, Ikeda Y, Tagami T, et al.The phytochemical lindleyin.islolated from Rhei rhizoma , mediates hormonal effects through estrogen receptors[J].Endocrinol ,2002 ,175 :289.
[7] 史凤芹,于世凤,张润荃,等.大黄对破骨细胞性骨吸收作用的研究[J].现代口腔医学杂志,1995 ,9 :193.
[8] 邹丽宜,吴铁.何首乌防治骨质疏松症的研究进展[J].现代医药卫生,2011,27(22):3418.
[9] 于燕,颜虹,胡森科.淫羊藿提取物的雌激素样作用研究[J].西安交通大学学报(医学版),2009,30(3):373.
[10] Chang E J, Lee W J, Ch o S H, et al.Proliferative effects of fl avan-3-ols and propelargonidins from rhizomes of Drynaria fortunei on MCF -7 and osteoblastic cells [J].Arch Pharm Res, 2003, 26( 8) : 620.
[11] SudaT,UdagawaN,NakamuraI,et al.Modulation of osteoclast differentiation by local factors[J].Bone,1995 , 17 ( 2 Supp l):87S.
[12] Tee, M.K., Rogatsky, I., Tzagarakis-Foster, et al.Estradiol and selective estrogen receptor modulators differentially regulate target genes with estrogen receptors α and β[J].Molecular Biology of the Cell ,2004,15:1262.
[13] Cvoro, A., Paruthiyil, S., Jones, J.O., et al.Selective activation of estrogen receptor-β transcriptional pathways by an herbal extract[J].Endocrinology,2007,148: 538.

