壳寡糖对烟草赤星病病原菌的抑制作用
胡国元,胡 坚,李超影,杨春雷,袁 军,余 君,杨锦鹏
(1.武汉工程大学化工与制药学院,绿色化工过程教育部重点实验室,湖北省新型反应器与绿色化学工艺重点实验室,湖北 武汉 430074;2. 湖北省烟草科研所,湖北 武汉 430030)
0 引 言
烟草黑胫病、赤星病等真菌病害严重影响了烟草的产量和质量,采用化学农药控制烟草病害仍然很普遍.然而,化学农药的残留对生物和环境存在着潜在的威胁,而且它们的使用导致病原菌的抗性问题越来越严重.为此,开发化学农药替代品的研究日益引起人们的重视[1].
壳寡糖是由2~10个2-氨基葡萄糖通过β-1,4-糖苷键连接而成的一种寡糖[2].壳寡糖为壳聚糖的衍生物,壳聚糖及其衍生物属含氮高分子聚合物,在土壤中易被微生物分解,其终产物可被植物吸收[3].利用壳寡糖控制病原真菌的研究已有大量报道[1-7].应用壳寡糖抑制烟草真菌病原菌的报道较少.本研究旨在探索壳寡糖对烟草赤星病病原菌的抑制效果.通过测定不同浓度的壳寡糖对烟草赤星病病原菌的菌丝生长、孢子萌发、产孢的抑制作用及壳寡糖抑菌作用的热稳定性和pH值对壳寡糖抑菌作用的影响.
1 实验部分
1.1 材 料
1.1.1 壳寡糖 壳寡糖由大连中科格莱克生物科技有限公司提供,批号MP-91,聚合度为2~10,平均分子量≤1 000.
1.1.2 菌种来源 链格孢菌[Alternariaalternata(Fr.)Keissler] 由湖北省烟草科研所提供的赤星病病原菌.
1.1.3 培养基 马铃薯蔗糖琼脂(potato sucrose agar, PDA)培养基:马铃薯200 g,蔗糖20 g,蒸馏水1 000 mL,琼脂粉18 g,自然状态pH值.121 ℃下湿热灭菌20 min备用.
1.2 方法
1.2.1 抑制菌丝生长试验 称取一定量的壳寡糖粉末,用无菌水溶解后得到质量浓度为200 g/L的原液,吸取一定量的壳寡糖原液,注入到定量的PDA培养基中,使培养基中的壳寡糖质量浓度分别为10,12,15 g/L,对照组添加等量的无菌水.赤星病病原菌在PDA培养基上培养7 d后,用打孔器获得生长旺盛的菌饼(Φ7.6 mm),将菌饼接种到装有不同质量浓度壳寡糖PDA培养基的培养皿(Φ90 mm)中央,实验组与对照组各重复5个培养皿.28 ℃培养48 h后开始采用十字交叉法测量菌落直径取平均值记录,并计算菌丝生长抑制率[2,6-7].
菌丝生长抑制率=

1.2.2 孢子萌发试验 用无菌水将在马铃薯蔗糖琼脂培养基上培养7 d后赤星病病原菌的孢子洗脱下来并振荡摇匀,通过二倍稀释法使其在显微镜低倍镜(×40)视野中保持个数为100左右.所需的不同质量浓度壳寡糖溶液采用1.2.1中壳寡糖原液稀释获得.采用载玻片悬滴法,将孢子悬浮液10 μL滴在凹玻片上,实验组壳寡糖质量浓度分别为0.5,1,2.5,5,10 g/L.将不同浓度壳寡糖溶液取10 μL溶液滴加在孢子悬浮液中,对照组取等量的蒸馏水作同样处理.28 ℃培养5 h后观察孢子萌发情况,每组包含三个重复,并计算孢子萌发抑制率[3].
1.2.3 产孢量试验 用无菌水将在马铃薯蔗糖琼脂培养基上培养7 d后赤星病病原菌的孢子洗脱下来,通过二倍稀释法使10 μL的孢子悬液在显微镜低倍镜(×40)视野中保持个数为100左右,统计实验组与对照组每个培养皿中孢子总数,实验组壳寡糖质量浓度分别为5,10 g/L.计算产孢量的抑制率[7].
1.2.4 壳寡糖热稳定性试验 将配制好的壳寡糖原液(200 g/L)分别置于烘箱并调节温度为40,50,60,70,80 ℃中处理20 min[2],然后利用不同温度处理后的壳寡糖原液按方法1.2.1制备装有壳寡糖质量浓度为15 g/L的马铃薯蔗糖琼脂培养基的培养皿,之后操作方法同1.2.1.
1.2.5 壳寡糖pH值稳定性试验 吸取一定量配制好的壳寡糖原液并分别添加到四组试验组当中,在培养基固化前调节四组试验组pH值分别为4,5,6,7 .相应四组对照组加入等量的无菌水,并在培养基固化前调节其pH值为4,5,6,7之后操作方法同1.2.1,实验组壳寡糖溶液质量浓度为15 g/L[2].
2 结果与讨论
2.1 壳寡糖对菌丝生长的抑制作用
由图1,图2可以看出,随着壳寡糖质量浓度的提高,对赤星病病原菌菌丝的抑制作用也在提高.48 h壳寡糖质量浓度10 g/L时,对赤星病原菌菌丝的抑制率达到了89.36%.当壳寡糖质量浓度达到15 g/L时,对赤星病原菌菌丝的抑制率则达到了94.74%以上.随着培养时间的延长,壳寡糖对赤星病原菌菌丝的抑制率略有下降.
2.2 壳寡糖对孢子萌发的抑制作用
由表1可知,壳寡糖质量浓度为2.5 g/L 以上时对赤星病病原菌孢子萌发抑制率均在100%,即使质量浓度降低至0.5 g/L,其抑制率也可以达到95.36%.从壳寡糖对赤星病病原菌孢子萌发的抑制来看,所需的质量浓度远低于对菌丝生长抑制的质量浓度,其可能的原因是孢子萌发试验中孢子量少,每个孢子充分接触壳寡糖,降低了抑制萌发所需要的质量浓度.
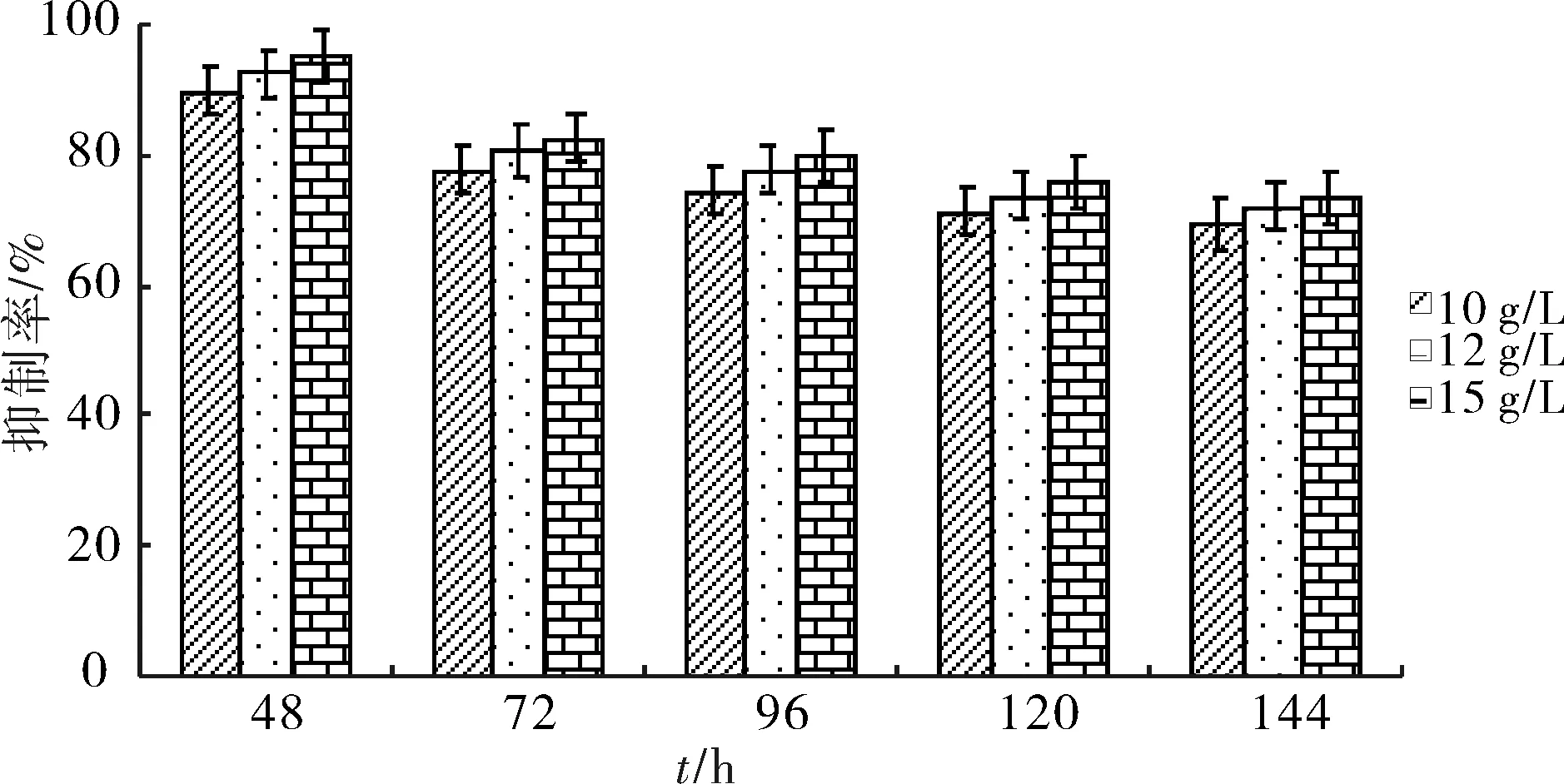
图1 不同质量浓度壳寡糖对赤星病病原菌菌丝生长的影响Fig.1 Effects of different concentrations of oligochi-tosan on mycelial growth of Alternaria alternata
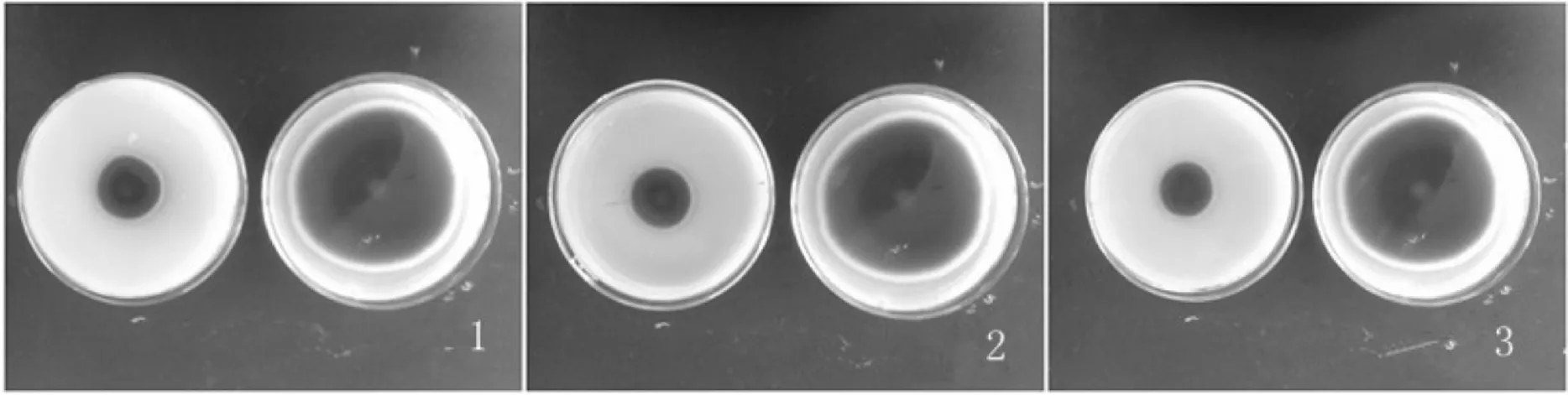
图2 不同浓度壳寡糖对赤星病病原菌菌丝生长的影响(144 h)Fig.2 Effects of different concentrations of oligochito-san on mycelial growth of Alternaria alternata in 144 h注: 1、2、3中壳寡糖浓度分别为10 g/L、12 g/L、15 g/L.1、2、3中左为试验组,右为对照组.
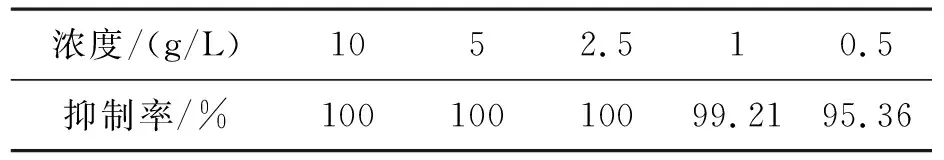
浓度/(g/L)1052.510.5抑制率/%10010010099.2195.36
2.3 壳寡糖对产孢量的抑制作用
如表2所示,质量浓度为5和10 g/L的壳寡糖溶液处理赤星病病原菌144 h产孢量的抑制率分别为53.1%和69.7%,低于对菌丝生长的抑制率.

表2 不同质量浓度壳寡糖对赤星病病原菌产孢量的影响Table 2 Effects of different concentrations of oligochito-san on spore production of Alternaria alternata
2.4 壳寡糖热稳定性
如图3,图4所示,在48 h,5组壳寡糖质量溶液对赤星病病原菌的抑制率分别为90.46%,89.19%,91.88%,92.39%,92.74%.在144 h,5组壳寡糖溶液对赤星病病原菌菌丝的抑制率分别为68.13%,68.05%,65.52%,69.02%,70.13%.比较各组抑制率的大小可以得出壳寡糖的抑菌作用具有良好的热稳定性.该结果与徐俊光(2007)[2]报道不同温度处理不同质量浓度壳寡糖质量溶液对其抑菌活性没有显著性影响的的结果一致.
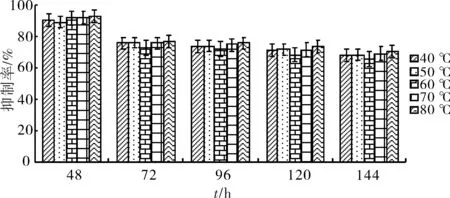
图3 不同温度处理后的壳寡糖对赤星病病原菌菌丝生长的影响Fig.3 Effects of different temperature of oligoc-hitosan on mycelial growth of Alternaria alternata
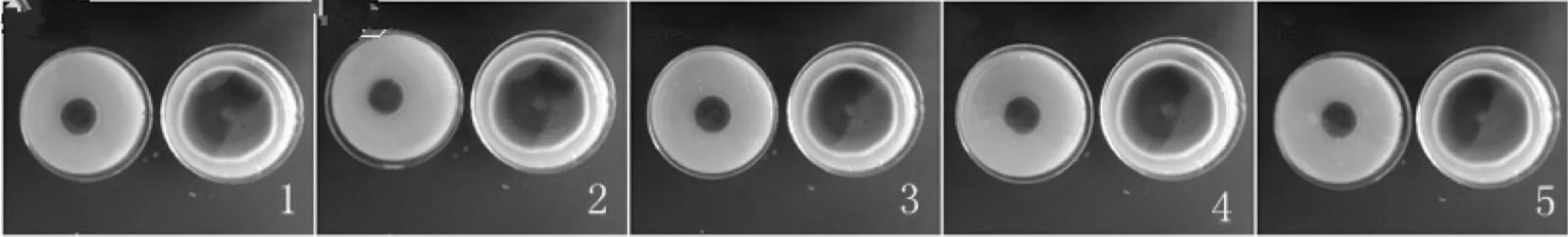
图4 不同温度处理后的壳寡糖对赤星病病原菌菌丝生长的影响(144h)Fig.4 Effects of different temperature of oligochito-san on mycelial growth of Alternaria alternate in 144 h注: 1、2、3、4、5中壳寡糖处理温度分别为40℃、50℃、60℃、70℃、80℃.1、2、3、4、5中左图为试验组,右图为对照组.
2.5 壳寡糖pH值稳定性
由图5,图6可知,pH值对壳寡糖溶液对烟草赤星病病原菌的抑菌率影响较大.在48 h,培养基pH值为4, 5, 6, 7的实验组对应的抑制率分别为100%,98%,85.05%,60.26%.在120 h,培养基pH值为4, 5, 6, 7的实验组对应的抑制率分别为100%,91.24%,68.78%,46.24%.然而,徐俊光(2007)[2]报道pH值对壳寡糖抑菌活性的影响因菌而异.这一结果暗示着壳寡糖对不同类别的菌可能存在不同的抑菌机理,并且说明在使用壳寡糖生物农药时要注意溶液酸碱性的影响.
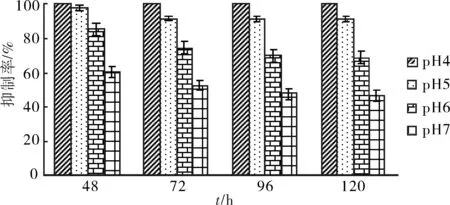
图5 不同pH值壳寡糖对烟草病原菌菌丝生长的影响Fig.5 Effects of different pH of oligochitosan on mycelial growth of Alternaria alternata
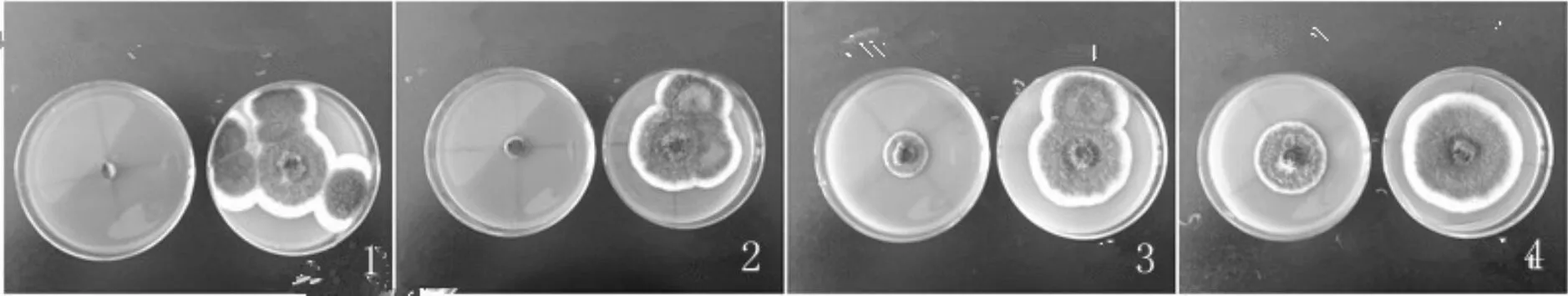
图6 不同pH值壳寡糖对烟草病原菌菌丝生长的影响(120 h)Fig.6 Effects of different pH of oligochitosan on mycelial growth of Alternaria alternata in 120 h注: 1、2、3、4中培养基pH值分别4、5、6、7. 1、2、3、4中左图为试验组,右图为对照组.
3 结 语
a. 壳寡糖对烟草赤星病病原菌具有较好的抑制作用.
b. 质量浓度为10 g/L的壳寡糖在48 h时,对烟草赤星病病原菌菌丝的抑制率达到了89.36%.当壳寡糖质量浓度达到15 g/L时,对赤星病原菌菌丝的抑制率则达到了94.74%以上.
c. 壳寡糖质量浓度为2.5 g/L 以上时对烟草赤星病病原菌孢子萌发抑制率均在100%,所需的壳寡糖质量浓度远低于对菌丝生长抑制的浓度.
d. 质量浓度为5和10 g/L的壳寡糖溶液在144 h时,对烟草赤星病病原菌产孢量的抑制率分别为53.1%和69.7%,低于对菌丝生长的抑制率.
e. 壳寡糖对烟草赤星病病原菌菌丝的抑制作用对于热处理具有良好的稳定性.
f. 质量浓度为15 g/L的壳寡糖PDA培养基pH值为4, 5, 6, 7在48 h时,对烟草赤星病病原菌菌丝的的抑制率分别为100%,98%,85.05%,60.26%,pH值对壳寡糖溶液的抑菌率影响较大.
参考文献:
[1] 沈奕.丁几寡糖对烟草黑胫病和赤星病的控制效应及其机制研究[D].合肥:安徽农业大学植物保护学院,2004.
[2] 徐俊光. 壳寡糖对植物病原真菌的抑菌活性及其机理的初步研究[D].大连:中国科学院大连化学物理研究所,2007.
[3] 张敏, 何熙璞, 彭好文, 等. 壳寡糖基聚合物对3种病原真菌抑菌作用研究木[J]. 中国果树, 2008(3): 35-37.
[4] MENG Xian Ghong, YANG Ling Yu, Kennedy John F, et al. Effects of chitosan and oligochitosan on growth of two fungal pathogens and physiological properties in pear fruit[J]. Carbohydrate Polymers, 2010, 81(1): 70-75.
[5] 杨玲玉.壳聚(寡)糖的抑菌规律及对果实采后病害防治作用研究[D].青岛:中国海洋大学海洋生物系,2009.
[6] 刘晓宇,刘志恒,吕淑霞.壳寡糖对植物病原真菌的抑制作用[J].安徽农业科学,2005,33(2):225,282.
[7] 卢金清,王琴,何冬黎,等.两种植物源农药对烟草赤星病的药效试验[J].湖北农业科学,2011,50(6): 1155-1157,1161.

