艾灸对D-半乳糖衰老小鼠学习记忆、大脑组织NOS/NO-cGMP信号系统及c-fosmRNA的影响
赵利华,韦良玉,陈煌,王进声,杨柯,黄燕
艾灸对D-半乳糖衰老小鼠学习记忆、大脑组织NOS/NO-cGMP信号系统及c-fosmRNA的影响
赵利华1,韦良玉1,陈煌1,王进声2,杨柯3,黄燕4
(1.广西中医学院第一附属医院针灸科,南宁 530023;2.广西中医学院病理教研室,南宁 530001;3.广西中医学院药学院,南宁 530001;4.广西中医学院基础医学院微生物与免疫学教研室,南宁 530001)
探讨艾灸疗法改善学习记忆的作用机制。将72只雄性小鼠随机分为生理组、模型组、艾灸1组、艾灸2组、电针组和尼莫地平组,每组12只。模型组及艾灸组连续42 d于小鼠颈背部皮下注射D-半乳糖,生理组注射等量生理盐水。造模第13天开始干预治疗,艾灸1组灸足三里、悬钟穴,艾灸2组灸关元、百会穴,隔天治疗1次,共治疗15次。采用水迷宫检测学习记忆,检测脑组织匀浆一氧化氮(NO)、一氧化氮合酶(NOS)、环磷酸鸟苷(cGMP)含量,原位杂交检测各组小鼠大脑皮层、海马CA3区c-fosmRNA的表达。模型组“潜伏期”较生理组、艾灸1组、艾灸2组、尼莫地平组延长(<0.01,<0.05),模型组“原象比”和“垮台次数”较其他各组缩短、降低(<0.01,<0.05)。模型组脑组织NO含量、总一氧化氮合酶(TNOS)、诱导型一氧化氮合酶(iNOS)活力较其他5组均显著升高(均<0.01),模型组脑组织cGMP含量较其他5组均显著降低(均<0.01)。模型组小鼠大脑皮质、海马CA3区c-fosmRNA表达的神经元密度较其他5组均降低(<0.01,<0.05)。艾灸疗法可能通过提高cNOS的活力,生成生理活性的NO,增加第二信使cGMP的含量,即通过NO-cGMP信号转导系统,促进大脑皮质、海马CA3区神经元细胞c-fosmRNA表达,维持长时程增强(LTP),改善学习记忆能力。
针灸疗法;灸法;学习记忆;D-半乳糖;一氧化氮合酶;环磷酸鸟苷;c-fosmRNA
NOS/NO-cGMP信号系统广泛存在于体内,NO做为鸟苷酸环化酶内源性活化因子,促进cGMP的合成[1];海马区的NO-cGMP可诱导与学习记忆有关的长时程增强效应(Long-term potetiation;LTP)[2];LTP的诱导也伴有c-fos基因表达增强,因此,人们认为c-fos基因的表达和蛋白质合成是LTP能够维持数星期乃至数月的物质基础,并将c-fos基因作为学习记忆功能的客观指标之一[3]。随着增龄脑内不同类型的NOS的改变,从而改变了体内NO的水平,进而导致细胞内cGMP水平下降[4]。学习记忆减退是脑衰老的重要表现。中医学认为脑为髓海,增龄等引起的脑衰老则为髓海失养。《灵枢·海论》:“髓海不足,则脑转耳鸣,胫酸眩冒,目无所见,懈怠安卧。”《医林改错》:“高年无记性者,脑髓渐空也。”艾灸百会和命门两穴,能起到补髓作用,促进老年学习记忆减退大鼠海马神经发生[5]。历代医家都重视艾灸的养生保健作用,本研究通过观察艾灸疗法对D-半乳糖衰老小鼠脑组织NOS/NO-cGMP信号系统及c-fosmRNA的影响,了解艾灸疗法改善学习记忆的作用机制,现报告如下。
1 材料与方法
1.1 动物分组
健康3月龄昆明雄性小鼠72只,体重为(30±2)g,由广西医科大学动物中心SPF实验室提供(SCXK桂2003-0003)。实验前,动物置于广西中医学院实验动物中心SPF级实验室(桂E动字第11004号)饲养5 d,适应环境,自由摄食和饮用纯净水,室温保持在(24±2)℃,相对湿度65%,12 h昼夜交替。用Morris水迷宫(Morris Water Maze Test,MWM)筛选游泳距离不低于2600 cm/2 min、体重不低于28 g的72只健康雄性小鼠。按随机区组设计分为生理组、造模组、艾灸1组、艾灸2组、电针组、尼莫地平组6组,每组12只。
1.2 试剂与仪器
D-半乳糖(国药集团化学试剂有限公司提供);NO硝酸还原酶法试剂盒(20081129,南京建成生物工程研究所提供);NOS化学比色法试剂盒(20081127,南京建成生物工程研究所提供)测TNOS、iNOS;超氧化物歧化酶(superoxide dismutase,SOD)测试盒(20081129,南京建成生物工程研究所提供)采用抽提法测分型SOD(Cu-Zn、总SOD);总蛋白定量测试盒(20081129,南京建成生物工程研究所提供)采用考马斯亮兰法;cGMP用放射免疫法检测,125I-cGMP试剂盒(上海中医药大学核医学实验室提供);c-fosmRNA试剂盒(武汉博士德公司提供)。HH-8数显恒温水浴锅(中国国华仪器厂提供);JY92-IID超声波细胞破碎机(中国宁波仪器厂提供);TGL-16M台式高速冷冻离心机(湖南赛特湘仪离心机仪器有限公司提供);LD4-1.8台式低速离心机离心机(北京京立离心机有限公司提供);721分光光度计(上海光学仪器厂提供);FJ-2008P型g放射免疫计数器(国营二六二厂提供)。
1.3 1 MWM行为测试实验
MWM实验的第2天至第6天,进行定位航行试验。平台位于第三象限,没于水下1 cm,小鼠入水点为各象限(分为1、2、3、4象限)池壁中点,每天分上、下午两个时间段,每时间段每鼠训练4次,且每鼠每次训练间隔时间不能低于1 min。训练期间迷宫外参照物(包括实验者)及环境保持不变,训练每天在上午9点至下午6点进行,训练时将小鼠面向池壁(背向平台)由4个入水点放入水池中,测其60 s内成功进驻平台(小鼠找到平台并滞留其上5 s为成功进驻)所需时间(即逃避潜伏期)。如在60 s内小鼠不能成功进驻平台,则实验者将其引上平台并令其停留10 s,记录逃避潜伏期为60 s。潜伏期能综合反映出小鼠的学习、记忆及运动行为能力,其值越小,说明小鼠学习、记忆能力越强。
实验第7天,进行空间探索实验。撤除平台,从1象限(原平台象限对侧)池壁中点将小鼠放入水中,电脑记录2 min内小鼠在原平台象限的游泳时间和游泳轨迹。原平台象比(简称“原象比”)越大,跨越平台次数(简称“跨台次数”)越多,说明小鼠学习、记忆及行为能力越强。
定位航行试验指标和空间探索实验指标可综合反映出小鼠在平台撤除后所发生的探索反应,从而综合评判小鼠的学习、记忆及行为能力。
1.4 造模方法
参照文献[6]用D-半乳糖颈背部皮下注射。将D-半乳糖试剂与生理盐水按1.2(g):100(mL)混匀为(12 mg/mL),造模组及各干预治疗组以D-半乳糖120 mg/kg/d颈背部皮下注射,连续42 d,同时对生理组颈背部皮下注射等量的生理盐水42 d。
1.5 治疗方法
造模第13天开始治疗,艾灸1组和艾灸2组进行艾炷灸,时间选择上午9:00-11:30,艾灸1组灸足三里、悬钟穴,艾灸2组灸关元、百会穴,灸后用棉签轻轻按压穴位,每次每穴3壮。定位取穴按照《实验动物针灸手册》[7],穴位选定后剪毛,施灸时涂凡士林以保护小鼠皮肤且便于固定艾炷,艾炷做得紧而结实(底座直径2 mm,高度5 mm,重量13~15 mg),用线香点燃,每壮时间为18~20 s,当小鼠挣扎时更换艾炷。电针组将输出电流正极接足三里穴,负极接悬钟穴,用20 Hz连续波,电流0.24~0.30 mA,以小鼠肢体轻微抖动、不嘶叫为度,每次3 min。尼莫地平组采用尼莫地平(山西亚宝药业集团股份有限公司)灌胃,剂量按体表面积等效折算计算法,予以每天每公斤12 mg灌胃。治疗方法均为隔天治疗1次,共治疗15次。生理组和造模组不做任何治疗性干预,但给予与治疗组同样时间、同等程度的捉抓。
1.6 样本采集和制备、检测
1.6.1 脑组织NO、NOS、cGMP检测
治疗结束,MWM再测试后,将各组小鼠断头处死,迅速取右侧大脑组织(在冰面上操作)称重,按g/v=1:9比例加入冰生理盐水进行匀浆,低温离心机2000转离心10 min。提取上清液,样本置-20℃保存,待测。另取左侧大脑组织50 mg,放入盛有2 mL冷的50 mMpH4.75醋酸缓冲液的试管内(冰浴),匀浆,加入2 mL无水乙醇,混匀,静止5 min,3500转离心15 min,将上清液收集在青霉素小瓶内,再用75%乙醇2 mL冲洗沉淀,匀浆分散,混匀,3500转离心15 min,合并上清,60℃烘箱烘干,残渣放置于4℃保存,测量时用1 mL醋酸缓冲溶解,然后取0.1 mL测量大脑组织cGMP含量。按试剂盒说明书要求测各项指标。
1.6.2 c-fosmRNA原位杂交检测
原位杂交试剂盒采用特异性针对c-fos的寡核苷酸探针,经地高辛标记。针对小鼠c-fos靶基因的mRNA序列为,(1)5’-TCCTT CTCCA GCATC GGCTC GCCTG TCAAC-3’(2)5’—CTTCT ATGCA GCAGA CTGGG AGCCT CTGCA-3’(3)5’—CTTAC ACGTC TTCCT TCGTC TTCAC CTACC-3’。原位杂交实验步骤严格按照试剂盒说明书操作进行。阴性对照,除不加探针杂交液外,其余步骤相同。原位杂交阳性信号以细胞核中有棕黄色颗粒者为阳性的神经元,采用Matic Images Advanced 3.2病理图文分析系统,在高倍(10×40)显微镜视野下于每张病理切片皮层部位、海马CA3区,分别选取不相重叠连续的10、6个视野,计数完整阳性神经元细胞数,其与视域参考面积(3292.76、1975.66mm2)的比值(单位面积神经元数)即是阳性神经元表达密度。
1.7 统计学方法
各组定位航行实验指标用SPSS13.0进行重复测量的数据分析,各组空间探索试验,脑组织NO、NOS、cGMP检测,c-fosmRNA的表达指标进行多个样本均数的方差分析以及均数间两两比较(SNK-q检验和LSD 法),以<0.05表示差异具有统计学意义。
2 结果
生理组和艾灸2组治疗后各死亡2只,艾灸1组和尼莫地平组各死亡1只。
2.1 各组治疗前后水迷宫各项指标比较
由表1可见,各组造模前定位航行、空间探索指标比较,差异均无统计学意义(>0.05)。治疗后,模型组潜伏期较其他5组延长(均<0.01),模型组原象比及垮台次数较其他5组缩短、降低(<0.01,<0.05)。生理组治疗后潜伏期与艾灸2组、电针组、尼莫地平组比较,差异均具有统计学意义(<0.01,<0.05)。
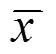
表1 各组治疗前后水迷宫各项指标比较 (±s)
注:与模型组比较1)<0.01,2)<0.05;与生理组比较3)<0.01,4)<0.05
2.2 各组治疗后大脑组织NO含量及NOS分型活力比较
由表2可见,模型组治疗后脑组织NO含量、TNOS及iNOS活力较其他5组显著升高(均<0.01)。其他5组脑组织NO含量、TNOS、iNOS活力比较,差异均无统计学意义(>0.05)。
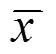
表2 各组治疗后大脑组织NO含量及NOS分型活力比较 (±s)
注:与模型组比较1)<0.01
2.3 各组治疗后cGMP含量及大脑皮质、海马CA3区c-fosmRNA表达比较
由表3可见,模型组脑组织cGMP含量较其他5组显著降低(均<0.01),其他5组脑组织cGMP比较,差异均无统计学意义(>0.05)。模型组大脑皮质、海马CA3区c-fosmRNA阳性表达神经元密度较其他5组降低(<0.01,<0.05)。尼莫地平组海马CA3区c-fosmRNA阳性表达神经元密度与艾灸1组比较,差异具有统计学意义(<0.05)。
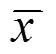
表3 各组治疗后cGMP含量及大脑皮质、海马CA3区c-fosmRNA表达比较 (±s)
注:与模型组比较1)<0.01,2)<0.05;与艾灸1组比较3)<0.05
3 讨论
NO是中枢神经系统(CNS)中一种重要的生物信使分子,在CNS中具有双重作用,过量的NO则会作为强氧化剂与超氧阴离子发生反应,对细胞产生毒性从而导致衰老的发生[4]。随着增龄各型NOS的表达会发生相应的变化,老年大鼠和认知损伤大鼠均表现为其海马和皮质nNOS活性降低而iNOS活性升高[8]。cNOS的生物效应以细胞间信息传递为主,NO-cGMP是重要的信息转导通路,而iNOS其生物效应以细胞毒为主,其合成的NO不依赖cGMP直接发挥作用[1]。
学习记忆的分子基础长时程增强(Long-term potetiation,LTP),是突触可塑性的一种形式,被认为与学习、记忆密切相关,是神经元学习和记忆机制的模式之一。人们对LTP的机制及其影响因素进行了大量研究,发现NO作为逆行信使参与了LTP[9],突触后NOS合成的NO,作为逆行信使,增加突触前膜生成第二信使cGMP含量,通过促进突触前谷氨酸(Glu)激活突触后的N-甲基-D-天门冬氨酸(NMDA)受体,Ca2+进入突触后膜与钙调素(CaM)一起激活NOS,又产生NO,从而形成NO-cGMP信号系统,诱导和维持LTP[10];cGMP作为新的信使分子,又可诱导c-fos、c-jun等即早基因的表达[11];国外学者Dragunow率先发现在清醒大鼠海马齿状回诱导LTP可导致即刻早期基因(Immediate early genes,IEGS)表达增高,IEGS再激活靶基因进而合成各种相应的蛋白质,对各种刺激起反应,这是突触重塑即学习记忆的基础,即海马-LTP-IEGs通路[12]。国内学者[13]认为学习记忆在细胞水平上的机制为长时程增强,它取决于神经细胞永久性功能改变,要求基因表达上的重新编程,c-fos基因正是作为这一过程中的第三信使来调节核内其他靶基因,从而影响学习记忆。
在我们以往的研究中已经证实,D-半乳糖衰老小鼠大脑组织中NO的含量与NOS的活力都有增高,与18月龄衰老小鼠相似[14],究竟是何种类型的NOS活力增加,生成NO,产生细胞毒性,或是否参与NO-cGMP信号系统转导途径呢?又如何进一步维持LPT?本研究观察发现,D-半乳糖致衰老小鼠大脑组织NO、总一氧化氮合酶(TNOS)的活力升高,主要与iNOS的升高有关。TNOS的活力是cNOS和iNOS活力的总和,实验结果分析可以得出模型组cNOS活力较其他5组降低。而生理组、艾灸1组、艾灸2组、电针组、尼莫地平组的大脑组织cGMP含量、大脑皮质和海马回的CA3的c-fosmRNA的表达神经元密度较模型组明显升高,学习记忆改善。提示艾灸、电针、尼莫地平可以减低D-半乳糖致衰老小鼠iNOS的活力,提高cNOS的活力,产生具有信使作用的NO,增加cGMP含量,形成逆行释放机制促进LTP,同时cGMP又作为第二信使增加了大脑皮质和海马回CA3的c-fosmRNA基因表达的神经元密度,c-fos基因作为第三信使构成了LTP能够维持数周乃至数月的物质基础,提高了D-半乳糖致衰老小鼠学习记忆能力。因此,艾灸疗法可能通过提高cNOS的活力,依赖Ca2+/CaM途径产生生理浓度NO,增加第二信使cGMP的含量,即通过NO-cGMP信号系统,诱导与维持LPT,又通过cGMP促进c-fosmRNA的表达,再进一步从神经元的基因和蛋白功能结构上维持LPT,改善学习记忆能力。
[1] 臧梦维,方芳,刘景生.NO-cGMP信号转导系统[J].基础医学与临床, 1996,16(6):408-419.
[2] 张镛.神经系统的NO/cGMP系统[J].国外医学·生理、病理科学与临床分册,1995,16(2):77-79.
[3] 杨毅飞,徐波,季浏,等.c-fos基因在运动训练增强学习记忆能力中的作用机制[J].体育科学,2005,25(10):75-78.
[4] 马厚勋,曾凡荣,曾昭淳.一氧化氮生物学作用及其与衰老的关系[J].国外医学·,老年医学分册,1999,20(4):167-172.
[5] 吴巧凤,尹海燕,曾芳,等.艾灸补髓促进老年学习记减退大鼠海马神经发生[J].中国老年学杂志,2008,28(21):2081-2082.
[6] 龚国清,徐本.小鼠衰老模型研究[J].中国药科大学学报,1991,22 (2):101-103.
[7] 胡元亮.实用动物针灸手册[M].北京:中国农业出版社,2003:379.
[8] Law AO, Donnell J, Gauthier S,. Neuronal and inducible nitric oxide synthase expressions and activities in the hippoxcampi and cortices of young adult,aged cognitively unimpaired, and impaired Long-Evans rats[J]. Neuroscience, 2002,l12(2):267-275.
[9] Garthwaite J. Neural nitric oxide signaling[J]. Trend Neur- osci,1997,18(2):51-52.
[10] 陈俊抛,林煜.痴呆治疗学[M].北京:人民军医出版社,2002:53.
[11] 李国君,吴德生.中枢神经系统中一氧化氮和一氧化氮合酶研究进展[J].国外医学·卫生学分册,1999,26(2):65-68,77.
[12] Dragunow M, Abraham WC, Gouiding M,. Long-term potention and the induction of c-fosmRNA and proteins in the dentate gyrus of unanesthetized rats[J]. Neurosci Lett, 1989,101(3):274-280.
[13] 王虹,舒斯云,包新民,等.学习记忆过程中即刻早期基因c-fos、c- jun在纹状体边缘区的表达[J].第一军医大学学报,2002,22(1):9 -12.
[14] 赵利华,文建军,杨柯,等.艾灸对D半乳糖致小鼠衰老模型抗衰老作用的研究[J].针刺研究,2008,33(4):255-257,261.
Effect of Moxibustion on Learning and Memory, and Cerebral NOS/NO-cGMP Signal Transduction System and Expression of C-fos mRNA in D-galactose-Induced Senile Mice
-1,-1,1,-2,3,4.
1.,,530023,; 2.,,530001,; 3.,530001,; 4.,,530001,
To explore the mechanism of improving action of moxibustion on learning and memory.Seventy-two male mice were randomly allocated to normal, model, moxibustion 1, moxibustion 2, electroacupunctue and Nimodipine groups, 12 mice each. The model and moxibustion groups of mice received nuchal subcutaneous injections of D-galactose for 42 consecutive days. The normal group was injected with an equal volume of normal saline. Treatment was given at 13 days after model making. In moxibustion 1 group, moxibustion was performed on points Zusanli and Xuanzhong and in moxibustion 2 group, on points Guangyuan and Baihui. Treatment was provided once every other day, for a total of 15 times. Learning and memory were assessed using a water maze. The nitric oxide (NO), nitric oxide synthase (NOS ) and cyclic guanosine monophosphate (cGMP) contents of brain homogenates were measured. The expression of c-fos mRNA in the cerebral cortex and hippocampal CA3 region was examined by in situ hybridization in each group of mice.The “latency” lengthened significantly in the model group compared with the normal, moxibustion 1, moxibustion 2 and Nimodipine groups (<0.01,<0.05). The targeted quadrant time and the spanning (original) platform frequency decreased in the model group compared with the other groups (<0.01,<0.05). Cerebral NO content, total nitric oxide synthase (TNOS) and induced nitric oxide synthase (iNOS) activities increased significantly in the model group compared with the other five groups (<0.01). Cerebral cGMP content decreased significantly in the model group compared with the other five groups (<0.01). The density of c-fos mRNA-expressing neurons in the cerebral cortex and hippocampal CA3 region decreased significantly in the model group of mice compared with the other five groups (<0.01,<0.05).Moxibustion can maintain long-term potentiation (LTP) and improve learning ability and memory through increasing cNOS activity to produce bioactive NO and raising second messenger cGMP content, that is, promoting the expression of neuronal c-fos mRNA in the cerebral cortex and hippocampal CA3 region by means of a NO-cGMP signal transduction system.
Acupuncture-moxibustion therapy; Moxibustion method; Learning and memory; D-galactose; Nitric oxide synthase; Cyclic guanosine monophosphate; C-fos mRNA
1005-0957(2012)03-0194-04
R2-03
A
10.3969/j.issn.1005-0957.2012.03.194
2011-08-01
广西自然科学基金(桂科自0832170)
赵利华(1967 - ),女,教授,博士,E-mail:zhaolh67@163.com

