胚胎透明带厚度及厚度变量与IVF-ET治疗结局关系探讨
鲁琳琳 白晓红 吕 睿
天津医科大学总医院生殖中心(300052)
胚胎发育到囊胚阶段能否从透明带中孵出是决定胚胎能否种植的先决条件,孵出困难可能是胚胎种植失败的原因之一[1]。Cohen等[2]发现有些胚胎的透明带均匀一致,而有些则厚薄不均,他建议将透明带厚度(ZPT)作为评价早期胚胎质量的参数。透明带厚度变量(ZPTV)最早由 Cohen提出,他将ZPTV定义为透明带厚度最大值与平均值的差值与透明带平均厚度的百分比[2]。有报道认为相对于ZPT,ZPTV与妊娠结局有更好的相关性[3]。本文观察分析在体外受精-胚胎移植(IVF-ET)周期中新鲜移植胚胎ZPT及ZPTV,以评价早期胚胎ZPT和ZPTV与治疗结局的关系。
1 对象与方法
1.1 研究对象
2011年3~4月天津医科大学总医院生殖中心对51对夫妇施行IVF-ET 51个周期,共移植119枚新鲜胚胎。其中IVF 28个周期,65枚胚胎;卵胞浆内单精子注射(ICSI)23个周期,54枚胚胎。女方年龄32.04±4.45岁;原发不孕32个周期,继发不孕19个周期。
1.2 研究方法
1.2.1 仪器及试剂 Saturn Active激光系统附带图像采集及测量软件(RI,英国);Forma CO2培养箱(Forma,美国);Olympus解剖镜及倒置显微镜(O-lympus,日本);Vitrolife胚胎体外培养系统(Vitrolife,瑞典)。
1.2.2 超排卵方案 采用促性腺激素释放激素激动剂(GnRH-a)/促性腺激素(Gn)/人绒毛膜促性腺激素(hCG)长方案或超长方案。长方案一般于前一月经周期的黄体中期使用GnRH-a,7~10d后行阴道B超检查并测血清卵泡刺激素(FSH)、黄体生成激素(LH)和雌二醇(E2)评价垂体降调情况,于促排卵周期第3~5d应用Gn,阴道B超监测卵泡发育,并测血E2、LH、孕酮(P)直至注射hCG日。hCG注射36h后取卵。对于多囊卵巢综合征、子宫内膜异位症患者,采用超长方案[4]。
1.2.3 实验室操作 取卵当日患者丈夫取精,精液常规分析并进行精子处理。常规IVF在取卵后将卵丘-放射冠-卵母细胞复合物培养4~6h后受精。ICSI操作按文献[5]进行。受精后16~18h观察卵子受精情况,观察到两个极体并见两个清楚原核表明正常受精。受精后培养至24~48h观察卵裂情况。
1.2.4 胚胎评分及胚胎移植 取卵后42~66h根据胚胎形态学参数对早期胚胎进行分级。Ⅰ级:卵裂球形状规则、大小均匀,胞质均匀清晰,无碎片或者碎片少于10%;Ⅱ级:胚胎卵裂球大小略不均,形状略不规则,碎片含量10% ~25%;Ⅲ级:卵裂球大小明显不均或形状明显不规则,碎片含量达25% ~50%;Ⅳ级:卵裂球大小严重不均,碎片超过50%;Ⅴ级:延迟受精或补救受精形成的胚胎。Ⅰ级和Ⅱ级胚胎为优质胚胎,从中选择2~3枚进行胚胎移植(本研究中有4个周期只形成1枚优质胚胎而移植1枚)。移植后予黄体支持,并于移植后2周查尿hCG和血β-hCG,阳性为生化妊娠。移植后4周B超检查,若见妊娠囊则诊断临床妊娠。
1.2.5 ZPT、ZPTV的测量 在倒置显微镜下利用激光系统附带测量软件对每个胚胎透明带厚度进行测量:取胚胎3、6、9、12四点处自透明带内侧测量至外侧,系统自动统计出 ZPTmin、ZPTmax及 ZPTmean。利用所测得数据计算ZPTV:ZPTV=[(ZPTmax-ZPTmean)/ZPTmean]× 100[2]。在比较妊娠结局时,分别计算出每个周期移植胚胎的平均ZPT值和ZPTV值。
1.3 统计学方法
采用SPSS17.0软件包对数据进行统计学分析。所有数据均经过正态性检验,正态资料两组间均数比较采用t检验;多组间均数比较采用ANOVA,F值有显著性则进一步行两两多重比较;若方差齐采用S-N-K法,方差不齐采用Dunnett's T3法;率的比较采用卡方检验。
2 结果
51个周期共移植119枚胚胎,平均每周期移植胚胎数2.33 ±0.68枚,周期妊娠率为45.10%。
2.1 常规IVF与ICSI周期ZPT、ZPTV的比较
ZPT和ZPTV值在IVF和ICSI组间差异无统计学意义。见表1。
2.2 ZPT、ZPTV与妊娠结局的关系
妊娠组与未妊娠组对象年龄及ZPT差异无统计学意义(P>0.05);妊娠组ZPTV值大于非妊娠组(P <0.001)。见表2。
表1 不同受精方式组胚胎ZPT、ZPTV比较(±s)

表1 不同受精方式组胚胎ZPT、ZPTV比较(±s)
两组比较P>0.05
组别 周期数 年龄(岁) ZPT(μm) ZPTV(%)IVF组28 32.37 ±4.39 17.20 ±2.58 15.27 ±7.59 ICSI组23 32.00 ±4.40 17.81 ±2.63 16.16 ±7.91
表2 妊娠与未妊娠组ZPT、ZPTV比较(±s)
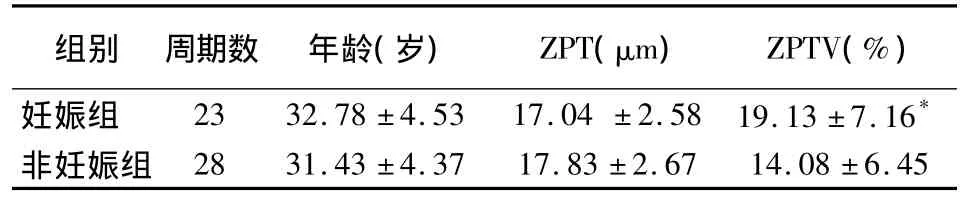
表2 妊娠与未妊娠组ZPT、ZPTV比较(±s)
*与未妊娠组比较P<0.001
组别 周期数 年龄(岁) ZPT(μm) ZPTV(%)妊娠组 23 32.78 ±4.53 17.04 ±2.58 19.13 ±7.16*非妊娠组28 31.43 ±4.37 17.83 ±2.67 14.08 ±6.45
2.3 ZPTV与妊娠结局的关系
根据ZPTV值大小分为两组,ZPTV≥20%组临床妊娠率为60.00%,ZPTV<20%组的临床妊娠率为38.89%,两组间差异有统计学意义(P<0.05)。
2.4 ZPT、ZPTV 与年龄的关系
不同年龄组ZPT值和ZPTV值差异无统计学意义(P >0.05)。见表3。
表3 不同年龄组ZPT、ZPTV值比较(±s)

表3 不同年龄组ZPT、ZPTV值比较(±s)
组别 周期数 ZPT(μm) ZPTV(%)<30岁18 17.30 ±2.96 15.80 ±7.26 30~35岁 15 17.38 ±3.02 15.74 ±8.57>35岁18 17.85 ±2.35 15.54 ±7.13
2.5 ZPT、ZPTV与FSH基础水平的关系
ZPTV随FSH值的升高而减小,差异有统计学意义。见表4。
表4 不同FSH水平组与ZPT、ZPTV值比较(±s)

表4 不同FSH水平组与ZPT、ZPTV值比较(±s)
*FSH<8mU/L比较P<0.05
组别 周期数 年龄(岁) ZPT(μm) ZPTV(%)FSH≥8U/L 11 32.66 ±4.80 17.93 ±2.88 14.51 ±4.90*FSH <8U/L 40 32.42 ±4.40 17.30 ±2.57 17.16 ±7.69
2.6 不同种植率组ZPT、ZPTV值比较
依据胚胎种植情况分为3组:第1组为非妊娠组(种植率为0);第 2组种植率为1/3、1/2、2/3(33.33% ~66.67%);第3组为全胚种植组(种植率为100%)。各组间ZPT差异无统计学意义(P>0.05),ZPTV第1组与其他两组比较差异有统计学意义(P<0.001),第2、3组间差异无统计学意义。见表5。
表5 不同种植率组ZPT和ZPTV值比较(±s)

表5 不同种植率组ZPT和ZPTV值比较(±s)
*与其他两组比较P<0.001
组别 周期数 年龄(岁) ZPT(μm) ZPTV(%)第1 组 28 31.43 ±4.37 17.83 ±2.67 14.08 ±6.45*第2 组 19 32.79 ±5.05 17.18 ±2.53 18.84 ±7.02第3组4 31.75 ±2.99 17.35 ±2.94 20.51 ±8.05
3 讨论
迄今为止,大多数实验室仍单纯以胚胎形态学参数评估胚胎种植潜力。但是通过这种方法选择的优质胚胎仍有可能因孵出困难而导致种植失败。Dokras等[6]观察体外培养中仅25%的胚胎可以孵出。Cohen等[2]发现IVF周期种植率下降与胚胎透明带增厚有关,后续研究证实透明带厚度不规则的胚胎其种植率高于透明带厚度均匀的胚胎[7]。
本研究显示,妊娠组移植胚胎的ZPTV值显著高于非妊娠组(P<0.001),且当ZPTV≥20%时妊娠率明显提高(P <0.005),这与 Palmstierna等[8]的研究结果相似。Cohen等[9]称透明带增厚会影响胚胎孵出及种植,但在本研究中并未发现妊娠组及非妊娠组间ZPT值有差异。综上笔者认为ZPTV对妊娠结局有更好的预测价值。本研究还依据胚胎种植情况进行分组比较,结果发现胚胎全部种植组与未全部种植组相比ZPTV有增大趋势,但未显示统计学意义,需增加数据量进一步研究。
文献[3]报道随着患者年龄增长,ZPT和ZPTV明显下降。但本研究并未发现这一明显差异。早些年文献及本研究发现随女性年龄增大透明带逐渐增厚,但近期有研究指出透明带随年龄增长变薄[3,10],这一现象是否存在普遍性以及其出现的原因和机制仍待进一步研究。
基础FSH水平是反应卵巢储备能力,预测IVF妊娠结局的重要指标之一。当基础FSH≥10U/L(免疫酶标法)时提示卵巢功能衰退。文献[11]报道,早卵泡期FSH水平与透明带厚度具有相关性,至今国内没有关于基础FSH与ZPT相关性的研究。本研究数据统计发现基础FSH≥8U/L时,ZPTV即表现出明显降低的趋势(P<0.05),而ZPT没有变化。Schoolcraft等[12]指出基础 FSH值偏高者 IVF治疗预后较差,故认为基础FSH增高引起ZPTV值减小可能是这些患者妊娠结局不良的原因之一。
近年来辅助孵化在辅助生殖中技术中广泛应用,尤其对于高龄者、重复着床失败以及冻融周期解冻胚胎。随着辅助孵化技术的发展,激光系统以其快速、准确、安全等特点应用越来越普遍,并且能够显著提高胚胎种植率和妊娠率[13]。相对于激光透明带打孔,激光透明带削薄不仅可以提高胚胎种植率和妊娠率,同时可减少胚胎损伤。激光透明带削薄是将胚胎1/4象限的透明带削薄50% ~80%,可以认为是人为地增加胚胎的ZPTV,胚胎更容易在透明带薄化处孵出,从而提高妊娠率。总之,在临床工作中可将ZPTV作为传统形态学胚胎分级的补充,用来筛选更有种植潜力的胚胎。在形态学评分的基础上选择ZPTV≥20%的胚胎,以提高种植率,改善妊娠结局。
1 Cohen J,Elsner C,Kort H,et al.Impairment process following in vitro fertilization in the human and improvement of implantation by assisting hatching using micromanipulation[J].Human Reproduction,1990,5(1):7-13.
2 Cohen J,Inge KL,Suzman M,et al.Videocinematography of fresh and cryopreserved embryos:a retrospective analysis of embryonic morphology and implantation[J].Fertil Steril,1989,51(5):820-827.
3 Gabrielsen A,Bhatnager PR,Petersen K,et al.Influence of zona pellucida thickness of human embryos on clinical pregnancy outcome following in vitro fertilization treatment[J].J Assist Reprod Genet,2000,17(6):323-328.
4 陈子江.人类生殖与辅助生殖[M].北京:科学出版社,2005:375.
5 庄广伦.现代辅助生育技术[M].北京:人民卫生出版社,2005:290-292.
6 Dokras A,Sargent IL,Ross C,et al.The human blastocyst:morphology and human chorionic gonadotrophin secretion in vitro[J].Human Reproduction,1991,6(8):1143-1151.
7
8 Palmstierna M,Murkes D,Csemiczky G,et al.Zona pellucida thickness variation and occurrence of visible mononucleated blastomers in preembryos are associated with a high pregnancy rate in IVF treatment[J].J Assist Reprod Genet,1998,15(2):70-75.
9 Cohen J,Alikani M,Trowbridge J,et al.Implantation enhancement by selective assisted hatching using zona drilling of human embryos with poor prognosis[J].Human Reproduction,1992,7(5):685-691.
10 孙莹璞、徐瑜,苏迎春,等.人胚胎透明带厚度及其变量与体外受精-胚胎移植妊娠结局的关系[J].生殖医学杂志,2004,12(6):349-353.
11 Shiloh H,Lahav-Baratz1 S,Koifman M,et al.The impact of cigarette smoking on zona pellucida thickness of oocytes and embryos prior to transfer into the uterine cavity[J].Human Reproduction,2004,19(1):157-159.
12 Schoolcraft WB,Schlenker T,Gee M,et al.Assisted hatching in the treatment of poor prognosis in vitro fertilization candidates[J].Fertil Steril,1994,62(3):551-554.
13 Blake DA,Forsberg AS,Jonhansson BR,et al.Laser zona pellucida thinning-an alternative approach to assisted hatching[J].Human Reproduction,2001,16(9):1959-1964.

