牛出血性肠炎A型产气荚膜梭菌的分离鉴定
孙连童,吴建勇,李建军,杨 魁,段新华,王治才
(1.新疆伊犁州动物卫生监督所,伊宁835000;2.新疆畜牧科学院兽医研究所,乌鲁木齐830000)
产气荚膜梭菌(Clostridium perfringens)又称魏氏梭菌,是一种广泛分布于水源、土壤等外环境和动物肠道中的重要微生物。它所产生的毒素种类较多,有研究报道仅外毒素就达18种[1,2]。该菌的致病性与毒素有关,传统分型方法是根据其产生的主要毒素α毒素(cpa)、β毒素(cpb)、ε毒素(etx)、ι毒素(itx),将其分为5个毒素型(A、B、C、D、E型)[3],不同毒素型致病性有一定差异。其中,A型菌是人畜气性坏疽和人食物中毒的主要病原[4]。自20世纪80年代以来,A型产气荚膜梭菌引起牛羊猝死症[5,6]、牛出血性皱胃炎等疾病的报道不断增多[7]。出血性皱胃炎通常表现为顽固性腹泻、出血性肠炎,最终导致家畜死亡。我们在新疆维吾尔自治区某牛场先后采集到疑似因出血性肠炎死亡的3头牛病料,分别采用常规微生物学方法和分子流行病学技术,对采集的病料进行了微生物分离培养和分子流行病学分析。
1 材料与方法
1.1 菌株 产气荚膜梭菌参考菌株C57-8(毒素A型)、C58-5(毒素B型)、C59-14(毒素C型)、C60-11(毒素D型)购自中国兽医菌种保藏中心。
1.2 试剂TaqDNA聚合酶、dNTPs、DNA Marker DL2000、基因组提取试剂盒等购自天根生化科技(北京)有限公司。
1.3 引物 多重PCR毒素分型引物(cpa-F、cpa-R、cpb-F、cpb-R、etx-F、etx-R)、16S rRNA基因扩增引物(63f,1387r)见表1。以上引物均由生工生物工程(上海)有限公司合成。

表1 多重PCR毒素分型引物及16SrRNA基因扩增引物Table 1 Primers used in this study
1.4 试验动物 18~20 g昆明系小鼠购自新疆医科大学医学实验动物中心。
1.5 病料来源和处理 所检病料均来自新疆伊犁地区某一牛场疑似因产气荚膜梭菌性肠炎死亡的3头牛,采样时间为2010年11月、2011年2月和5月。分别采集肝脏、脾脏和肠内容物进行病料涂片,染色镜检。将疑似产气荚膜梭菌病料接种厌气肝汤培养基,37℃厌氧培养过夜。培养物革兰氏染色阳性者,再转接绵羊血琼脂平板厌气培养16~18 h,挑取溶血的可疑单菌落再染色镜检。以菌落形态和染色细菌表型特征初步判定为产气荚膜梭菌,共分离获得8株疑似菌,分别编号为CPXJ23~CPXJ30。
1.6 菌株的毒力试验 挑取血平板上的单菌落,接种厌气肝汤培养基,37℃培养16~18 h后离心取上清。取小鼠6只随机分成2组,试验组腹腔注射培养菌液离心上清0.2 mL,对照组注射同一剂量的无菌PBS,24 h内观察小鼠死亡状况。
1.7 基因组的提取 采用细菌基因组DNA提取试剂盒提取基因组,-20℃冻存。
1.8 16S rRNA的分子鉴定与遗传进化分析 采用50 μL反应体系:10×PCR reaction buffer(含Mg2+)5 μL、dNTPs(10 mmol/L)2 μL、TaqDNA 聚合酶1 μL(2.5 U/μL)、引物(20 mmol/L)各 0.5 μL、基因组DNA 1 μL、灭菌ddH20 40 μL。反应程序:95℃预变性5 min, 95℃变性30 s,55℃退火30 s,72℃延伸90 s, 扩增30个循环;72℃ 延伸10 min。扩增产物经胶回收后委托上海生工生物工程技术服务有限公司进行测序。利用BLAST 在线搜索同源序列,利用DNAStar软件对从数据库获得的16S rRNA 基因序列进行同源性分析,运用MEGA5.0软件建立系统发育树。
1.9 多重PCR毒素分型 采用50 μL反应体系:10×PCR reaction buffer( 含 Mg2+)5 μL、dNTPs(10 mmol/L)2 μL、TaqDNA聚合酶1 μL(2.5 U/μL)、引物(20 mmol/L)各0.25 μL、基因组DNA 1 μL、灭菌ddH20 39 μL。反应程序:95℃预变性5 min;94℃变性1 min,55℃退火1 min,72℃延伸1 min,扩增30个循环;最后72℃延伸5 min。扩增产物用1.2%琼脂糖凝胶电泳进行检测。
2 结果
2.1 菌的分离与镜检 病料的厌氧肝汤培养物在鲜血平板培养过夜后,生长出灰白色、光滑、扁平、半透明、边缘整齐的菌落,菌落周围呈现双溶血环,内环为完全溶血,外环为不完全溶血,革兰氏染色可见两端钝圆、粗短阳性杆菌。
2.2 病原菌回归小鼠的毒力试验 试验组小鼠均在注射12 h内死亡,对照组小鼠72 h后均健活。所分离的8株产气荚膜梭菌的毒力试验结果一致。
2.3 16S rRNA基因序列测定及分子鉴定 用PCR方法分别扩增上述8株菌1325 bp的16S rRNA基因片段进行序列测定和分析,序列比对结果显示,8株分离株之间16S rRNA基因同源性为100%,与GenBank参比序列(见表2)同源性在99.8%以上(图1)。

表2 与CPXJ23~30分离株相关性较高的产气荚膜梭菌16S rRNA基因检索记录Table 2 16S rRNA gene of Clostridium perfringens related highly to CPXJ23~30 strains
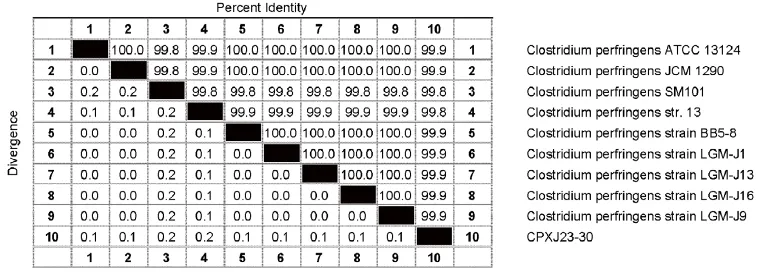
图1 产气荚膜梭菌16S rRNA序列的相似性和遗传偏离Fig.1 Identity and divergence of 16S rRNA genes in Clostridium perfringens strains
2.4 遗传进化分析 将参比菌株和分离株16S rRNA一同构建系统进化树,结果显示,本试验分离的8株A型产气荚膜梭菌均属于同一进化分支,而与国内报道的猪源菌株LGM-J16、LGM-J13、LGM-J9、LGM-J1不在同一进化分支,说明产气荚膜梭菌遗传进化存在一定宿主与来源差异(图2)。
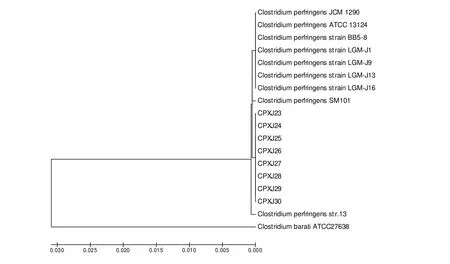
图2 产气荚膜梭菌16S rRNA的遗传进化分析Fig.2 Phylogenetic analysis of 16S rRNA of Clostridium perfringens
2.5 多重PCR分型结果 用cpa、cpb、etx基因特异性引物扩增参考菌株和实验室分离菌株的结果显示,cpa、cpb和etx扩增产物分别为402 bp、236 bp、541 bp,与理论计算一致(图2)。对照本次分离的8株产气荚膜梭菌分型检测结果,全部为毒素A型(见图3)。
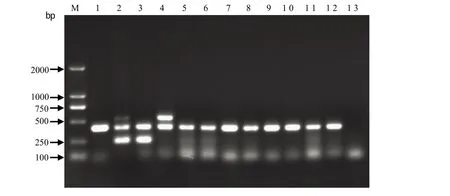
图3 产气荚膜梭菌多重PCR毒素分型电泳图Fig.3 Toxinotyping of Clostridium perfringens by multi-PCR method
3 讨论
近年来有关畜禽A型产气荚膜梭菌感染的的报道很多,一般认为,猪、鸡、兔以及一些经济动物的坏死性肠炎、下痢与该型菌株的感染有关。牛猝死症的研究也发现A型产气荚膜梭菌是其中的病原之一[10]。我们通过对所采集牛出血性肠炎病料分离菌株进行形态学、16S rRNA基因序列测定、毒型的基因检测,结果均证明所分菌株属于A型产气荚膜梭菌,表明所采病料牛场的牛出血性肠炎的发生与该型菌的感染有关。
16S rRNA是病原菌检测和鉴定的一种强有力工具,它相对分子质量适中,结构既保守性又具有高变性,可以实现对病原菌进行快速、微量、准确地分类鉴定;进化群内部序列差异较小,根据已知16S rRNA序列,产气荚膜梭菌种之间的16S rRNA同源性达到了99.8%以上,高度保守。本研究所有8株分离株16S rRNA基因序列完全一致,说明所分离菌株有一个共同来源;我们从牛分离的菌株与已报道的猪源性菌株不在同一进化分支,说明该菌的感染具有宿主的差异。遗传进化分析还显示,目前已知的产气荚膜梭菌16S rRNA基因从进化关系上,可以分为两个分支,我们从牛中获得的分离株属于大分支的一个独立亚类,这一发现丰富了该病的流行病学资料。
A型产气荚膜梭菌不仅是肠道常在菌,而且也是牛舍中的常在菌。有学者曾分别用ELISA、多重PCR方法对牛舍空气中分离的产气荚膜梭菌进行分型研究发现,A型菌的比例高达88%[11]。产气荚膜梭菌的感染主要是由于体内外不良因素如气温巨变、饲养管理方式或饲料种类变化、圈舍阴冷和空气污浊、应激等因素的影响下肠道菌群失调,引发感染的发生或流行。因此,该病的防治主要通过科学的程序化管理、良好的圈舍卫生与合理饲料搭配进行综合性预防。
[1]Songer J G. Clostridial enteric diseases of domestic animals[J]. Clin Microbiol Rev,1996, 9(2): 216-234.
[2]Keyburn A L, Boyce J D, Vaz P, et al. NetB, a new toxin that is associated with avian necrotic enteritis caused by Clostridium perfringens[J]. PLoS Pathog, 2008, 4(2): e26.
[3]Uzal F A, Vidal J E, McClane B A, et al. Clostridium perfringens toxins involved in mammalian veterinary diseases[J]. Open Toxinol J, 2010, 3: 24-42.
[4]蔡宝祥. 家畜传染病学 [M]. 4版.北京: 中国农业出版社, 2001.
[5]施远翔. 喀什地区疏附县牛猝死症病原分离与鉴定[D].乌鲁木齐: 新疆农业大学, 2006.
[6]张小荣, 文其乙, 刘秀梵, 等. 应用多重PCR快速诊断山羊猝死症的研究[J].中国兽医科学, 2002, 32(3): 10-12.
[7]Nowell V. Genomic and proteomic analysis of a bovine hemorrhagic abomasitis type a Clostridium perfringens isolate[D]. Guelph: the University of Guelph, 2011.
[8]Yoo H S, Lee S U, Park K Y, et al. Molecular typing and epidemiological survey of prevalence of Clostridium perfringens types by multiplex PCR[J]. J Clin Microbiol,1997, 35(1): 228-232.
[9]Marchesi J R, Sato T, Weightman A J, et al. Design and Evaluation of Useful Bacterium- Specific PCR Primers That Amplify Genes Coding for Bacterial 16S rRNA[J].Appl Environ Microbiol, 1998, 64(2): 795-799.
[10]柴同杰, 马瑞华, 常维山, 等. 牛羊猪“猝死症”防治技术研究[J]. 中国兽医科技, 1997, 27(5): 13-15.
[11]柴同杰, 张绍学, Mueller W. 乳牛舍内外环境空气中微生物中需氧菌、厌氧菌以及产气夹膜杆菌的定量分析[J]. 中国兽医学报, 1999, (6): 612-615.

