磷酸钙作为O型口蹄疫多肽疫苗佐剂的研究
郭 沛,王霄旸,江善祥,薛飞群
(1.中国农业科学院上海兽医研究所 中国农业科学院兽药安全评价与兽药残留研究重点开放实验室 农业部动物寄生虫病学重点开放实验室,上海200241;2.南京农业大学动物医学院,南京210095)
近些年来,多肽疫苗因其安全性好、容易获得、纯度高等优点开始受到人们广泛的重视并呈现极大的发展空间,对其进行的研究也已取得一些成果,但所遇到的问题仍是不可回避的:一是合成多肽的直链结构在整个功能上可能与天然分子不完全相同;二是合成多肽半衰期短,在体内存留时间短,被蛋白酶迅速降解;三是多肽分子小,免疫原性弱,难以刺激甚至根本不能刺激产生有效的免疫应答等[1]。以上缺陷使多肽疫苗难以引发期望的免疫应答,需要用佐剂来增强免疫效果。因此为了适应推广应用新疫苗的研制,佐剂的研究也显得至关重要,无论在数量上还是质量上对疫苗佐剂的要求都愈来愈高。
常用佐剂是铝盐佐剂、轻质矿物油等传统佐剂。铝盐佐剂不能引起细胞免疫应答,油佐剂在使用过程中有一定刺激性,刺激注射部位引发炎症反应。这些缺点使传统佐剂的应用受到了限制,人们不得不寻找新型的疫苗佐剂。新型疫苗佐剂的组成形式多样,来源也不同,例如MF59[2]、AS02[3]、脂质DC-Chol[4]等均可作为良好的疫苗佐剂,引发较优的免疫反应。
磷酸钙(calcium phosphate, CaP)是机体的天然成分,具有良好的组织相容性和吸收性,无毒且廉价易得。钟石根等[5]将钙纳米颗粒与日本血吸虫单克隆抗独特型抗体NP30制备成Ca-NP30结合物,主动免疫Balb/C小鼠,结果Ca纳米颗粒可增强NP30对宿主的保护性作用。Biosante公司研究发现,磷酸钙纳米颗粒佐剂H5N1疫苗可以刺激机体产生高滴度的H5N1特异性抗体,显著高于单用H5N1疫苗时所诱导的抗体[6]。本试验的目的是将磷酸钙作为游离O型口蹄疫多肽疫苗的佐剂,免疫大鼠,旨在增强游离O型口蹄疫多肽疫苗对机体的保护性免疫作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 Wistar大鼠,清洁级,体重60~80 g,雌性,购于上海斯莱克实验动物有限责任公司,饲以标准饲料,自由饮水、采食,观察1周,健康正常者用于实验。
1.1.2 O型口蹄疫多肽疫苗 FMDV O型多肽抗原液(浓度7.06 mg/mL)由上海申联生物有限公司提供。
1.1.3 试剂 O型口蹄疫抗体液相阻断ELISA检测试剂盒购自中国农业科学院兰州兽医研究所;O型口蹄疫多肽商品疫苗(油苗)购自上海申联生物有限公司;BCA蛋白浓度测定试剂盒(增强型)购自碧云天生物技术研究所;磷酸氢二钠、氯化钙、1,2-丙二醇等试剂均为分析纯,购自上海埃彼化学试剂有限公司。
1.2 方法
1.2.1 磷酸钙多肽复合物的制备及优化 采用共沉淀的方法,参考文献[11]进行,制备过程根据多肽特性做出优化。7.5 mL CaCl2(10 mmol/L)中加入7.06 mg/mL O型口蹄疫多肽,混合均匀后,逐滴加入7.5 mL Na2HPO4(10 mmol/L),滴加完毕后搅拌3 h,最终体系中多肽浓度为50 μg/mL。
鉴于O型口蹄疫多肽在反应体系中不能稳定存在的情况,对多肽稳定剂进行了筛选。7.5 mL CaCl2(10 mmol/L)中分别加入10%、20%、50%的1,2-丙二醇和乙二醇于磁力搅拌器上搅拌混匀,混合液中加入7.06 mg/mL O型口蹄疫多肽混合均匀后,离心过滤测滤液中多肽浓度,检测多肽有无聚沉及其沉降比例。
1.2.2 多肽包封率 将2.1过程制备的CaP-多肽复合物2 mL,6200×g离心15 min,上清液用0.22 μm水性滤膜过滤,BCA蛋白试剂盒检测滤液中蛋白浓度。CaP中多肽包封率(EE%)用以下公式计算:

1.2.3 免疫分组及免疫程序 将Wistar大鼠随机分6组,每组4只,苦味酸乙醇溶液标记。①空白对照组:生理盐水。②游离多肽组:O型口蹄疫多肽液,用纯水稀释至最终浓度50 μg/mL。③空白CaP佐剂组:直接注射不含多肽的CaP混悬液。④阳性对照油佐剂组:O型口蹄疫多肽商品疫苗,多肽浓度50 μg/mL。⑤试验1组:CaP-多肽终浓度50 μg/mL。⑥试验2组:CaP-多肽终浓度100 μg/mL。免疫时0.5mL/只,腹腔注射,首免后14、28 d进行二免、三免。首免后14、21、28、35、42、56 d分别尾静脉采血0.5 mL,4 ℃静置2 h后6200×g离心10 min,取血清,即用或-20 ℃保存备用检测抗体水平。
1.2.4 抗体测定 利用液相阻断ELISA方法检测抗体效价,包被缓冲液1:1000倍稀释口蹄疫O型兔抗血清,每孔加样50 μL,室温过夜。在U型板上按50 μL/孔,用PBST洗涤缓冲液将待检血清从1:4开始做倍比稀释至1:512。同时,按比例稀释阴阳性对照血清,然后每孔加入50 μL用PBST稀释到使用浓度的O型口蹄疫病毒抗原(1:4),病毒抗原对照孔加100 μL,4 ℃过夜。用PBST洗板、甩干,将U型板中各孔血清病毒混合物按次序转移至ELISA板上,每孔50 μL,封板,37 ℃温育1 h。洗板甩干,用豚鼠抗血清稀释液稀释豚鼠抗O型口蹄疫病毒血清至工作浓度(1:1000),每孔50 μL,封板,37℃温育1 h。同上洗板,用PBST稀释兔抗豚鼠酶结合物至工作浓度(1:500),每孔50 μL,37 ℃温育1 h。同上洗板,每孔50 μL底物溶液,37 ℃温育15 min。每孔再加50 μL终止液终止反应,立即在492 nm波长下读取光吸收值(OD492),判定各血清的抗体效价。
2 结果
2.1 磷酸钙-多肽复合物的制备及优化 根据上述方法制得的磷酸钙-多肽复合物电镜下观察有少量团聚,粒径大小在1000~3000 nm。于反应体系中加入不同比例的多元醇,对O型口蹄疫多肽有一定的保护作用,结果(图1)显示,随多元醇含量升高,体系中多肽沉降比例降低,且1,2-丙二醇效果优于乙二醇。
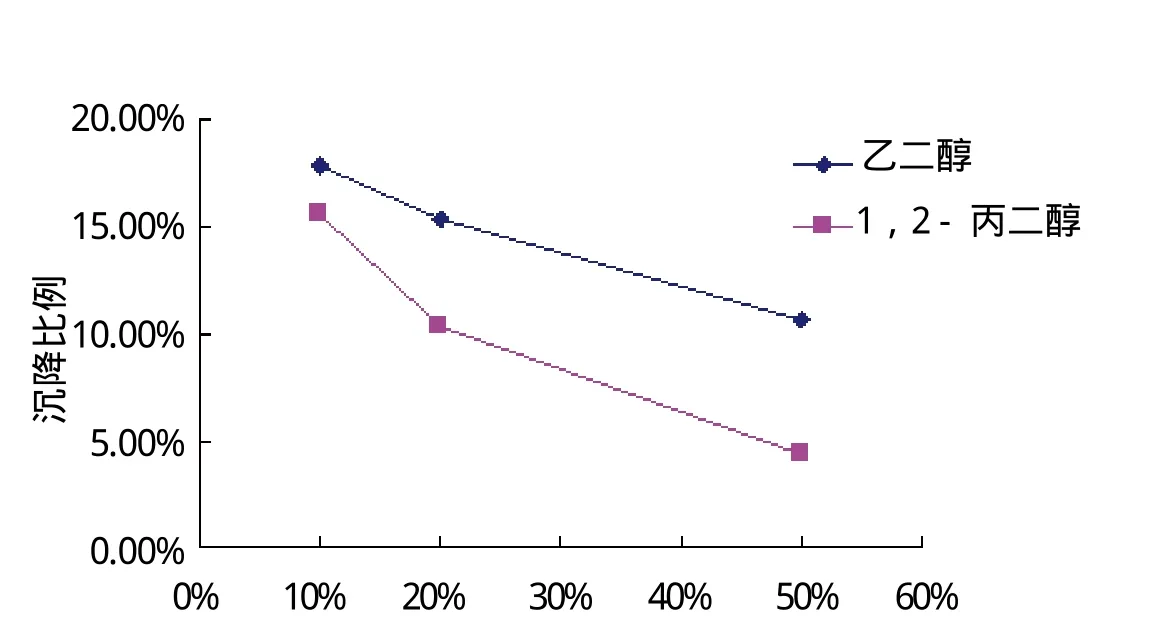
图1 不同浓度多元醇对多肽沉降的沉降比Fig.1 Sedimentation Proportion of different concentration polyhydric alcohol
2.2 CaP-多肽复合物包封率 BCA蛋白试剂盒测定离心过滤前后磷酸钙中包封的多肽含量,结果显示磷酸钙中多肽终浓度为50 μg/mL、100 μg/mL时,包封率50%左右,无较大差异,见表1。
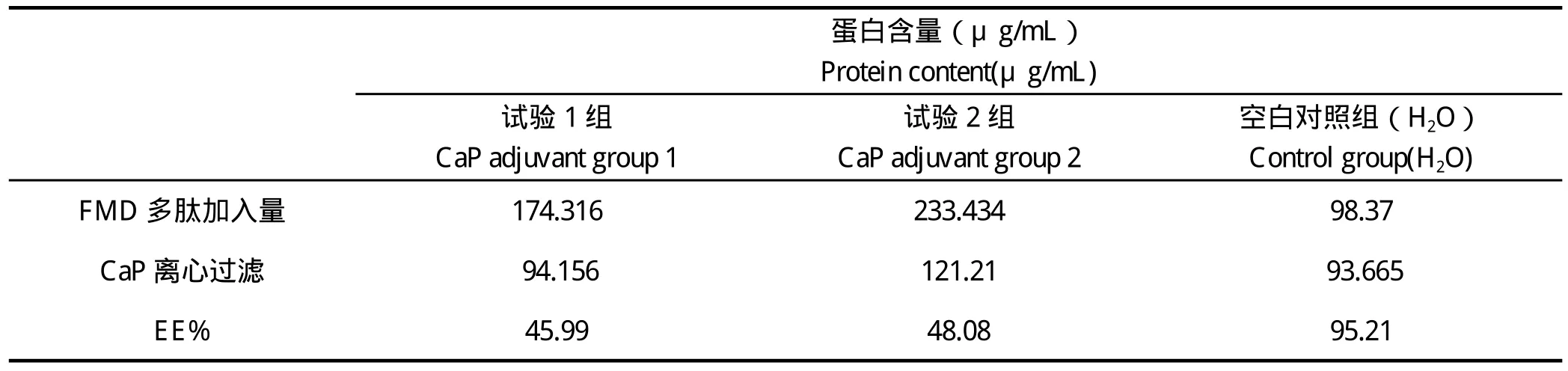
表1 磷酸钙对O型口蹄疫多肽包封率Table 1 Rate of encapsulation efficiency of calcium phosphate
2.3 抗体测定 分别于首免后第d14、21、28、42、56尾静脉采血测定抗体效价。市售商品疫苗使用的是矿物油佐剂,免疫后抗体水平在14 d达到26,42 d增至210,抗体产生较快且该较高水平可维持28~35 d,证实了矿物油是一种良好的疫苗佐剂;生理盐水组、空白CaP佐剂组、游离多肽组均无抗体产生 ;试验1组、试验2组在21 d后陆续产生抗体,抗体水平较油佐剂低,在42 d和28 d分别达到最高水平27和28,说明磷酸钙可一定程度上提高O型口蹄疫多肽的免疫效果,结果见表2。
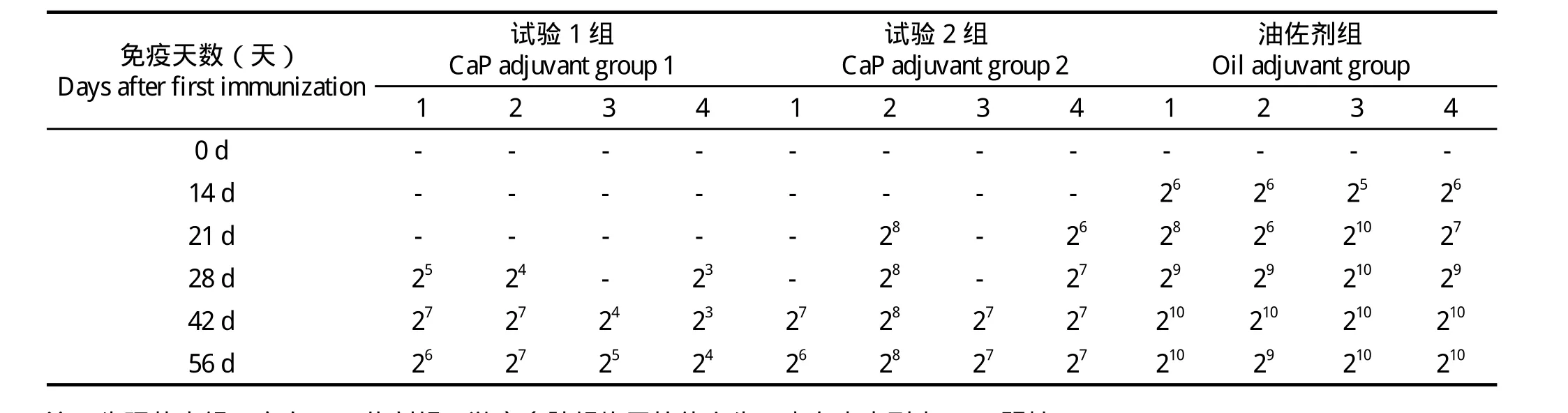
表2 试验组和油佐剂组抗体效价测定结果Table 2 Result of experimental groups and oil adjuvant group antibody titer

图2 免疫后抗体效价检测结果Fig.2 Result of antibody titer after immunization
3 讨论
磷酸钙用作基因载体已有多年,将DNA与磷酸钙以共沉淀的方式引入到细胞中,并在体内转染试验中有较高的转染效率,已广泛应用于细胞转染[7-10]。将其作为疫苗佐剂也取得了一些进展,在欧洲,磷酸钙已被用来作为预防白喉和破伤风疫苗抗原的免疫佐剂,可诱导机体对II型单纯疱疹病毒和EB病毒的免疫应答[11],磷酸钙既可减少注射局部的炎症反应,而且还能诱导Thl细胞反应,具有比传统氢氧化铝佐剂更强的优势。
FMDV O型多肽抗原是利用化学方法人工合成FMDV O型毒株VP1结构蛋白中141-160位的氨基酸序列,同时,在VP1上结合辅助T细胞表位的环状构造以增强疫苗的抗原性,克服了VP1环状多肽只有B细胞表位的缺点,加强了T细胞和B细胞免疫,另外双硫键的存在提高了环状构造的稳定性[12]。
为了探讨磷酸钙是否可作为 O型口蹄疫多肽疫苗佐剂,本试验采用共沉淀的方法制备磷酸钙混悬剂作为佐剂包裹O型口蹄疫多肽,在反应体系中,CaCl2、Na2HPO4盐溶液,易使多肽发生絮凝甚至沉淀,导致其活性降低或丧失。在反应体系中加入不同量乙二醇、1,2-丙二醇[13],可使更多的水分子围绕在蛋白质周围从而提高多肽稳定性。
通过液相阻断ELISA比较免疫大鼠后各组抗体效价,结果显示磷酸钙作为佐剂免疫效果低于市售油佐剂,但高于游离多肽。因磷酸钙作为佐剂其作用机制尚不明确,我们对该抗体检测的结果做出可能性分析:原因一,包封于磷酸钙内部的多肽量不足以引发较强的免疫反应。检测多肽包封率50%左右,共沉淀过程中实际包封于磷酸钙内部的多肽为试验1组约25 μg/mL,试验2组约50 μg/mL。原因二,颗粒性佐剂可通过树突状细胞活化抗原摄取和转运至引流淋巴结而诱导有效的免疫应答[14]。免疫后,包裹多肽的磷酸钙颗粒能否被树突状细胞及时捕获,以及多肽能否在抗原递呈细胞中及时释放是决定免疫强度的重要因素。原因三,磷酸钙为无定形颗粒,静置后易发生絮凝,团聚体粒径大于抗原递呈细胞的捕获范围,因此免疫活性较低。对于其原因的分析有助于进一步改进实验方法,从而进一步研究磷酸钙作为疫苗佐剂的可能性。
我们目前的研究表明,采用共沉淀方法制备的CaP-多肽复合物,50% 1,2-丙二醇为口蹄疫多肽的稳定剂,CaP中多肽包封率达50%,腹腔免疫大鼠后检测抗体水平,相对游离多肽可以适当提高其免疫效果,但相对市售商品油佐剂抗体水平较低。
[1]吕凤林, 何凤慈. 利用纳米材料制作多肽疫苗佐剂的思考[J]. 生物化学与生物物理进展, 2001, 28(6): 832-835.
[2]Podda A, Del-Giudice G. MF59-adjuvanted vaccines:increased immunogenicity with an optimal safety profile[J]. Expert Rev Vaccines, 2003, 2(2): 197-203.
[3]Garcon N, Heppner D G, Cohen J. Development of RTS, S/AS02: a purified subunit-based malaria vaccine candidate formulated with a novel adjuvant[J]. Expert Rev Vaccines, 2003, 2(2): 231-238
[4]Guy B, Pascal N, Francon A, et a1. Design,characterization and preclinical efficacy of a cationic lipid adjuvant for influenza split vaccine[J]. Vaccine, 2001,19(13-14): 1794-1805
[5]钟石根, 冯振卿, 仇镇宁, 等.钙纳米颗粒作为血吸虫病抗独特型抗体疫苗佐剂的研究[J].中国血吸虫病防治杂志, 2001, 13(6): 321-323
[6]施桂兰. BioVant显示良好的抗动物H5N1资料[J]. 国外药讯, 2006, (11): 3
[7]Jordan M, Schallhorn A, Wurm F.M, Transfection mammalian cells:otimization of critical parameters affecting calcium phosphate precipitetion foramtion[J].Nucleic Acids Res, 1996, 24(4): 596-601.
[8]Jordan M, Wurm F, Transfection of adherent and srspended cells by cacium phosphate[J].Methods, 2004,33(2): 136-143.
[9]Olton D, Jinhua Li, Wilson M E, et al. Nanostructured calciun phosphate (NanoCaPs)for non-viral gene delivery: Influence of the synthesis parameters on transfection efficiency[J].Biomaterials, 2007, 28(6):1267-1279.
[10]Roy I, Mitra S, Maitra A, et al. Calcium phosphate nanoparticles as novel non-viral vectors for targeted gene delivery[J]. Int J Pharm, 2003, 250(1): 25-33.
[11]He Q, Mitchell A R, Johnson S L, et al. Calcium phosphate nanoparticle adjuvant[J]. Clin Diagn Lab Immunol, 2000, 7(6): 899-903.
[12]Wang C Y, Chang T Y, Walfield A M , et al. Effective synthetic peptide vaccine for foot-and mouth disease in swine[J]. Vaccine, 2002, 20(19-20): 2603-2610.
[13]Manning M C, Matsuura J E, Kendrick B S, et al.Approaches for increasing the solution stability of proteins[J]. Biotechnol Bioeng, 1995, 48(5): 506-512.
[14]Dupuis M, Murphy T J, Higgins D, et al. Dendritic cells internalize vaccine adjuvant after intramuscular injection[J]. Cell Immunol, 1998, 186(1): 18-27.

