兔IL-6基因真核表达载体的构建及其对pcDNA-VP60 DNA疫苗佐剂效应研究
张夏兰
(重庆市巴南区动物疫病预防控制中心,重庆401320)
白介素6(interleukin 6,IL-6)是一种多功能细胞因子,又称为B细胞分化因子、干扰素J32及肝细胞刺激因子。哺乳动物的白介素6具有广泛的生物学活性,几乎能影响免疫系统的所有细胞,在调节免疫应答、影响急性期的蛋白应答和造血功能等方面发挥重要作用,并与其他细胞因子相互协调,共同构成复杂的细胞因子网络。研究表明,IL-6具有免疫佐剂效应,能增强免疫应答,但将细胞因子重组蛋白作为免疫佐剂,其主要缺陷是半衰期短,活性易受内环境如PH值、各种水解酶及血浆蛋白的影响[1-4]。有资料显示,细胞因子基因真核表达质粒在机体内部可产生与自身机体细胞因子十分相似的生物学活性[5-8]。同时以重组质粒表达的细胞因子,即细胞因子分子佐剂,可以克服重组蛋白的缺陷,从而在DNA疫苗这个领域中得到更多的重视和研究。分子佐剂一次少量接种即可在机体内长时间低量表达,而且表达产物接近天然构象,是体内存在的免疫效应因子,对机体无毒副作用。因此,本研究构建了真核表达质粒pcDNA-IL-6,并与pcDNA-VP60联合免疫试验兔,分析其对家兔免疫应答的影响。
1 材料与方法
1.1 试验动物 农户处购买的1月龄左右的兔病毒性出血症(rabbit haemorrhagic disease, RHD)非免疫兔30只。
1.2 质粒和菌种 重组质粒pMD18-T-IL-6和真核表达质粒pcDNA-VP60系本人构建并保存。
1.3 试剂 人“O”型红细胞由雅安市血站提供;Lipofecter 脂质体转染试剂盒购自碧云天生物技术研究所;溶菌酶PEG8000、NH4Ac、异丙醇、NaOH、胰蛋白胨、酵母抽提物、小牛血清、葡萄糖、醋酸钠、冰乙酸、氯仿、苯酚、无水乙醇均为分析纯。
1.4 真核表达质粒pcDNA-IL-6的构建 将重组质粒pMD18-T-IL-6转化E.coli JM109感受态细菌,37℃培养12 h后,抽提质粒并纯化。重组质粒经限制性内切酶Hind Ⅲ和EcoRⅠ双酶切后,回收IL-6基因,与经同样双酶切处理的pcDNA3.1(+)质粒进行连接。连接体系如下:IL-6 4.5 μL、pcDNA3.1 0.5 μL、Soltion Ⅰ5.0 μL,加到反应管中,混匀,16℃连接过夜。将连接产物转化JM109细菌,37℃培养12 h后,抽提质粒。经过酶切和PCR鉴定为阳性的重组质粒,送宝生物(大连)有限公司进行测序。重组质粒命名为pcDNA-IL-6。
1.5 质粒的大量提取及纯化 用含Amp+的LB液态培养基对含有pcDNA3.1(+)、pcDNA-IL-6和pcDNA-VP60质粒的大肠杆菌JM109进行大量培养,按照碱裂解法进行质粒的大量抽提,并采取PEG(聚乙二醇)沉淀法对质粒进行纯化。方法均参照文献[9]进行。
1.6 质粒的脂质体包被 质粒/脂质体复合物的制备,按照文献[10]方法进行。分别制备pcDNA3.1/脂质体复合物、pcDNA-IL-6/pcDNA-VP60/脂质体复合物(两种质粒的比例为3:10)和pcDNA-VP60/脂质体复合物。
1.7 动物分组及免疫 筛选30只1月龄非免疫兔,随机分成3组,分别通过腿部肌肉分点注射。免疫pcDNA3.1/脂质体复合物、pcDNA-IL-6/pcDNAVP60/脂质体复合物和pcDNA-VP60/脂质体复合物,质粒免疫剂量为500 μg,免疫2次,两次免疫时间间隔20 d。分别于免疫后d7、14、21、28、35、70对各组试验兔耳静脉采血,分离血清,检测特异性免疫抗体。免疫d70后用兔病毒性出血症病毒(Rabbit haemorrhagic disease virus, RHDV)滴度108的活病毒进行攻毒,剂量为0.5 mL/只,腿部肌肉注射。攻毒后观察1周内试验兔的发病、死亡情况,计算攻毒保护率。
1.8 特异性抗体的检测及分析 采用血凝抑制(HI)试验(GB/T1496.54-2008):取“V”型96孔微量反应板1块,用微量吸液器每孔加生理盐水25 μL,随后取待测兔血清25 μL,从第1排1孔开始,依次倍比稀释至第1排最后1孔,弃掉25 μL。将兔病毒性出血症血凝抗原稀释成4单位,每孔加4单位兔病毒性出血症血凝抗原25 μL,放震荡器上混匀,置湿盒内,37℃作用10 min后,每孔加1%人O型血红细胞25 μL,再放微量震荡器上混匀,置湿盒内,37℃作用30 min后观察结果,以能完全抑制红细胞凝集的血清最高稀释倍数作为血清的血凝抑制价。同时设阴阳性对照。应用SPSS11.0按方差分析法对同一时间段不同组别、不同时间段同一组织试验兔的血清特异性抗体含量进行统计学处理。
2 结果
2.1 真核表达质粒pcDNA-IL-6构建结果 通过质粒PCR、Hind Ⅲ和EcoRⅠ双酶切鉴定结果表明,IL-6基因成功克隆至真核表达载体pcDNA3.1(+)中。测序结果显示克隆到pcDNA3.1(+)上的基因大小为726 bp,与目的基因大小一致(图1);且插入的基因序列与目的基因片段,完全吻合,即IL-6基因按照正确的阅读框架插入到pCDNA3.1(+)质粒中,pcDNA-IL-6真核表达质粒构建成功。
2.2 特异性抗体检测结果 pcDNA-IL-6/pcDNA-VP60/脂质体复合物和pcDNA-VP60/脂质体复合物免疫试验兔之后,均产生了不同程度的特异性抗体。各实验组与对照组相比,均具有极显著统计学意义(P<0.01)。其中,pcDNA-IL-6/pcDNA-VP60/脂质体复合物免疫组产生的抗体水平高于免疫pcDNAVP60/脂质体复合物组。首免后特异性抗体逐步上升,免疫d28,pcDNA-IL-6/pcDNA-VP60/脂质体复合物诱导抗体达到峰值水平,而pcDNA-VP60/脂质体复合物在免疫后d35,其抗体水平才达到峰值(表1)。

图1 pcDNA-IL-6双酶切及PCR鉴定结果Fig.1 Identification of pcDNA-IL-6 digested by restriction enzyme and PCR result
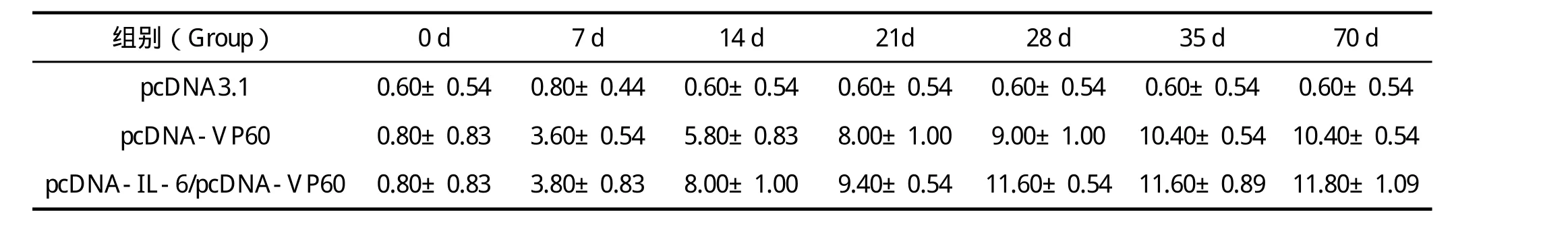
表1 特异性抗体检测结果Table1 Antibody responses induced by different methods
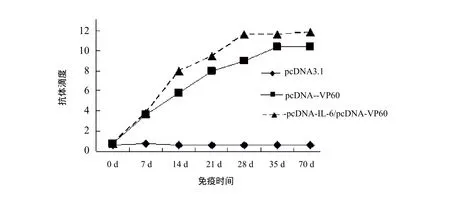
图2 pcDNA3.1, pcDNA-VP60和 pcDNA-IL-6/pcDNA-VP60免疫后兔血清抗体变化曲线Fig.2 HI antibody titer curve in rabbits immunized with pcDNA3.1, pcDNA-VP60 and pcDNA-IL-6/pcDNA-VP60
2.3 pcDNAIL-6的免疫佐剂效应 真核表达质粒pcDNA-IL-6对pcDNA-VP60的佐剂效应在二免后1周表现出来,免疫后第28、35、70 d,pcDNAVP60 DNA+pcDNA-IL-6免疫诱导产生的抗体水平高于pcDNA-VP60 DNA免疫诱导产生的抗体水平(图2),差异具有显著统计学意义(P<0.01)。
2.4 攻毒试验结果 攻毒d1,对照组有实验兔死亡,d2未注射pcDNA-IL-6真核质粒组的实验兔开始死亡,d4之后无实验兔死亡(表3)。对病死兔进行剖检,其病理变化表现为:气管和支气管黏膜充血;肝肿大,呈黄褐色,质脆;脾脏肿大,呈黑紫色;肾呈暗红色,被膜下和切面有大量出血点;肺表面有大小不等的出血块,严重者甚至整叶肺出血;膀胱内有黄褐色较浓稠的尿液;淋巴结肿大。

表3 攻毒保护试验统计结果Table 3 The result of protective test against RHDV in rabbits
3 讨论
中国国内至今还没有成熟的RHDV抗体ELISA检测试剂盒,血凝抑制试验是比较传统的一种血清抗体检测方法,因其操作简单、稳定性好,在RHDV抗体的检测上得以广泛应用,故本研究选择血凝抑制试验(GB/T1496.54-2008)作为试验兔血清抗体检测方法。
本研究用pcDNA-IL-6与pcDNA-VP60联合免疫实验兔,对免疫后各实验组抗体动态变化的分析发现,pcDNA-IL-6在疫苗诱导免疫应答的过程中都表现出了明显的佐剂效应。抗体水平变化的总体趋势是:从免疫后7 d到70 d, pcDNA-IL-6+pcDNA-VP60 DNA疫苗诱导产生的抗体滴度显著高于pcDNA-VP60 DNA疫苗,差异具有极显著统计学意义(P<0.01)。免疫后70 d,pcDNA-VP60 DNA+pcDNA-IL-6免疫组抗体水平没有降低,pcDNA-VP60 核酸疫苗免疫组的抗体水平明显下降,此时前者比后者抗体水平高出4倍以上,差异具有极显著统计学意义(P<0.01)。试验结果表明pcDNA-IL-6与疫苗联合免疫时可促进机体产生快速持久的免疫应答, pcDNA-IL-6对pcDNA-VP60 DNA疫苗免疫具有明显免疫佐剂效应。
攻毒试验结果表明,攻毒保护率与机体的抗体水平基本一致。抗体水平高的实验兔的保护率也高,相反产生抗体水平低的实验组兔在受到强毒攻击时保护率就低。说明分子佐剂pcDNA-IL-6在增强DNA疫苗的免疫力、抵抗强毒攻击等方面发挥重要作用。
[1]郭焱, 金宁一, 张应玖, 等. 共表达HIV-1与IL-6核酸疫苗质粒诱导小鼠免疫原性的研究[J]. 中华徽生物学和免疫学杂志, 2002, 22(2): 174.
[2]郭斐, 陆柔剑, 孙朝晖, 等. 非复制重组痘苗病毒中白细胞介素6的表 达及其对重组病毒免疫效果的形响[J].中华实验和临床病毒学杂志, 2002,16(2): 136-141.
[3]龙章富, 高荣, 孟民杰, 等. 脂质体包裹猪白细胞介素6基因对猪带绦虫抗原基因免疫小鼠的影响[J]. 高技术通讯, 2003, (3): 25-29.
[4]严琳, 何启盖, 陈焕春, 等. 猪IL-2与IL-6的原核表达及其对伪狂犬病基因块失疫苗的佐剂效应研究[J].中国农业科学, 2003, 36(10): 1213-1218.
[5]原冬伟, 刘家森, 郭东春,等. 兔出血症病毒VP60基因真核表达质粒的构建及初步评价[J].中国兽医学报,2011, 31(11): 1582-1586.
[6]Geissler M, Gesien A, Tokushige K,et al. Enhancement of cellular and humoral immune responses to hepatitis C virus core protein using DNA-based vaccines augmented with cytokine-expressing plasmids[J]. J Immunol, 1997,158(3): 1231-1237.
[7]程相朝, 赵德明, 吴廷才, 等. 鸡IL-18真核表达载体的构建及其对新城疫疫苗免疫增强作用的研究[J]. 畜牧兽医学报, 2005, 36(5): 476-481.
[8]张春杰, 程相朝, 李银聚, 等. 鸡IL-18真核表达载体的构建及其对IBD灭活疫苗免疫增强作用的研究[J].中国免疫学杂志, 2004, 20(9): 617-621.
[9]萨姆布鲁克 J,弗里奇 E F, 曼尼阿蒂斯 T. 分子克隆实验指南[M]. 3版. 北京: 科学出版社, 2002.
[10]李晓英, 王红宁, 周生, 等. IBV pcDNA质粒/脂质体符合物得制备工艺研究[C]11 中国畜牧兽医学会家禽传染病学会第11次学会研究会论文集, 2005.

