磁共振扩散加权成像对肝脏肿瘤的诊断价值
宋 淮 周立强 徐开鹏
江苏省沭阳县人民医院影像中心,江苏 沭阳 223600
磁共振扩散加权成像对肝脏肿瘤的诊断价值
宋 淮 周立强 徐开鹏
江苏省沭阳县人民医院影像中心,江苏 沭阳 223600
目的 探讨利用不同b值和测量位置得到的表观扩散系数(ADC)值及灌注ADC值在肝脏良恶性肿瘤鉴别诊断中的价值。方法 对120例肝脏肿瘤进行常规MRI平扫和扩散加权成像扫描,其中48例肝脏肿瘤同时进行了多期增强扫描。采用表观扩散系数(b值)分别为0s/mm2和1000s/mm2,测量病变整体、边缘及中心的表面扩散系数(ADC)值及灌注ADC值,分析不同b值时,各测量参数在良恶性肿瘤之间的差异。结果 肝癌、肝脏转移瘤患者病变区的ADC值分别为(1.04±0.36)×10-3mm2/s、(1.46±0.49)×10-3mm2/s;肝囊肿、肝脏血管瘤患者病变区的ADC值分别为(2.38±0.81)×10-3mm2/s、(1.97±0.63)×10-3mm2/s;b值0s/mm2时,肝脏良恶性肿瘤之间ADC值差异均无统计学意义(P>0.05),肝脏灌注ADC值有统计学意义(P<0.05);当b值1000s/mm2时,肝脏良性病变与恶性病变区域内的ADC值差异有统计学意义(P<0.05),肝脏灌注ADC值差异有统计学意义(P<0.05);对于不同的测量感兴趣区位置,在病灶边缘与中心之间,恶性肿瘤的灌注ADC值差异有统计学意义(P<0.05);但是良性肿瘤差异无统计学意义(P>0.05)。结论 磁共振弥散成像对肝脏肿瘤的诊断具有很大的价值,特别是高b值及灌注ADC值对肝脏良恶性的鉴别诊断更加准确。
磁共振成像;弥散加权成像;表观扩散系数;肝脏肿瘤;鉴别诊断
弥散加权成像( diffusion weigh tedimaging, DWI ) 是目前能在活体上进行水分子弥散测量与成像的惟一方法,反映了水分子的微观运动状况。DWI对中枢神经系统特别是脑缺血的临床价值已被广泛肯定,随着磁共振技术的发展,DWI的应用也从神经系统向全身其他系统推广。本文探讨弥散加权成像在肝脏肿瘤中的价值。
1 资料与方法
1.1 临床资料 选择2009年6月至2011年10月在我院诊治的肝内良、恶性肿瘤120例,其中肝细胞癌36例(男27例,女9例,年龄41~78岁,平均年龄54.5岁);肝脏转移瘤29例(男22例,女7例,年龄38~74岁,平均年龄51.5岁);肝脏血管瘤36例(男23例,女13例,年龄33~71岁,平均年龄48.5岁);肝囊肿19例(男10例,女9例,年龄30~69岁,平均年龄43.5岁)。所有病例在 DWI 扫描前未经任何治疗。
1.2 检查方法 采用GE公司Singa HDe至臻版1.5T 磁共振成像仪和8通道相控表面线圈。进行上腹部平扫加增强,扫描序列包括:T2WI采用呼吸触发脂肪抑制快速恢复自旋回波(TR:6666.7ms,TR:93.4ms),T1WI采用屏气相双回波扰相梯度回波(in phase TR:190ms,TE:4.7ms;opposed phase TR:190ms,TE:2.4ms)。增强扫描采用肝脏容积快速三维成像(LAVA序列),利用LAVA技术获得动脉期、门脉期及延迟期图像。DWI 扫描前先行 ASSET序列扫描,DWI选用2个不同的扩散敏感系数,b值分别为0 s/mm和800s/mm。采用SE-EPI序列,扫描中心层面置于病灶最大直径处。扫描层数6~11层,层厚5mm,层距2mm,视野(FOV) 380mm×380mm。矩阵:128×128,激励次数3,扩散方向至少6~8个。DWI扫描均在1次屏气中完成。
1.3 DWI图像分析 在ADW4.4工作站上测量ADC值, 将图像分析层面置于病灶最大直径处。首先利用机器自带的扩散成像分析软件建立 ADC图和指数化表观扩散系数图(eADC),测量感兴趣区覆盖全部病灶进行ADC值测量。每个病灶选用同样大小的圆形感兴趣区的不同位置测量3次,取其平均值。
1.4 统计学方法 所有数据利用 SPSS13.0软件进行处理,ADC值用均数±标准差表示,不同病灶的ADC值之间的差异用单因素方差分析,进行组间两两比较,P<0.05为差异具有统计学意义。
2 结 果
本组病例包括原发性肝癌、肝脏转移瘤、肝脏血管瘤和肝囊肿患者(图1~12)。所有病例均得到弥散加权图像及ADC图像,可以得出弥散系数。从ADC图像上看,弥散系数高的组织呈高信号影,代表其含水量高,水分子弥散快。在DWI图上,肝囊肿为较低信号,ADC图上较小的囊肿不易辨认,故采用ADC图与T2 WI图象融合来解决;肝癌、转移瘤及血管瘤的实体部分多为较高、稍高或稍高混杂信号,坏死部分多为较低信号容易辨别b值0s/mm2时,肝脏良恶性肿瘤之间ADC值差异均无统计学意义(P>0.05),肝脏灌注ADC值有统计学意义(P<0.05);当b值1000s/mm2时,肝脏良性病变与恶性病变区域内的ADC值差异有统计学意义(P<0.05),肝脏灌注ADC值差异有统计学意义(P<0.05);对于不同的测量感兴趣区位置,在病灶边缘与中心之间,恶性肿瘤的灌注ADC值差异有统计学意义(P<0.05);但是良性肿瘤差异无统计学意义(P>0.05)。(表1)
3 讨 论
磁共振扩散加权成像主要反映组织内微观水分子的活动自由度,它可提供组织功能和生理方面的信息[1]。肝细胞癌、肝转移瘤、肝内海绵状血管瘤及肝脏囊肿为肝脏常见的占位性病变,部分病例由于缺乏特异性表现导致诊断困难。受疾病不同生物学行为的影响,不同病变组织内细胞增殖和组织结构等存在明显的差异,由此导致水分的扩散程度不同,因此,DWI可以用于肝脏肿瘤的诊断和鉴别诊断。目前DWI图像及表观扩散系数值在肝脏占位性疾病的早期诊断和鉴别方面显示出较高的敏感性[2、3],但是不同研究、不同b值得到的结果也不尽一致。选择合理的b值和DWI测量参数将提高DWI在肝脏占位性疾病鉴别诊断中的临床应用效果。肝细胞癌、转移瘤、海绵状血管瘤、均为肝脏常见的实性占位性病变。肝脏是血供丰富的器官,DWI测量参数容易受到血流灌注的影响。当DWI敏感性较低时,测得的水分子受血流的影响较大,当敏感性增加到一定程度时,血流灌注的水分子运动已经超出一个体素的范围,这时DWI主要反映组织内水分子运动,病灶组织内分子的扩散程度与细胞增殖、生物膜结构合成及细胞分泌或因细胞坏死释放的一些大分子蛋白质有关[4]。而不同病变的以上结构存在较大的差异,尤其,是恶性肿瘤易出现特征性的液化、坏死[5]。因此利用DWI技术可对肝脏疾病进行鉴别。另外,DWI测量参数易受血流灌注的影响,当DWI敏感度较低时,测得的水分子运动受运动较快的血液流动的影响较大;而b值增加到一定程度,血流灌注的水分子运动已经超出一个体素的范围,这时DWI主要反映组织内水分子的运动,因此高b值反映了病变水分子真实的扩散情况[6]。但是由于不同病种之间血流灌注不尽一致,而低b值的测量参数可在一定程度上反映该病的血流情况,因此在疾病的鉴别方面,低b值测量参数同样也具有一定的意义。有关文献报道[7]:高、低b值时ADC值之间的差值可反映该组织的血流灌注情况,即灌注ADC值和e ADC值。与对比剂增强或灌注成像相比,该方法简便快捷、且无对比剂不良反应。b值选取极其重要,一般来说,b值越大的图像测得的ADC值越准确,然而b值过高意味着需要较长的回波时间(TE)成像,图像的信噪比就会下降,反而会影响病灶ADC值的测量[8]。b值小的图像信噪比高。但是测得的ADC值偏高。且有较大波动,因此本研究采用的值为1000s/mm2,测得的ADC值较稳定,且图像质量也相对较好。
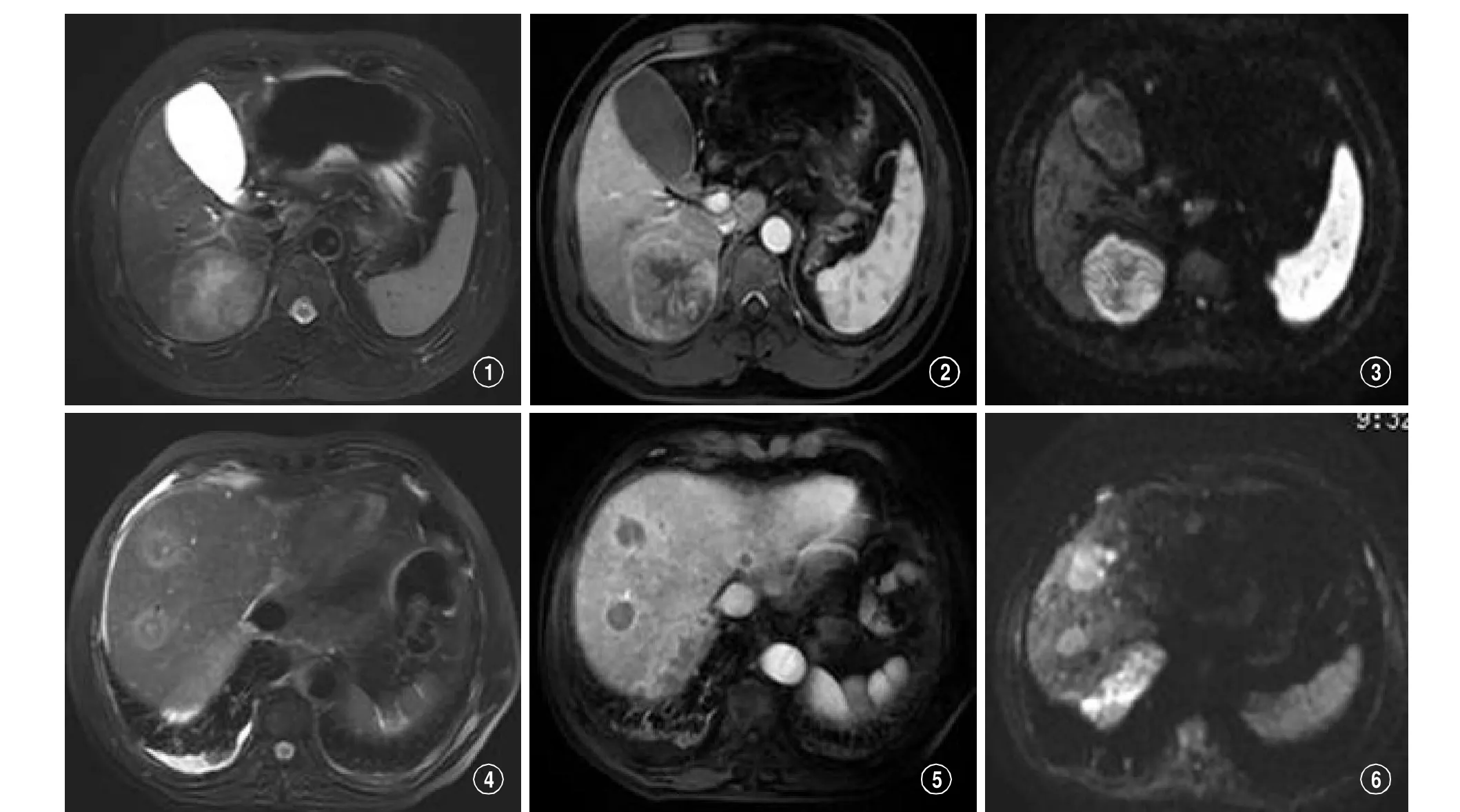
图1-3 原发性肝癌的MRI成像.图1在脂肪抑制序列(STIR),图2为增强横断位,图3为DWI图),图1肝脏右叶后段类圆形肿瘤,呈不均匀高信号,边界清晰;图2 肝右叶肿瘤增强呈不均匀强化,边缘强化明显;图3 DWI上病灶呈高信号。图4-6肝脏转移瘤,(图4为脂肪抑制序列(STIR),图5为增强横断位,图6为DWI图),图4肝脏内多发类圆形异常信号,边缘呈高信号,其中心可见点状高信号,呈典型的‘牛眼征’;图6肝脏内肿块增强呈明显环形强化,中心轻度强化,肝脏边缘呈斑片状强化;图6 DWI病灶呈高信号。

图7-9 肝脏血管瘤,(图7:ST I R,图8:增强动脉期,图9:增强扫描延迟器图像),图7肝脏右叶后段病灶,呈明显高信号,边界清晰;图8动脉早期造影剂少量进入,病灶呈边缘强化,呈向心性;门脉期造影剂全部充填,病灶明显均匀强化。图1 0-1 2 肝囊肿患者,(图10:STIR,图11:T1WI,图12:MRCP),图10 肝脏内多发囊肿,最大直径2.5cm,病灶呈高信号,边界清晰,信号均匀;图11 T1WI序列,肝脏内多发病灶,呈低信号,边界清晰;图12 MRCP显示肝脏内弥漫性多发异常信号,呈高信号,边界清晰。
表1 不同肝脏病变的A DC值(±s,×103mm 2/s)
疾病 例数 ADC值原发性肝癌 36 1.04±0.36肝脏转移瘤 29 1.46±0.49肝脏血管瘤 36 1.97±0.63肝脏囊肿 19 2.38±0.81
肝细胞肝癌和转移瘤的鉴别:本组数据显示其在b值1000时无统计学意义。有文献报道[9]根据MRI动态增强扫描动脉期的表现,把恶性实性肿块分为富血供和乏血供两组,肝细胞癌多属于富血供肿瘤;肝转移瘤多属于乏血供肿瘤。在采用小b值的DWI上,ADC值明显受组织和病变内血流灌注的影响,肝细胞癌的平均ADC值明显高于肝转移瘤。肝囊肿及肝血管瘤鉴别:本组数据显示其在b值1000时无统计学意义。因为病灶主要由液体成分构成。其水分子运动较自由,因此ADC值较肝脏实质性肿瘤高。在DWI图上呈低信号。ADC图上呈高信号。由于DWI的T2余辉效应[10],部分病灶在DWI图上仍呈高信号.肝血管瘤内常有纤维间隔、瘢痕、出血等,且血窦中所含血液的粘度高于囊肿内的囊液,其水分子运动较囊液相对受限,因此肝血管瘤的ADC值又低于肝囊肿。肝癌、肝转移瘤等实质性肿瘤由实性细胞构成,其分子运动受限,ADC值较低,但是肿瘤血供丰富,含结合水量增加,因此其ADC值又较正常肝组织高。胆管细胞癌因其纤维成分较多,细胞含水量少。且为乏血供肿瘤。分子运动受限,其与正常肝组织的A DC值相接近。肝脏恶性肿瘤与良性病灶的鉴别:本组数据显示其在 b值1000时有统计学意义。本研究发现,不同b值时各病种的ADC值由大到小依次为肝脏囊肿、肝脏血管瘤、肝脏转移瘤、原发性肝癌。由于囊肿、血管瘤内部为含水较多液体。血窦、肝脏转移瘤、原发性肝癌内部存在程度不同的液化、坏死,其内存在导致水分子扩散在一定程度上受限,但其扩散程度还是大于实性肿瘤。由于不同b值得出的各个参数都不相同,几乎所有的测量参数都具有差异,与文献报道相符[11、12]。
有文献报道[13-16]:不同b值时ADC值之间的差值可反映组织的血流灌注情况,即灌注ADC值。与对比增强或灌注成像相比,该方法简单易行,无不良反应。良恶性肿瘤的血液灌注量有很大的差别,可以用于肝脏原发性肿瘤与肝脏转移瘤的鉴别诊断[17-19]。本研究发现,在病变边缘与中心之间,恶性病变的灌注ADC和eADC差异有统计学意义[20],但良性肿瘤这种差异不明显,说明恶性肿瘤因中心出现坏死使血流灌注下降,良性肿瘤生长速度较慢,病灶中心与边缘的血供并不明显。另外恶性肿瘤病灶整体及边缘、中心的灌注ADC值均大于良性肿瘤,因此,灌注ADC值是鉴别肝脏良恶性肿瘤的指标[21]。
总之,DWI的信号表现较为真实地反映了肝脏病灶的组织成分,可以作为磁共振常规扫描序列的有效补充。在临床应用中,可以通过测量病灶的ADC数值,大致推想其病理组成,并在一定程度上提高了小病灶的检出率,从而帮助得到更加准确的诊断结果;肝脏良、恶性肿瘤的平均ADC值之间存在显著性差异[21],检测病灶的ADC值,对于肝脏占位性病灶诊断与鉴别诊断有重要价值,结合常规MRI可大大提高肝脏占位性病变的诊断准确率。
1.TALWALKAR JA, YIN M, FIDLER JL, et al.Magnetic resonance imaging of hepat ic f ibrosis: emerging c l inical applicarions[J].Hepatology,2008,47:332-342.
2.ZECH CJ, HERRMAN KA, DIETRICH O, et al.Black-blood dif fusion-weigheed EPI acquistion of the liver with paral lel inaging: comparison with a standard T2-weighted sequence for detection of focal liver lesions[J].Incest Radiol,2008,43:261-266.
3.PARIKH T, DREW SJ, LEE VS, et al.Focal liver lesion detection and characterization with dif fusion-weigheed MR imaging: conparison with standard breath-hold T2-weighted imaging[J].Rsdiology,2008,246:812-822.
4.史慧萍,刘晓雨,李冬梅,等.肝癌边缘CT强化特征与肿瘤新生恤管的相关性研究[J].实用肝脏病杂志,2011,14(2):138-141.
5.YUN YH, XIAO EH, LIU JB, et al.Characterisrics of liver on magnetic resonance dif fusion-weigheed imaging: dynamic and image pathological investigation in rabbit liver VX-2 tumor model[J].World J Gastroenterol,2008,14:3997-4004.
6.田洪梓,肖林.肝脏常见病变的弥散加权成像及病理基础分析.医学综述,2011,17(5):800-801
7.聂玫,陈自谦,钱根年.磁共振弥散加权成像在肝脏占位性病变诊断中的应用[J].福州总医院学报,2011,17(4):240-241.
8.蔡磊,张伟,郭玉林.磁共振弥散成像对肝脏肿瘤的诊断价值[J].宁夏医科大学学报,2009,31(4):461-462.
9.毛瑜,陈韵彬.磁共振弥散加权成像在肝脏疾病中的临床应用[J].实用放射学杂志,2008,24(1):126-129.
10.程华才,陈家祥,马岩,等.弥散加权成像在局灶性肝脏病变中的诊断价值[J].中国CT和MRI杂志,2011,9(2):49-51.
11.封海龙,李彩英,冯平勇,等.3.0T MRI肝脏磁共振弥散加权成像定量表观弥散系数值影响因素的初探[J].临床荟萃,2010,25(21):79-82.
12.BRUEGEL M, HOLZAPFEL K, GAA J, et al.Characterization liver lesions by ADC measurements using a respiratory dif fusion-weigheed single-shot echo-planar MR imaging trecmque[J].Eur Radiol,2008,18:477-485.
13.于德新,马祥兴,张晓明,等.不同b值和测量位置的DWI参数鉴别诊断肝脏良、恶性占位性病变[J].中国医学影像技术,2009,25(5):830-832.
14.王丽杰,于钦森,于德新,等.DWI技术在肝脏占位性病变鉴别诊断中的价值[J].中国中西医结合影像学杂志,2011,9(1):1-3.
15.侯登华,陈丽军,郭玉林,等.扩散加权成像在单发结节性肝癌和血管瘤鉴别诊断中的价值[J].宁夏医科大学学报,2011,23(1)72-74.
16.黄丽丹,赵英杰,李振龙,等.探讨双b值对比法在肝脏局灶性病变诊断中的作用[J].放射学实践,2010,25(11):1253-1255.
17.刘金有.MRI诊断肝转移瘤的价值探讨[J].实用肝脏病杂志,2011,14(1):42-44.
18.李小杉,肖静,高月霞,等.原发性肝癌患者生存质量研究新进展[J].实用肝脏病杂志,2011,14(3):236-238.
19.DENIR OI,OBUZ F,SAGOL O,et al.Contribution of dif fusionweighted MRI to the dif ferential diagnosis of hepatic masses[J].Diagn Inter Radiol,2007,13(2):81-86.
20.吴秀栓,李建生,许戈良,等.超声造影在肝细胞癌诊断及治疗中的应用进展[J].实用肝脏病杂志,2011,14(2):158-160.
21.于德新,马祥兴,魏华刚,等.磁共振扩散加权成像ADC值和eADC值与肝细胞癌血管生成的关系[J].实用放射学杂志,2009,25(7):976-980.
The Value of Diffusion Weighted Imagesin Diagnosis of Liver Tumor
SONG Huai, ZHOU Li-qiang, XU Kai-peng.Department of Radiology,The People's Hospital of Shuyang, Shuyang Jiangsu 223600,China
ObjectiveTo explore the use of different bvalues and measurement position of the apparent diffusion coefficient (ADC) value and ADC value of liver perfusion in differential diagnosis of benign and malignanttum ors of the value.MethodsIn 120 patients with liver tumors underwent conven tional MRI scan and diffusion w eigh ted imaging scans, including 48 cases of liver tumors and mu ltiple phase enhanced scan.The apparen t diffusion coefficient (b) w ere 0s/mm2and 1000s/mm2, the lesions m easured overall,edge and the center of the surface diffusion coefficient (ADC) value and perfusion ADC value, analysis of different bvalue, the measured param eters in benign and malignant tum ors of the difference between.. ResultsLiver cancer, liver metastases in patients with lesions of the ADC value (1.04±0.36) × 10-3mm2/s, (1.46±0.49) × 10-3mm2/s; liver cysts, liver hem angiom as in patien ts with lesions of the ADC value (2.38±0.81) × 10-3mm2/s, (1.97±0.63) × 10-3mm2/s; bvalue of 0s/mm2, the ADC values betw een benign and malignant liver showed no statistical significance (P>0.05), ADC values of liver perfusion was statistically significant (P<0.05); when the bvalue of 1000s/mm2, the benign and malignant liver lesions in the ADC value was significantly (P<0.05), ADC values of liver perfusion was significantly(P<0.05); regions of in terest for different measu rement locations, and the cen ter edge of the lesion between the ADC values of tumorperfusion was significan tly (P<0.05); but no significant difference betw een benign tum ors (P>0.05).ConclusionMagnetic resonance diffusion imaging in the diagnosis of liver tum ors of g reat value, especially in high b-value ADC values and perfusion of the d ifferen tial d iagnosis of benign and malignant liver is m ore accurate.
Magnetic resonance imaging; diffusion-weighted imaging; apparent diffusion coefficient; livertumors; differen tial diagnosis
R73;R445.2
A
10.3969/j.issn.1009-3257.2012.05.007
宋 淮,男,副主任医师,主要从事CT和MRI的影像学诊断研究。
宋 淮
2012-06-10

