酒精性肝病患者血清铁蛋白和血清铁检测的意义
李志国 王 琦
近年来,酒精性肝病(ALD)的发病率迅速上升。酗酒伴发病毒性肝炎亦十分常见[1]。ALD 的发病机制较为复杂,酒精可对肝脏造成直接损害和间接损害,同时还与营养状态及遗传易感性密切相关。在动物试验中被证实酒精中毒可以导致肝脏铁的过度蓄积[2,3]。铁通过催化超氧化物和过氧化氢转变为更强有力的氧化剂,如羟自由基或高铁自由基,或超高铁自由基的Fenton 反应而引起氧化应激。我们检测了ALD 患者血清铁(FE)和铁蛋白(Ferr)的变化,现将结果总结、报道如下。
资料与方法
一、研究对象 选择2008年2月至2010年4月门诊就诊和住院的慢性乙型肝炎(CHB)患者95 例,临床诊断均符合2000年西安会议修订的《病毒性肝炎防治方案》的标准。其中符合慢性乙型肝炎合并ALD 患者34 例,均为男性,年龄 41~68岁,平均年龄 46.4±12.3岁;ALD 患者 75 例,男性,年龄 39~56岁,平均年龄 42.3±7.5岁。符合 2006年2月由中华医学会肝病学分会脂肪肝和酒精性肝病学组修订的酒精性肝病诊断标准,包括酒精性脂肪肝(AFL)26 例,酒精性肝炎(AH)26 例和酒精性肝硬化(ALC)23 例。另选男性健康人 30 例,年龄 34~55岁,平均年龄 41.2±9.4岁。
二、检测方法 采用放射免疫法检测血清铁蛋白;使用全自动生化分析仪测定血清铁;采用微粒子发光法检测血清乙型肝炎病毒标记物(美国雅培公司)。
三、统计学处理 采用SPSS17.0 统计软件。计量资料采用均数±标准差表示,组间比较采用单因素方差分析,多个样本的两两比较采用LSD 检验,P<0.05 为有统计学意义。
结果
一、各组人群血清铁蛋白、血清铁和生化指标的比较 见表1。
表1 3组人群血清铁蛋白、血清铁和生化指标(±s)的比较
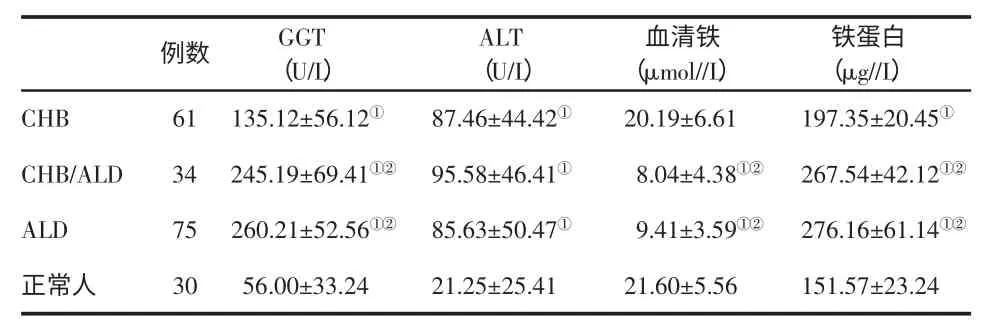
表1 3组人群血清铁蛋白、血清铁和生化指标(±s)的比较
与正常人比,①P<0.05;与 CHB 组比,②P<0.05;
?
二、不同ALD 患者血清铁蛋白、血清铁和生化指标的比较 见表2。
表2 不同ALD 患者血清铁蛋白、血清铁和部分生化指标(±s)的比较
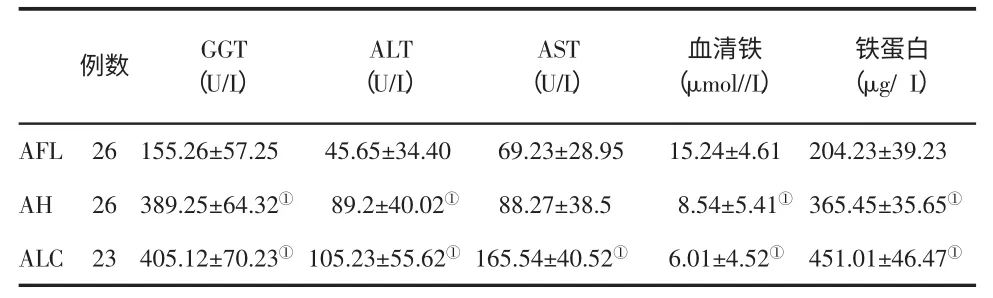
表2 不同ALD 患者血清铁蛋白、血清铁和部分生化指标(±s)的比较
与 AFL 组比,①P<0.05
AST(U/L)AFL 26 155.26±57.25 45.65±34.40 69.23±28.95 AH 26 389.25±64.32① 89.2±40.02① 88.27±38.5 ALC 23 405.12±70.23① 105.23±55.62① 165.54±40.52①例数 GGT(U/L)ALT(U/L)血清铁(μmol//L)铁蛋白(μg/ L)15.24±4.61 8.54±5.41①6.01±4.52①204.23±39.23 365.45±35.65①451.01±46.47①
讨论
《酒精性肝病诊断标准》明确推荐影像学检查和与肝脏损伤相关的各种酶学检测对ALD 诊断有所帮助,但病理学检查仍是诊断的金标准。血清GGT 增高是识别酒精造成肝损伤的良好指标,但其水平受许多药物的影响。因此,病理学检查易受穿刺部位的局限,也不能对酒精性肝病进行动态观察,故此临床迫切需要建立恰当的无创和易行的实验室检测指标。
本研究发现ALD 和ALD 合并慢性乙型肝炎患者血清铁水平显著低于正常对照组和慢性乙型肝炎,血清铁蛋白水平明显高于正常对照组和慢性乙型肝炎,说明洒精可以干扰正常的铁代谢,导致铁在肝脏的过度沉积,进而引起肝脏的损害,从而导致血清铁降低,引起铁蛋白的代偿性升高。另外,本文检测不同程度的酒精性肝病患者血清铁和血清铁蛋白,结果显示,随着酒精性肝病的程度加重,患者血清铁含量逐渐降低,血清铁蛋白和AST 逐渐增高,说明血清铁蛋白联合AST 在诊断酒精性肝病患者方面有重要意义。因此,血清铁蛋白可作为临床治疗慢性酒精中毒时观察疗效的一个指标。
酒精性肝病的发病机制复杂,除了氧化应激、脂质过氧化、内毒素、细胞因子及炎症介质的参与外,铁稳态失衡学说在酒精性肝病中的作用正逐渐受到重视。本研究结果提示在洒精性肝病患者体内血清铁蛋白水平与丙氨酸氨基转移酶和天门冬氨酸氨基转移酶平行增高,血清铁下降。在动物实验可见肝细胞中转铁蛋白受体表达上调,导致肝脏铁负荷增加[4],而应用维生素C 和没食子酸可以通过增加铁调蛋白和降低转铁蛋白受体在肝脏的表达,改善酒精性肝病铁过载,减轻肝脏的损害[5,6]。
Hepcidin 是2001年由Park 等人发现的一种由肝脏分泌的铁调蛋白。研究表明,它通过抑制肠粘膜细胞中铁转运及巨噬细胞中铁释放来调节铁代谢[7,8]。酒精通过抑制肝脏表达Hepcidin,从而导致肝脏中铁沉积,酒精代谢可以引起活性氧合成和脂质过氧化反应增强,表现为枯否细胞激活和肿瘤坏死因子-α 表达增加[9],铁与酒精呈协同作用而加重酒精性肝损伤,长期作用可使细胞坏死,并促进肝组织胶元形成,启动肝纤维化,最终发展为肝硬化。
[1]Crabb DW,Matsumoto M,Chang D,et a1.Overview of the role of alcohol dehydrogenase and aldehyde dehydrogenase and their variants in the genesis of alcohol-related pathology.Proc Nutr Soc,2004,63(1):49-63.
[2]Harrison-Findik DD,Klein E,Crist C,et a1.Iron-mediated regulation of liver hepeidin expression in rats and mice is abolished by alcohol.Hepatology,2007,46(6):1979-1985.
[3]冀杨,张亚南,康熙雄,等.铁调蛋白在大鼠酒精性肝损伤中的保护作用及其机制.中华肝脏病杂志,2011,19(4):301-304.
[4]Kohgo Y,Ohtake T,Ikuta K,et al.Dysregulation of systemic iron metabolism in alcoholic liver diseases.J Gastroenterol Hepatol,2008,23 Suppl 1:S78-81.
[5]Guo XiaoQiang,Li WenJie,Xin QiLiang,et al.Vitamin C protective role for alcoholic liver disease in mice through regulating iron metabolism.Toxicol Ind Health,2011,27(4):341-348.
[6]Ren Y,Deng F,Zhu H,et a1.Effect of epigallocatechin-3-gallate on iron overload in mice with alcoholic liver disease.Mol Biol Reports,2011,38(2):879-886.
[7]Park CH,Valore EV,Waring AJ,et al.Hepcidin,aurinary antimicrobial peptide synthesized in the liver.J Biol Chem,200l,276(11):7806-7810.
[8]Harrison-findik DD,Schafer D,Klein E,et a1.Alcohol metabolism-mediated oxidative stress down-regulates hepcidin transcription and leads to increased duodenal iron transporter expression.J Biol Chem,2006,281:22974-22982.
[9]Harrison-findik DD,Klein E,Evans J,et a1.Regulation of liver hepcidin expression by alcohol in vivo does not involve Kupffer cell activation or TNF-alpha signaling.Am J Physiol Gastrointest Liver Physiol,2009,296:112-118.

