异甘草酸镁对慢性肝病实验室指标改善的价值*
王柏芳 王 颖 王炳元 王 菲 李雪华
异甘草酸镁(Magnesium isoglycyrrhizinate,MIG)是近年国内开发的一种新的甘草酸类化合物,其为18α-异构体甘草酸,无论是单用或联合其他保肝药物,均显示良好的疗效和安全性[1~4],但对严重肝病或失代偿期慢性肝病的疗效如何仍需要研究。 我们回顾性地分析了应用MIG治疗慢性肝病患者的疗效,现报道如下。
资料与方法
一、病例选择 2010年4月~2011年4月我科住院的慢性肝病患者195例,男性161例,女性34例,平均年龄 52.1±12.7(23~90)岁。 诊断分别参考2010年中华医学会肝病学分会脂肪肝和酒精性肝病学组制定的酒精性肝病(ALD)和非酒精性脂肪性肝炎(NASH)诊疗指南[5,6]、慢性乙型肝炎防治指南[7]、丙型肝炎防治指南[8],以及2005年亚特兰大药物性肝损害(DILI)临床专题研讨会制定的标准[9]。
二、治疗方法 66例患者给予MIG注射液(江苏正大天晴药业股份有限公司)150mg静脉滴注,1次/日;129例患者给予二氯醋酸二异丙胺(丹东制药厂)80mg静脉滴注,或合并应用多烯磷脂酰胆碱(赛诺菲安万特制药有限公司)464mg静脉滴注或门冬氨酸鸟氨酸(德国麦氏大药厂)15g静脉滴注,或丁二磺酸腺苷蛋氨酸(意大利雅培)1.0g静脉滴注,或还原型谷胱甘肽(意大利斯德大药厂)1.8g静脉滴注,1次/日,均治疗2周。
三、检测 常规进行血生化和血液学检测。
四、统计学处理 应用SPSS13.0统计软件,组间计量资料比较采用中心效应的方差分析法或t 检验, 计数资料采用Fisher确切概率法计算,均为双侧检验,P<0.05为差异有统计学意义。
结 果
一、入选患者一般情况 本组入选72例ALD(肝炎 10例和肝硬化 62例)、70例 LC(乙型肝炎31例、丙型肝炎2例、原发性胆汁性肝硬化3例、肝移植术后2例、淤血性肝硬化1例和隐源性肝硬化 31例)、35例 DILI和18例 NASH。 患者接受治疗情况见表1。
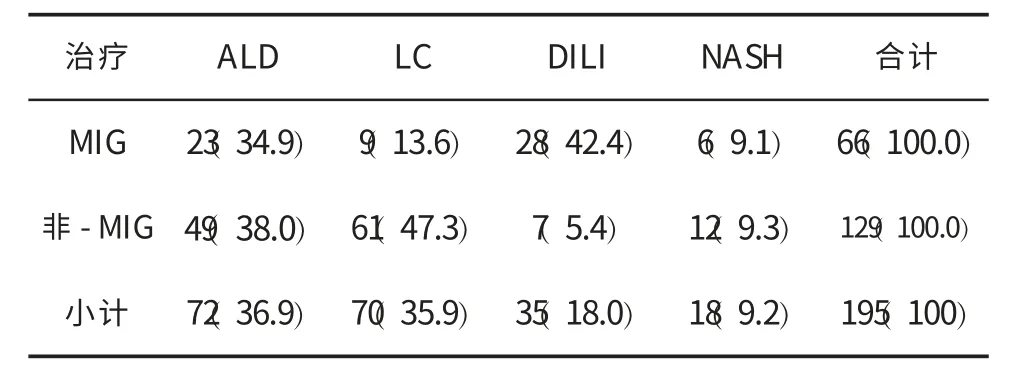
表1 入选患者百分比(%)
二、两组患者治疗后外周血液成分的变化 经过MIG治疗2周后, 患者白细胞略有升高并持续稳定,但非-MIG组治疗过程中仍变化不大; 两组患者血红蛋白和血小板基本保持不变。
三、两组患者治疗后血电解质的变化 两组在治疗过程中血电解质无明显的变化。
四、两组患者治疗前后凝血功能的变化 见表2。
表2 两组患者治疗前后凝血功能(±s)的变化
① 治疗前, MIG 组ALT、ALP、GGT 水平均显著高于非-MIG 组(t=4.03,t=3.73,t,t=4.2,P<0.01),治疗 1 周后,MIG组上述指标比非-MIG 组均明显恢复(t=3.99,t=2.74,t=3.57,P<0.01),治疗 2 周后,MIG 组与非-MIG 组上述指标均得到恢复;②治疗前,MIG 组 AST 显著高于非-MIG 组(t=3.88,P<0.01),治疗1 周时两组均恢复
?
五、两组患者治疗前后肝功能的变化 见表3、表4。
表3 两组患者治疗前后肝功能(±s)的变化
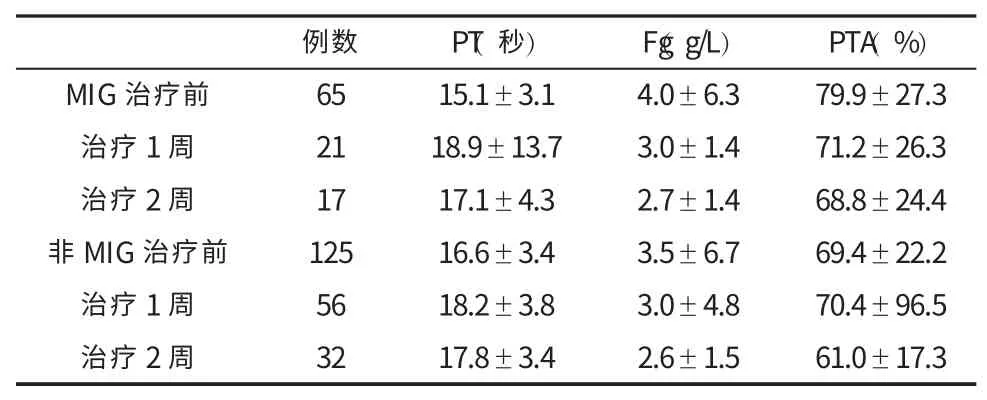
表3 两组患者治疗前后肝功能(±s)的变化
①非-MIG 组治疗前PT 比 MIG 组显著延长(t=-3.07,P=0.002),治疗 1 周后两组均比入组前延长 2~3 秒(t=0.33,P=0.75),2 周后均略恢复(t=-0.62,P=0.54);②两组治疗前Fg 水平无显著性差异(t=0.56,P=0.58),治疗 1 周和 2 周时均无显著性差异
例数 PT(秒)Fg(g/L)PTA(%)MIG治疗前 65 15.1±3.1 4.0±6.3 79.9±27.3治疗1周 21 18.9±13.7 3.0±1.4 71.2±26.3治疗2周 17 17.1±4.3 2.7±1.4 68.8±24.4非MIG治疗前 125 16.6±3.4 3.5±6.7 69.4±22.2治疗1周 56 18.2±3.8 3.0±4.8 70.4±96.5治疗2周 32 17.8±3.4 2.6±1.5 61.0±17.3
表4 两组患者治疗前后肝功能(±s)的变化
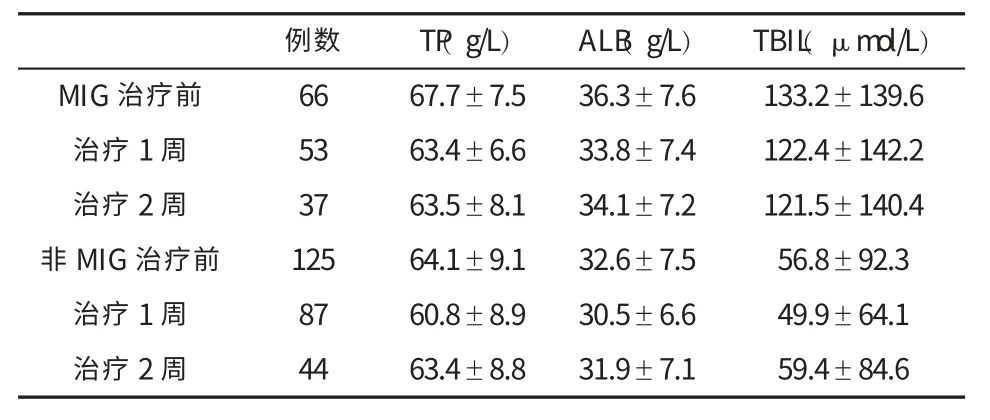
表4 两组患者治疗前后肝功能(±s)的变化
P<0.05①治疗前,MIG 组 TP 和 ALB 均显著高于非-MIG 组 (t=2.92,t=3.05,P<0.01),在治疗 1 周时,两组 TP 均有下降且无显著性差异 (t=1.88,P=0.06), 两组 ALB 也均下降 (t=2.72,P<0.01),在治疗2 周时,两组TP 和ALB 均恢复且无统计学差异(t=0.05,t=1.38,P=0.96,P=0.17); ②治疗前,MIG组 TBIL显著高于非MIG组(t=3.98,P<0.01),在治疗1周时两组均呈下降趋势(t=4.12,P<0.01),治疗 2周时非-MIG组有所上升(t=2.36,P=0.02)
L)ALB(g/L)TBIL(μmol/L)7.5 36.3±7.6 133.2±139.6 6.6 33.8±7.4 122.4±142.2治疗2周 37 63.5±8.1 34.1±7.2 121.5±140.4非MIG治疗前 125 64.1±9.1 32.6±7.5 56.8±92.3治疗1周 87 60.8±8.9 30.5±6.6 49.9±64.1治疗2周 44 63.4±8.8 31.9±7.1 59.4±84.6
讨论
有研究认为,早期使用足量的甘草酸制剂能够防止急性肝病患者的病情恶化,尤其在特定疾病患者不仅能够通过抑制肝细胞凋亡减轻肝损伤[10,11],还能够达到快速降酶的效果。
MIG 是第四代甘草酸制剂,其有效成分是一种高纯度单一 18-α 异构体甘草酸, 半衰期为 19~31h[12]。MIG 对四氯化碳、D-氨基半乳糖等引起的化学性肝损伤模型,以及刀豆蛋白A 诱导的小鼠免疫性肝损伤模型均发挥保护效应[13];明显抑制HSC 的增殖,抵抗次氮基三乙酸铁(Fe-NTA)诱导的氧应激[14]。临床随机双盲对照研究表明,MIG 注射液可以安全、有效地治疗ALT 升高的慢性肝病[1]。本研究也证明了这一点。开始选择应用MIG 治疗的患者ALT、AST、GGT 和ALP分别是非-MIG 患者的 5 倍 (P<0.01)、2.94 倍 (P<0.01)、2.41 倍(P<0.01)和 1.63 倍(P<0.01),在 MIG 治疗 2 周后,ALT、AST、GGT 和 ALP 分别是非-MIG 患者的 1.53 倍(P=0.03)、1.04 倍(P=0.79)、1.29 倍(P=0.26)和 1.1 倍(P=0.33)。
甘草酸制剂长期及联合用药的副作用主要是引起假性醛固酮症[15],限制了肝硬化,尤其是失代偿期肝硬化患者的应用。本研究入选病例特点是肝硬化达到67.69%(132/195),超过一半以上为失代偿期肝硬化。研究可见,两组药物在治疗过程中对钾、氯和镁几乎没有影响;Na+也维持在正常范围,假性醛固酮症的副作用并没有在本研究中显现, 说明MIG 的应用是比较安全的,但仍需进一步前瞻性研究。
本研究还发现一些现象值得重视,包括:①慢性肝病的营养问题,血红蛋白、总蛋白和白蛋白在所有病人中均有下降的趋势,提醒我们今后应该重视营养的平衡和及时补充; ②促血小板生成素由肝脏合成,由于MIG 改善了肝脏功能, 血小板的绝对值也会恢复,此时与脾功能亢进无关[16];③治疗1 周后PT 略有延长,除了病情改变外,可能与甘草本身的特性有关,因为甘草甜素是一种植物源性凝血酶抑制剂,在体内具有抗血栓性能[17],虽然这些改变均为一过性,但应该重视和继续研究;④隐源性肝硬化(31 例)和NASH患者(18 例)在本研究中占到 1/4 的比例,MIG 对其肝功能的改善也比较明显, 说明MIG 可抑制游离脂肪酸引起的脂毒性[18]。 这些现象和机制都需要进一步基础和临床研究证实。
[1]茅益民,曾民德,陈勇,等.异甘草酸镁治疗ALT 升高的慢性肝病的多中心、随机、双盲、多剂量、阳性药物平行对照临床研究.中华肝脏病杂志,2009,17(11):847-851.
[2]吴贻琛,李秋贞,刘鸿凌,等.异甘草酸镁治疗慢性乙型肝炎临床疗效观察.实用肝脏病杂志,2010,13(1):34-36.
[3]姜海,王华雨,薛明月,等.异甘草酸镁联合多烯磷酯酰胆碱治疗慢性乙型肝炎50 例疗效观察.实用肝脏病杂志,2011,14(2):144-145.
[4]余建国,王晓伟,程滢,等.异甘草酸镁联合舒血宁治疗慢性乙型肝炎疗效观察.实用肝脏病杂志,2012,15(1):44-45.
[5]中华医学会肝脏病学分会脂肪肝和酒精性肝病学组.酒精性肝病诊疗指南 (2010年修订版).中华肝脏病杂志,2010,18(3):167-170.
[6]中华医学会肝脏病学分会脂肪肝和酒精性肝病学组.非酒精性脂肪性肝病诊疗指南(2010年修订版).中华肝脏病杂志,2010,18(3):163-166.
[7]中华医学会肝病学分会和感染病学分会.慢性乙型肝炎防治指南(2010年版).实用肝脏病杂志,2011,14(2):81-89.
[8]中华医学会肝病学分会,中华医学会传染病与寄生虫病学分会.丙型肝炎防治指南.中华肝脏病杂志,2004,12(4):194-198.
[9]向晓星,于乐成,陈成伟.2005年亚特兰大药物性肝病临床专题研讨会介绍.肝脏,2006,11(2):123-127.
[10]Yasui S,Fujiwara K,Tawada A,et al.Efficacy of intravenous glycyrrhizin in the early stage of acute onset autoimmune hepatitis.Dig Dis Sci,2011,56(12):3638-3647.
[11]Ikeda T,Abe K,Kuroda N,et al.The inhibition of apoptosis by glycyrrhizin in hepatic injury induced by injection of lipopolysaccharide/D-galactosamine in mice.Arch Histol Cytol,2008,71(3):163-178.
[12]Sun L,Shen J,Pang X,et al.Phase I safety and pharmacokineticstudy of magnesium isoglycyrrhizinate after single and multiple intravenous dosesin Chinese healthy volunteers.J Clin Pharmacol,2007,47(6):767-773.
[13]金娟,许建明,刘晓昌,等.异甘草酸镁对刀豆蛋白A 诱导的小鼠免疫性肝损伤的保护作用.中华肝脏病杂志,2009,17(5):389-390.
[14]陈尉华, 陆伦根,曾民德,等.异甘草酸镁对大鼠肝星状细胞增殖和氧应激的影响.中华肝脏病杂志,2006,14(6):426-430.
[15]Maeda Y,Inaba N,Aoyagi M,et al.Pseudoaldosteronism caused by combined administration of cilostazol and glycyrrhizin.Intern Med,2008,47(14):1345-1348.
[16]刘鹏亮,孙杰生,王炳元,等.肝硬化患者Child-Pugh 分级与血小板生成素的关系.世界华人消化杂志,2010,18(4):392-396.
[17]Assafim M,Ferreira MS,Frattani FS,et al.Counteracting effect of glycyrrhizin on the hemostatic abnormalities induced by Bothrops jararaca snake venom.Br J Pharmacol,2006,148(6):807-813.
[18]Cheng Y,Zhang J,Shang J,et al.Prevention of free fatty acidinducedhepatic lipotoxicity in HepG2 cells by magnesium isoglycyrrhizinate in vitro.Pharmacology,2009,84(3):183-190.

