内毒素在酒精性肝病肠损伤中的作用*
聂 娇 李 鑫 徐有青
本实验观察了酒精性肝病患者内毒素水平和酒精诱导小鼠酒精性肝病肠粘膜的损伤情况。
资料与方法
一、标本来源 2010年3月~2010年10月期间来我科住院的男性酒精性肝病患者15 例,年龄47~73岁,平均年龄 56.8±9.0岁。依据 2010年中国酒精性肝病诊疗指南的标准[1]诊断。另选择男性健康人15 例,年龄17~83岁,平均年龄 46.8±18.9岁。清晨空腹抽静脉血4m1,3000rpm 离心5min,取血清备检。
二、小鼠酒精性肝病模型的建立 取SPF 级健康雄性C57/BL 小鼠20 只,重量20±3g,由北京维通利华实验动物技术有限公司提供。将小鼠适应性喂养1 周后随机分为对照组和模型组,每组10 只。对照组饲喂Lieber-Decarli 无酒精液体饲料,模型组饲喂Lieber-Decarli 含酒精饲料(北京华阜康生物科技股份有限公司,表1),饲养在室温为24±2℃,湿度为40%~70%、人工日夜循环照明(照明时间8:00am~5:00pm)的 SPF 级动物实验室。实验第 10 周末,小鼠禁食12h,3%水合氯醛(300mg.Kg-1)腹腔注射麻醉,心脏采血,加入真空管(BD 公司),3000 rpm 离心5min。另分别取肝脏组织和距肛门3cm 处结肠组织,在4%多聚甲醛中固定,制备石蜡切片,常规HE 染色。
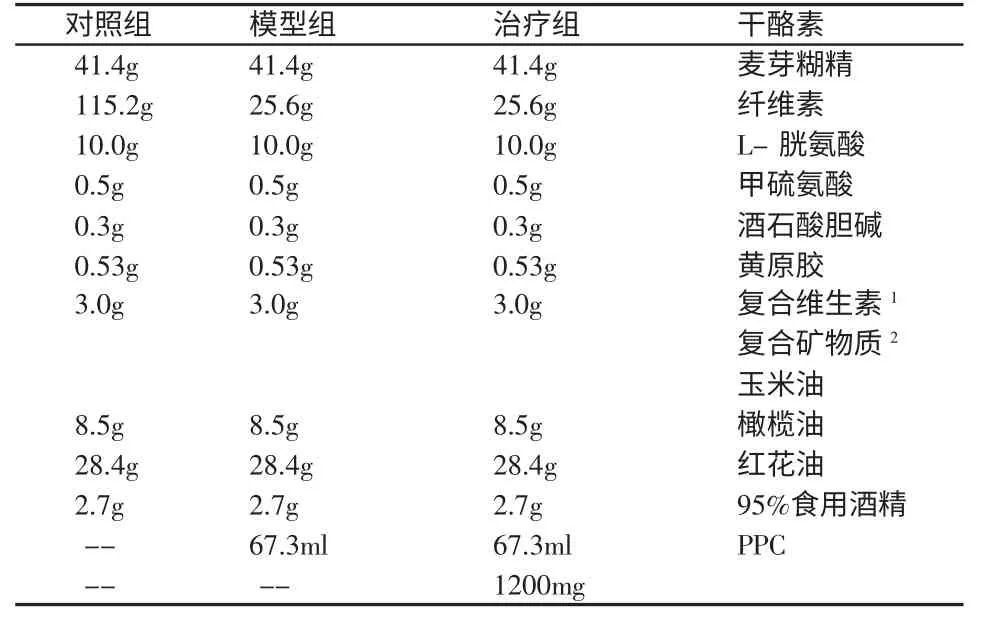
表1 Lieber-DeCarli 液体饲料成份表(1000ml)
三、肠粘膜损伤检查 在光镜下,参照Axaki Y[2]及Gulpinar MA[3]报道的结肠损伤评分法(表2)进行。每组取10 张切片,得分取均值。
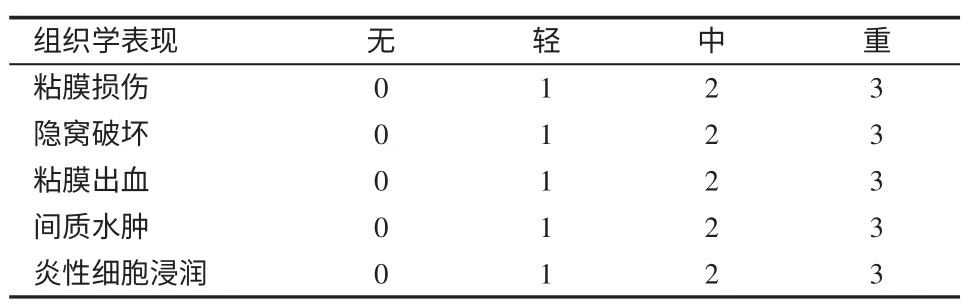
表2 病理学判断结肠损伤标准
四、血清内毒素和丙二醛(MDA)检测 采用ELISA 法(北京普生瑞达生物技术有限公司和南京建成生物有限公司试剂,VIS-7220 型分光光度计购自北京第二化学仪器厂)。
五、统计学方法 应用SPSS 17.0 软件进行统计学分析,结果以均数±标准差表示。两组间采用t检验,P<0.05 被认为有统计学意义
结果
一、血清内毒素和MDA 的比较 酒精性肝病患者血清内毒素水平较对照组明显升高,两组有统计学差异(0.52±0.54 Eu/L 对 0.47±0.34Eu/L,P=0.03)。酒精性肝病患者血清MDA 水平较对照组明显升高(5.6±5.0nmol/ml 对 3.7±3.4nmol/ml),但两组无明显统计学差异(P=0.26);酒精性肝病模型小鼠血清内毒素水平较对照组明显升高(0.38±0.05 Eu/L 对 0.13±0.02 Eu/L,P=0.00),有明显统计学意义。
二、小鼠肝脏组织学表现 对照组肝小叶结构完整、肝索排列整齐,沿中央静脉呈放射状分布(图1A)。模型组肝细胞脂肪变性明显,肝小叶排列紊乱,有明显的淤血(图1B)。
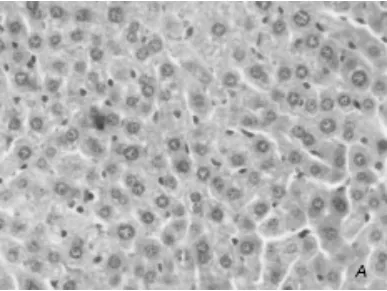
图1A 对照组肝组织 形态完整(HE,200×)
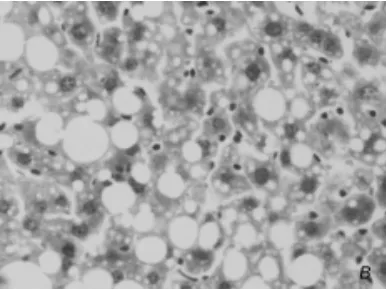
图1B 模型组肝组织 细胞脂肪变性明显,肝小叶排列紊乱,有明显的淤血(HE,200×)
三、小鼠肠粘膜形态学表现 对照组小鼠结肠粘膜层次清晰,表面光滑、整齐,粘膜上皮和腺体结构完整,无明显充血和淋巴细胞浸润(图2A);模型组小鼠结肠粘膜上皮细胞脱落,上皮细胞与固有层间距增宽,腺体结构破坏,隐窝变浅,粘膜下层水肿,但无明显的出血灶(图2B);模型组结肠组织损伤病理学评分为10.3±1.3 分,较对照组4.8±1.2分明显升高(P=0.01),有明显的统计学差异。
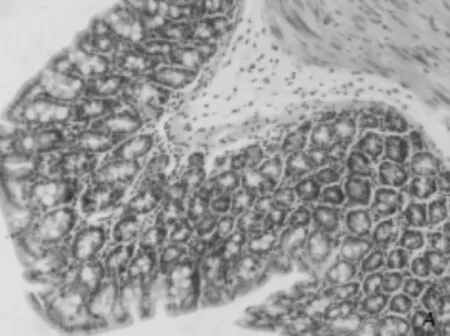
图2A 对照组肠粘膜 形态完整(HE,200×)
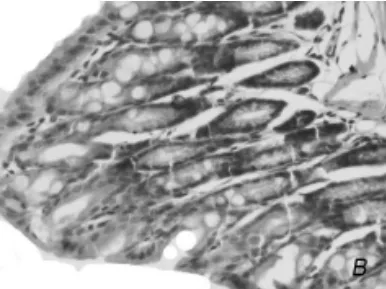
图2B 模型组肠粘膜 上皮细胞脱落,上皮细胞与固有层间距增宽,腺体结构破坏,粘膜下层水肿(HE,200×)
讨论
内毒素(LPS)是肠道革兰阴性杆菌细胞壁的脂多糖,具有高度的免疫活性,并且能诱导大量炎性介质的产生。近年来,有研究发现酒精性肝病患者血浆内毒素水平增高,并发现酒精、内毒素和肝损伤三者之间存在着一定的因果关系[4,5]。在酒精性肝病模型大鼠,注射LPS 将会加重大鼠脂肪肝的病变程度,甚至会导致大鼠肝脏的炎性坏死[6~10],而通过清除肠道细菌或抑制革兰阴性杆菌生长以降低血浆内毒素水平,可明显减轻酒精导致的肝脏损伤[11~13]。与饮酒<20g/d 的健康人相比,饮酒>60g/d 的酒精性肝病患者血浆内毒素水平明显增高。在无肝脏疾病的饮酒频繁的人群中血浆内毒素水平也是升高的[14]。但是停止酒精摄入1 周后,50%以上的轻度酒精性肝炎患者和大多数酒精性脂肪肝患者内毒素血症是可以逆转的[10]。在我们的临床研究中发现酒精性肝病组血清内毒素水平较对照组明显升高,同样证明了在酒精性肝病患者中存在着内毒素血症。
慢性酒精摄入导致血浆内毒素水平升高可能有以下几个方面的原因:(1)肠道革兰阴性杆菌过度生长,产生了过多的内毒素。Bode 等人研究证明酒精性肝病患者肠道菌群生长数是不饮酒的正常健康人的3 倍[11];(2)肠道粘膜对内毒素通透性增强;(3)肝脏库弗细胞对内毒素清除能力下降。
酒精性肝病患者是否存在着肠道损伤?在光镜下观察人体肠粘膜形态是诊断肠粘膜损伤最为直观和准确的方法,但由于在肠镜下摘取研究对象肠粘膜不仅是一种有创操作,而且易导致肠穿孔等危险并发症。所以,我们选择了检测血清丙二醛(MDA)含量,因为测量MDA 含量是一种无创操作,并且还可间接地反应组织氧自由基损害的程度和组织膜结构受损的程度。我们的研究发现,酒精性肝病组血清MDA 水平较对照组明显升高,间接证明了酒精性肝病患者存在着肠粘膜损伤。虽然两组间无明显统计学差异,考虑可能为MDA 升高有一定的时间依赖性,且与样本量大小有关。由于我们的标本来源未有明确的时间限定,我们下一步的研究将扩大样本量,分时间段测量MDA。
为更直接观察到肠粘膜的形态,我们用酒精诱导了小鼠酒精性肝病模型,观察到在小鼠酒精性肝病模型中血清内毒素水平较对照组明显升高,与我们对人体的临床研究结果相一致。在对肝脏的形态学观察中,模型组肝小叶结构破坏,明显脂肪变性,说明长期慢性的酒精摄入已引起小鼠的肝脏损伤。而通过对肠粘膜形态的观察中发现模型组小鼠结肠粘膜上皮细胞脱落,上皮细胞与固有层间距增宽,腺体结构破坏,隐窝变浅,粘膜下层水肿,进一步证明了酒精性肝病伴发了肠粘膜的损伤。
[1]中华医学会肝病学分会脂肪肝和酒精性肝病学组.中国酒精性肝病诊疗指南(2010年1月修订).现代医药卫生,2011,27(6):801-803.
[2]Arak1 Y,Andoh A,Takizawa J,et al.Clostridium butyricum,a probiotic derivative suppresses dextran sulfate sodium-induced experimental colitis in rats.Int J Mol Med,2004,13(4):577-580.
[3]Gulpinar MA,Ozbeyli D,Arbak S,et al.Acute stress ameliorates colitis via central corticotropin-releasing factor and serotonin(5-HT)-3 receptors.Turk J Med Sci,2005(35):13-19.
[4]Grant BF,Dufour MC,Harford TC.Epidemiology of alcoholic liver disease.Semin Liver Dis,1988,8(1):12-25.
[5]Leevy CM.Fatty liver: a study of 270 patients with biopsy proven fatty liver and review of the literature.Medicine(Baltimore),1962,41:249-276.
[6]Sorensen TI,Orholm M,Bentsen KD,et al.Prospective evaluation of alcohol abuse and alcoholic liver injury in men as predictors of development of cirrhosis.Lancet,1984,2:241-244.
[7]Hecht G.Innate mechanisms of epithelial host defense:spotlight on intestine.Am J Physiol,1999,27:351-358.
[8]Kim JM,Eckmann L,Savidge TC,et al.Apoptosis of human intestinal epithelial cells after bacterial invasion.J Clin Invest,1998,102:1815-1823.
[9]Purohit V,Bode JC,Bode C,et al.Alcohol,intestinal bacterial growth,intestinal permeability to endotoxin and medical consequences:summary of a symposium.Alcohol,2008,42 (5):349-361.
[10]Fukui H,Brauner B,Bode JC,et al.Plasma endotoxin concentrations in patients with alcoholic and non-alcoholic liver disease:reevaluation with an improved chromogenic assay.J Hepatol,1991,12(2):162-169.
[11]Bode C,Kolepke R,Schafer K,et al.Breath hydrogen excretion in patients with alcoholic liver disease-evidence of small intestinal bacterial overgrowth.Z Gastroenterol,1993,31(1):3-7.
[12]Pennington HL,Hall PM,Wilce PA,et al.Ethanol feeding enhances inflammatory cytokine expression in lipopolysaccharideinduced hepatitis.J Gastroenterol Hepatol,1997,12 (4):305-313.
[13]Adachi Y,Moore LE,Bradford BU,et al.Antibiotics prevent liver injury in rats following long-term exposure to ethanol.Gastroenterology,1995,108(1):218-224.
[14]Nolan JP.Intestinal endotoxins as mediators of hepatic injury:an idea whose time has come again.Hepatology,1989,10(5):887-891.

