慢病毒载体介导的结缔组织生长因子基因沉默对下游基因的影响*
彭梅娟 郝春秋 张 野 谢玉梅 张 岩 白雪帆
抑制结缔组织生长因子(CTGF)表达可减缓、抑制甚至逆转肝纤维化的进程[1~3]。我们利用前期制备的CTGF siRNA 慢病毒载体转移质粒[4],与包装质粒及包膜蛋白质粒共同包装能介导CTGF 基因沉默的慢病毒载体,感染HSC 后观察其对CTGF 及下游相关基因的抑制作用,为进一步阐明CTGF 及HSC在肝纤维化发病中的作用提供了实验依据。
材料与方法
一、细胞与材料 293T 细胞、HSC-T6 细胞、大肠杆菌菌株DH5α 均由本室保存;含有 CTGF siRNA 的慢病毒载体转移质粒 pGCL-TS1-GFP、pGCL-TS2-GFP、pGCL-TS3-GFP、pGCL-TS4-GFP由本实验室前期构建并鉴定[4],其他慢病毒载体包装系统(包括包装质粒pHelper1.0,包膜蛋白质粒p pHelper2.0)购自上海吉凯基因技术有限公司;质粒DNA 大量提取试剂盒购自Qiagen 公司;脂质体Lipofectamine 2000、Trizol 试剂、SuperScript 第 1 链cDNA 合成反转录试剂盒均购自Invitrogen 公司;SYBR Master Mix 荧光定量 PCR 试剂盒购自Takara 公司;抗CTGF 抗体、抗β-actin 抗体购自Abcam 公司;山羊抗兔 IgG-HRP、山羊抗鼠IgG-HRP 购自 Santa Cruz 公司;ECL 试剂盒购自Amersham 公司。Plus-20 离心超滤装置购自Millipore 公司。
二、含有CTGF siRNA 的慢病毒载体包装 取293T 细胞,用 DMEM(10%胎牛血清),在 37℃、5%CO2条件下培养。将对数生长期细胞于转染前24 小时接种于15cm 细胞培养皿中,转染前使细胞密度达70%~80%,取含有CTGF siRNA 的转移质粒或空 pGCL-GFP 质粒 20μg、pHelper1.0 质粒 15μg、pHelper2.0 质粒 10μg 共转染 293T 细胞,转染方法参照Lipofectamine 2000 转染试剂操作说明进行。转染 48 小时后收集上清液,3000g、4℃离心 10 分钟除去细胞碎片,用0.45μm 滤器过滤上清液,4000g 离心超滤浓缩病毒,使用逐孔稀释滴度测定法进行病毒滴度测定,保存于-80℃备用。
三、含有CTGF siRNA 的慢病毒载体感染HSC-T6 细胞 HSC-T6 细胞用 DMEM(10%),在37℃、5%CO2条件下培养。将对数生长期的细胞接种于6 孔板中,培养至细胞密度达30%~40%,以感染复数(MOI)=100 加入适量的慢病毒浓缩液,12 小时后观察细胞状态,如没有明显的细胞毒性作用则继续培养48 小时后更换培养液,感染96 小时后观察慢病毒中报告基因绿色荧光蛋白(GFP)的表达情况,收集细胞进行后续实验。
四、蛋白提取和Western 免疫印迹法筛选有效抑制序列 将感染细胞用PBS 冲洗后置于冰上,加入 150μL 裂解缓冲液(50mmol/LHEPES,pH7.0,1%NP-40,1μg/mL Aprotinin,100μg/mL PMSF),冰上裂解10 分钟,以细胞刮收集细胞并转移至离心管中,超声破碎仪破碎细胞,12000g、4℃离心15 分钟收集上清,用Bradford 法测定蛋白浓度,取40μg 总蛋白样本与上样缓冲液混合,沸水浴5 分钟,待完全冷却后上样,进行SDS-PAGE(5%浓缩胶、10%分离胶);电泳结束后400mA 恒流转移2 小时,将蛋白转移至PVDF 膜上;用封闭液(含5%脱脂牛奶的TBST 溶液)室温封闭 PVDF 膜 1 小时后加入抗CTGF 抗体或抗 β-actin 抗体,4℃孵育过夜;TBST洗膜3 次,每次10 分钟,加入山羊抗兔IgG-HRP 或山羊抗鼠IgG-HRP,室温孵育2 小时;TBST 洗膜3次,每次10 分钟,按照ECL 试剂盒说明书进行显色,在暗室中压片、化学发光自显影、洗片。
五、Real-time PCR 法筛选有效抑制序列和检测下游基因的表达 收集感染细胞,使用Trizol 试剂参照说明书提取病毒感染细胞总RNA,用DEPC处理的去离子水溶解RNA,使用SuperScript 第1链cDNA 合成试剂盒,应用随机引物合成cDNA。以cDNA 为模版,应用引物(表1)和 Real-time PCR 试剂盒对相应的目的基因进行扩增,预变性95℃ 15秒后,每个循环变性95℃ 5 秒、退火延伸60℃ 30秒,共45 个循环。
结果
一、含有不同靶向CTGF siRNA 慢病毒载体的抑制效率 分别用4 种含有不同靶向CTGF siRNA 的慢病毒载体感染HSC-T6 细胞,以不含siRNA 的慢病毒载体感染细胞作为阴性对照组,并同时设无病毒感染细胞作为对照组。6 组细胞分别进行Real-time PCR 检测其CTGF 基因表达水平。结果阴性对照组CTGF mRNA 相对表达水平为0.941±0.074,而含靶向CTGF siRNA 慢病毒载体感染细胞中 CTGF mRNA 相对表达水平分别为 TS1:0.145±0.004、TS2:0.634±0.043、TS3:0.405±0.021、TS4:0.544±0.050,与阴性对照相比,分别降低84.6%、32.6%、57.0%和42.3%,其中,TS1 组CTGF mRNA 表达水平的降低与阴性对照相比具有统计学差异(t=16.245,P=0.039)。因此,表达TS1 siRNA 的病毒抑制HSC-T6细胞中CTGF 表达的效率最高。Western 免疫印迹法检测发现内参照蛋白β-actin 的表达水平在6 组之间无明显差异,而CTGF 蛋白表达在TS1 病毒感染组显著降低(图1),提示表达TS1 siRNA 的慢病毒在蛋白水平上取得了最佳的抑制效果,与Real-time PCR 检测结果相符。因此,将表达靶向CTGF TS1 siRNA的慢病毒命名为:Len/siRNA-CTGF,不含siRNA 的慢病毒命名为:Len/siRNA-NC,用于后续实验研究。

表1 寡核苷酸引物序列
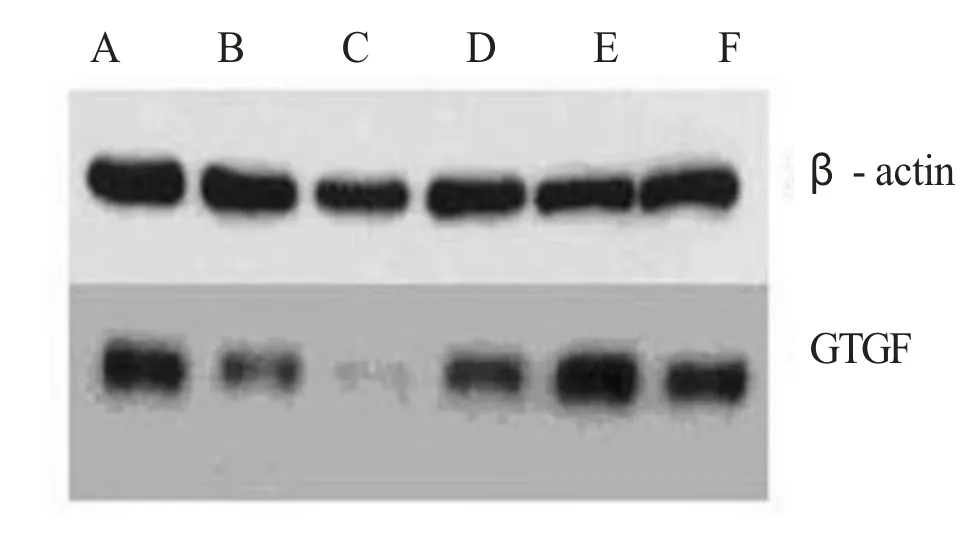
图1 各组CTGF 的蛋白表达水平
二、慢病毒载体感染HSC-T6 细胞的效率 慢病毒载体感染HSC-T6 细胞96 小时后在荧光显微镜下观察GFP 的表达情况,发现Len/siRNA-NC 和Len/siRNA-CTGF 感染的HSC-T6 细胞中都有GFP表达,感染效率大于50%(图2)。
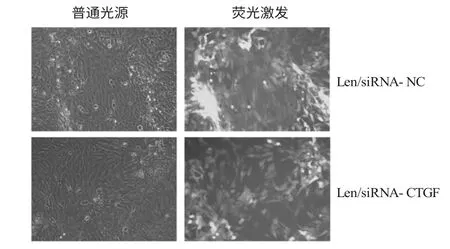
图2 HSC-T6 细胞表达GFP 情况
三、抑制CTGF 对下游基因表达的影响 应用Len/siRNA-NC 和 Len/siRNA-CTGF 感染 HSC-T6细胞,培养96 小时后收集细胞,进行RT-PCR 检测TIMP-1、TIMP-2 和 I 型胶原 mRNA 表达水平,以无病毒感染细胞作为对照组。结果发现,在CTGF被抑制的同时,TIMP-1 表达水平较阴性对照组下降约 77%(t=64.77,P=0.0002),TIMP-2 表达下降约 82%(t=244.9,P<0.0001),胶原蛋白 I 表达下降约 50%(t=9.08,P=0.011)。
讨论
CTGF 主要由HSC、纤维母细胞、平滑肌细胞和内皮细胞等分泌。研究发现,CTGF 的过度表达,特别是HSC 和纤维母细胞/ 肌纤维母细胞中CTGF 的过度表达在肝纤维化发生中可能发挥重要作用[5]。最新研究表明,CTGF 与抑癌基因p53 上调基因表达存在显著相关性,在发生纤维化的肝脏中表达水平均显著升高。p53 在人肝细胞癌细胞系中也可通过抑制miR-71-92 上调CTGF 的表达。更为重要的是,在小鼠模型中抑制肝脏中p53 蛋白的降解,可导致肝脏CTGF 合成增加,从而诱导肝细胞凋亡和自发性肝纤维化的发生,提示p53 可诱导CTGF 表达,p53/CTGF 信号通路可促进肝纤维化的进展[2]。因此,阻断CTGF 表达或抑制其活性,可能作为治疗和预防肝纤维化的靶点。
我们利用前期研究中成功构建的含有靶向CTGF siRNA 的慢病毒转移质粒,联合包装质粒和包膜蛋白质粒共同转染293T 细胞,成功包装出4株含有CTGF siRNA 的慢病毒载体,这4 株慢病毒载体均可有效感染HSC-T6 细胞,并发挥抑制CTGF mRNA 转录,这与siRNA 及慢病毒载体的作用机制相符,siRNA 发生作用的关键环节在mRNA,只要细胞中存在siRNA,无论其与细胞DNA 整合还是游离于细胞中,均可强烈抑制目的基因的转录,进而影响蛋白表达[6]。进一步应用Western 免疫印迹法也证明CTGF 蛋白表达也受到抑制,最终筛选出抑制效率最高的慢病毒重组株Len/siRNA-CTGF 作为CTGF 基因沉默的工具,为进一步研究CTGF 在HSC 活化及肝纤维化中的作用奠定了实验基础。
由于肝纤维化的病理过程复杂,CTGF 可能诱导多种下游因子,促进肝纤维化的进程。目前认为肝脏细胞外基质(extracellular matrix,ECM)的合成与降解失衡,是导致肝纤维化发展的主要机制。郭丽梅等人采用一次性大剂量二甲基亚硝胺致大鼠肝纤维化模型,在此模型中可见伴随肝细胞再生与肝组织结构修复重建,由肝星状细胞产生的ECM也不断沉积,沿着中央静脉之间形成早期肝纤维化的雏形[7]。
ECM 的降解主要由基质金属蛋白酶(matrix metalloproteinase,MMP)调控,其活性可被 TIMP 所抑制。其中,TIMP-1 在肝纤维化过程中对MMP 的活性抑制在TIMP 家族中作用最强[8]。激活的HSC可使TIMP-1 表达增加,继而抑制MMP 活性,使肝脏ECM不能及时降解,造成堆积,导致肝纤维化乃至肝硬化的发生[9]。同时,在正常情况下,HSC 合成的胶原蛋白以III、IV 型为主,而I 型胶原较少,而在肝纤维化时肝脏Disse 间隙中存在大量的I 型胶原[10]。我们的研究也发现,在CTGF 表达抑制的同时,也可导致 TIMP-1、TIMP-2 和 I 型胶原 mRNA 转录水平显著降低,提示CTGF 可能通过增强TIMP 和I型胶原的表达,诱导ECM在肝脏的沉积。CTGF 促进 ECM 合成,TIMP-1 抑制 ECM 降解,在肝纤维化发生过程中发挥协同促进作用[11]。本研究为进一步阐明CTGF 及HSC 在肝纤维化中的作用机制和防治肝纤维化奠定了理论和实验基础。
[1]Dessein A,Chevillard C,Arnaud V,et al.Variants of CTGF are associated with hepatic fibrosis in Chinese,Sudanese,and Brazilians infected with schistosomes.J Exp Med,2009,206(11):2321-2328.
[2]Kodama T,Takehara T,Hikita H,et al.Increases in p53 expression induce CTGF synthesis by mouse and human hepatocytes and result in liver fibrosis in mice.Clin Invest,2011,Jul 11.pii: 44957.doi: 10.1172/JCI44957.
[3]Tong Z,Chen R,Alt DS,et al.Susceptibility to liver fibrosis in mice expressing a connective tissue growth factor transgene in hepatocytes.Hepatology,2009,50(3),939-947.
[4]彭梅娟,郝春秋,白雪帆,等.介导大鼠结缔组织生长因子基因沉默的慢病毒载体转移质粒的构建及鉴定.生物技术通讯,2008,9(3):350-352.
[5]Hayashi N,Kakimuma T,Soma Y,et al.Connective tissue growth factor is directly related to liver fibrosis.Hepatogastroenterology,2002,49(43):133-135.
[6]Wang X,Chen Y,Ren J,et.al.Small interfering RNA for effective cancer therapies.Mini Rev Med Chem,2011,11(2):114-124.
[7]郭丽梅,林梅,陆珊,等.一次性大剂量二甲基亚硝胺致大鼠肝纤维化模型中肝星状细胞的病理变化.实用肝脏病杂志,2009,8(12):244-247.
[8]Brew K,Dinakarpandian D,Nagase H.Tissue inhibitors of metalloproteinases:evolution,structure and function.Biochim Biophys Acta,2000,1477(1-2):267-283.
[9]Yoshiji H,Kuriyama S,Miyamoto Y,et al.Tissue inhibitor of metalloproteinases-1 promotes liver fibrosis development in a transgenic mouse model.Hepatology,2000,32(6):1248-1254.
[10]Lotersztajn S,Julien B,Teixeira-Clerc F,et al.Hepatic fibrosis:molecular mechanisms and drug targets.Annu Rev Pharmacol Toxicol,2005,45:605-628.
[11]蒋玉凤,黄飞,张建军,等.结缔组织生长因子和金属蛋白酶组织抑制因子-1RNA 干扰靶位的筛选.实用肝脏病杂志,2011,8(14):246-248.

