拉曼光谱技术在肉品科学研究中的应用
陈 倩,李沛军,孔保华
拉曼光谱技术在肉品科学研究中的应用
陈 倩,李沛军,孔保华*
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
拉曼光谱技术作为新颖的光谱检测技术在物质理化结构分析方面得到了广泛应用。该技术能实现对肉的快速、无损检测,是肉品成分分析的技术之一,并且其光谱对水等极性物质极其不敏感,因此在肉品研究中具有良好的应用前景。本文简述拉曼光谱技术的基本原理及分类,综述其在肉品成分分析和品质评定方面的应用,并对该技术在今后肉品科学研究中的应用进行展望。
拉曼光谱;肉品科学;成分分析;品质鉴定
拉曼光谱(Raman spectroscopy)技术是一门基于拉曼散射效应而发展起来的光谱分析技术,可提供分子的振动或转动信息。拉曼光谱技术同化学分析技术和其他光谱技术相比,具有快速原位无损伤检测,样品不需处理,使用样品量少等特点[1]。随着拉曼光谱技术的发展[2],其已被广泛应用到石油化工[3]、生物医药[4]、考古艺术[5]和法医鉴定[6]等领域。基于拉曼光谱技术的诸多优点,其在肉品中也得到了应用。本文从拉曼光谱技术的原理出发,综述该技术在肉品成分分析和品质评定中的应用,为将来开发相应的在线检测设备提供基础。
1 拉曼光谱技术的原理
拉曼光谱原理是拉曼散射效应,它是分子对光子的一种非弹性散射效应。处于基态的样品分子受到能量为hv0外来光子的激发后,其能态上升至一个不稳定的中间状态,样品分子在离开这个中间状态时随机辐射光子。激发光的光子与物质分子相碰撞,可产生弹性碰撞和非弹性碰撞。在弹性碰撞过程中,二者未发生能量交换,光子频率保持恒定,这种散射现象称为瑞利散射,如图1a所示。在非弹性碰撞过程中,光子与分子有能量交换,光子转移一部分能量给散射分子,或者从散射分子中吸收一部分能量,从而使其频率改变,它取自或给予散射分子的能量只能是分子两定态之间的差值△E=E1-E2,而不同的化学键或基团有不同的振动能级,△E可反映指定能级的变化。因此,与之相应的光子频率变化也是具有特征性的,根据光子频率变化就可以判断出分子中所含有的化学键或基团,这就是拉曼光谱可以分析分子结构的基础。当光子把一部分能量交给分子时,光子则以较小的频率散射出去,称为斯托克斯散射,散射分子接受的能量转变成为分子的振动或转动能量,从而处于激发态E1,如图1b所示,这时的光子的频率为ν'=ν0-Δν;当分子已经处于振动或转动的激发态E1时,光子则从散射分子中取得了能量ΔE(振动或转动能量),以较大的频率散射,称为反斯托克斯散射,这时的光子的频率为ν'=ν0+Δν。这两种散射均属于拉曼散射。
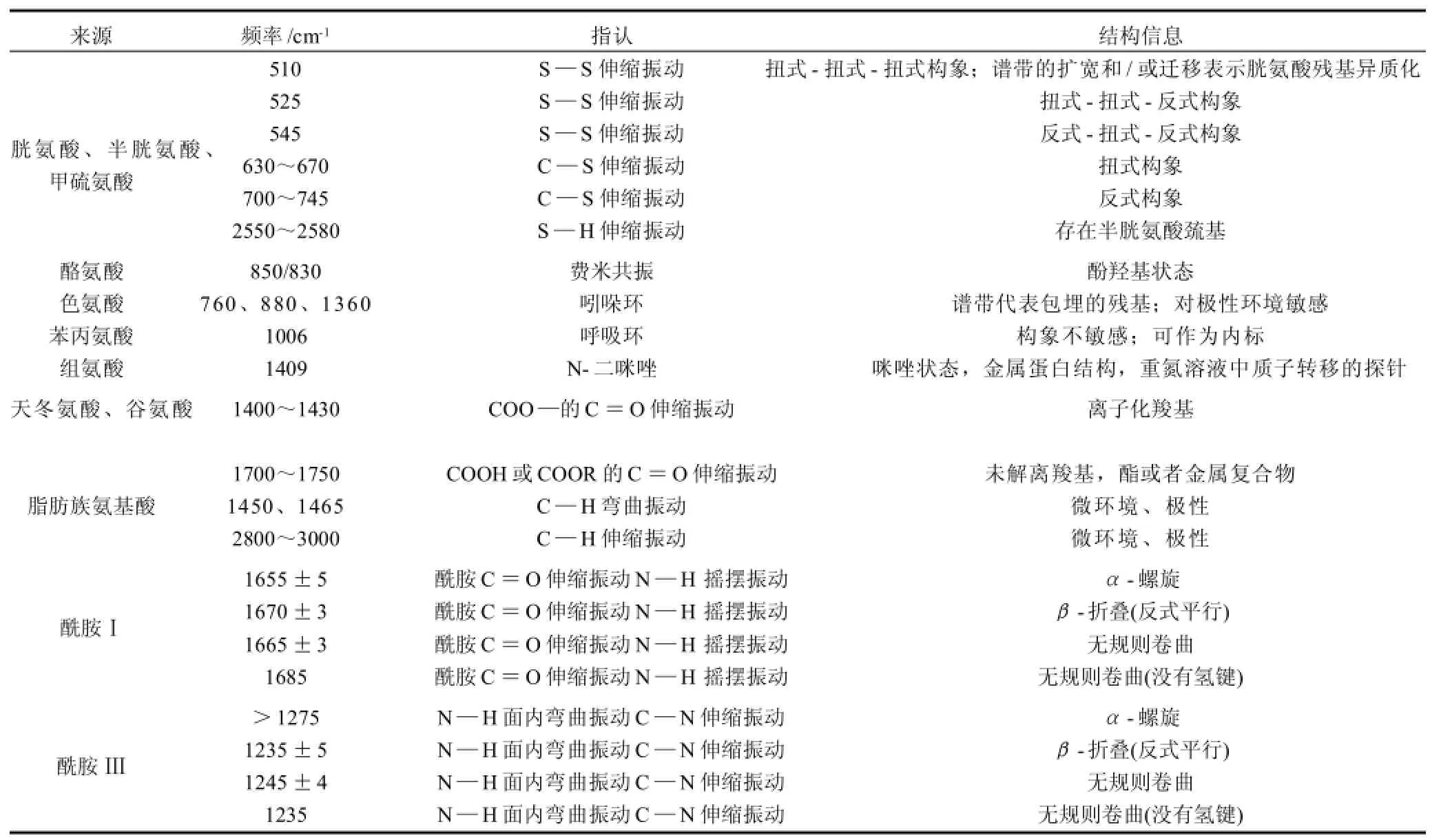
表1 蛋白质结构中有用的拉曼振动模式[7]Table 1 Raman modes useful in interpretation of protein structure[7]
由于斯托克斯散射比反斯托克斯散射强的多,因此光谱仪检测的主要是斯托克斯散射。其拉曼频移、拉曼强度及线宽反映的是拉曼样品池中散射物质的特性,与物质分子的振动和转动有关。从特征拉曼频率可以确定分子中的原子团和化学键的存在,从相对强度的变化能够确定化学键的含量,而物质化学环境的变化则会引起拉曼特征频率的微小位移,从特征频率位移的大小和方向能判定原子团和化学键所处化学环境的变化[7]。拉曼光谱对对称结构分子检测很有效,与红外光谱在分析分子结构中互相补充,一些基团红外吸收很弱,但拉曼散射却很强,如C—C、C=C、N=N和S—S等基团。另外,水的红外吸收很强,但它的拉曼散射却很弱,因此拉曼光谱技术特别适合水溶液体系[8]。
随着激光技术的发展,拉曼光谱技术也发展了多种分析技术,如傅里叶变换拉曼光谱技术、表面增强拉曼光谱技术、激光拉曼光谱技术和共焦显微拉曼光谱技术等[9]。
2 拉曼光谱技术在肉品成分分析中的应用
从肉的化学组成上分析,主要有蛋白质、脂肪、水分、浸出物、维生素和矿物质6种。其中蛋白质和脂肪对肉的品质影响较显著,如肌肉蛋白对肉品的质地和保水性有直接影响,肌肉内脂肪的含量会影响肉的风味和嫩度。
2.1 对肉中蛋白质的检测
蛋白质对肌肉食品的组织特性及功能特性有着重要的贡献,决定着终产品的品质。蛋白质的功能特性(溶解性、凝胶性和持水性等)和组织特性与其高级结构有关,主要包括二级结构(α-螺旋、β-折叠和无规则卷曲等)、三级结构(二级结构的空间作用)和四级结构(亚基间的相互作用)。这些结构通过不同类型的相互作用来维持氢键、疏水相互作用、静电力以及范德华力等[10]。

图1 瑞利和拉曼散射示意图Fig.1 Schematic diagram of Rayleigh and Raman scattering
2.1.1 蛋白质拉曼光谱谱带的指认
拉曼谱带可以提供蛋白质化学基团变化的信息,利用这些信息可以预测溶液、固体、凝胶或结晶状态的蛋白质二级结构和微环境。Li-Chan[7]、Herrero[10]等基于早期的研究结果对蛋白质拉曼光谱图中的谱带进行了指认与分析,酰胺Ⅰ和酰胺Ⅲ的骨架振动模式和氨基酸侧链(胱氨酸和半胱氨酸的S—S和S—H伸缩振动)以及C—C伸缩振动等模式反映了二级结构的变化;酪氨酸、色氨酸双峰以及和苯丙氨酸等芳香族氨基酸残基的振动可以反映微环境的变化,相关各个谱带指认见表1。在肌肉食品体系中,蛋白质这些结构的变化可为研究其腐败变质的机理提供信息,进而改善其处理、加工和贮藏条件。
2.1.2 从肌肉中分离出的蛋白质的检测
拉曼光谱技术已经应用到了分离出的肌原纤维蛋白和基质蛋白结构的测定中,这些蛋白对肌肉的组织和功能特性有着重要的贡献,但是特别易受加工处理以及贮藏条件的影响。肌肉中的肌原纤维蛋白主要包括肌球蛋白、肌动蛋白、肌原蛋白和原肌球蛋白等。其中肌球蛋白占主导,它是一种非对称蛋白,由头部和一部分尾部构成的重酶解肌球蛋白和尾部的轻酶解肌球蛋白两部分构成。Carew等[11]利用拉曼光谱技术确定并研究了从兔肉中分离出的肌球蛋白结构。酰胺Ⅲ区域(1265cm-1和1304cm-1)中α-螺旋构象的谱带对应肌球蛋白的尾部结构,1244cm-1处指认为β-折叠和无规则卷曲结构的谱带以及1265cm-1处的肩峰谱带对应肌球蛋白的头部结构。Sultanbawa等[12]从鳕鱼中提取了肌动球蛋白,研究其在添加抗冻保护剂后结构的变化。拉曼光谱结果表明,添加抗冻保护剂后进行冻藏的肌动球蛋白,其酰胺Ⅰ、酰胺Ⅲ以及C—C伸缩振动有变化,表明了其二级结构发生了变化。这些结果为利用拉曼技术研究肌原纤维蛋白的构象提供了信息。
胶原蛋白是结缔组织中主要的蛋白,含有大量的甘氨酸、脯氨酸和羟脯氨酸,它的结构对肌肉的质构特性有影响。Badii等[13]分别从新鲜的和解冻后的鳕鱼结缔组织中提取胶原蛋白,研究冻藏条件、甲醛以及鱼油对胶原蛋白的影响。结果表明,冻结的胶原蛋白添加甲醛或者鱼油后贮藏在-10℃条件下,酰胺Ⅰ区域(1660cm-1)强度的增加表明了其二级结构发生了变化。
2.1.3 肌肉中蛋白质的检测
基于拉曼光谱可以进行无损原位检测的特点,可将其直接应用到未经处理的肉样上,研究食品体系中天然蛋白质的相互作用以及构象改变。Careche[14]、Herrero[15]等利用拉曼光谱技术对冻藏期间的鱼肉蛋白结构进行了原位检测。Careche等[14]研究表明新鲜狗鳕鱼(hake)鱼肉与在-10℃和-30℃条件下冻藏10个月后的Hake鱼肉的拉曼光谱存在差异,在-10℃条件下蛋白结构变化更显著。比较新鲜的和冻藏的鱼肉酰胺Ⅰ谱带(1650~1680cm-1)发现,冷冻的鱼肉拉曼光谱波峰向高波数方向移动,推测这与α-螺旋结构含量的减少有关,同时伴随着酰胺Ⅲ谱带(1240~1225cm-1)强度的增加,说明β-折叠构象含量增加,另外759cm-1强度的减弱,说明包埋的色氨酸残基暴露了。Herrero等[15]也研究了在同样的冻藏温度(-10℃和-30℃)下狗鳕鱼肌肉蛋白的结构变化,图谱结果显示,酰胺Ⅰ和酰胺Ⅲ在940cm-1处谱带发生了变化以及色氨酸谱带(759cm-1)强度的减弱,这些现象说明了α-螺旋向β-折叠构象的转化,这与Careche等[14]的研究结果一致。
2.1.4 凝胶特性的分析
由于凝胶对肌肉食品的品质起着关键性的作用,所以研究其在加工和贮存过程中,因外界环境的改变而引起的变化是很必要的。以下是拉曼光谱技术在肌肉蛋白质凝胶和肉糜凝胶特性测定中的应用。
2.1.4.1 蛋白质凝胶特性的分析
肌肉蛋白凝胶是决定肉品品质的关键因素,对产品的质构、组织结构、保水性和与食品中其他成分的交互作用有重要作用[16],因此许多研究将肌肉蛋白从肌肉中分离出来并制备成凝胶,利用拉曼光谱技术研究分离出的蛋白的凝胶特性。Xu Xinglian等[17]研究了温度对猪肉肌原纤维蛋白凝胶特性的影响,并确定了凝胶结构变化与功能特性间的关系,结果表明,随着温度的升高α-螺旋含量降低,伴随着β-折叠含量的显著增加,同时二硫键构象发生变化,疏水相互作用也参与其中,这些变化对形成较硬而具有不可逆性的凝胶有很大的贡献,并且确定了50~60℃是猪肉肌原纤维蛋白热诱导凝胶的关键区域。此外,Chen等[18]采用了拉曼光谱研究了微生物转谷酰胺酶对猪肉肌原纤维蛋白凝胶结构的变化,添加转谷酰胺酶后凝胶光谱图表明,α-螺旋含量减少,伴随着β-折叠、β-转角和无规则卷曲含量的增加,这些变化会形成强而不可逆的热诱导凝胶。
猪血是屠宰厂中的主要副产物,其中血浆蛋白因其良好的凝胶特性而受到重视Davila等[19]借助拉曼光谱分析技术研究了存在于血浆中的3种主要蛋白质(纤维蛋白原、白蛋白和球蛋白)热诱导凝胶过程中的相互作用,通过图谱可知,在凝胶过程中纤维蛋白原和白蛋白发生了相互作用,造成纤维蛋白原二硫键构象变化,疏水基团包埋以及β-折叠构象含量减少等变化;同时发现,纤维蛋白原可以减少热诱导凝胶过程中α-螺旋含量减少程度;白蛋白与球蛋白间的相互作用使得二硫键增多,疏水残基暴露,并且当混合物中球蛋白含量居多时,其构象受白蛋白的影响,尽管其他质构特性会有所改变,但热力学性质不受影响。
2.1.4.2 肉糜凝胶特性的分析
随着肉糜制品的发展,对肉糜凝胶特性的研究也逐渐多了起来。Liu Ru等[20]采用拉曼光谱技术研究了鱼肉和猪肉两种不同肉糜经不同温度处理后其热诱导凝胶的构象及分子间相互作用的变化。通过光谱图中指认为二硫键的谱带(500~550cm-1)、酪氨酸双峰比值的变化,对应二级结构酰胺Ⅰ和酰胺Ⅲ谱带的变化,以及脂肪族氨基酸C—H振动等变化说明随着温度的升高,疏水交互作用先升高后降低。对于鱼肉而言,二硫键的形成主要是在70~80℃范围内,而猪肉是在50~60℃范围内;对于鱼肉而言,4~40℃诱导可以形成大量的非二硫共价交联,而猪肉不能形成。此外,Sanchez-Gonzalez等[21]研究了鱼肉由肉糜变成溶胶再到凝胶的过程中蛋白质结构的变化,表明其变化主要表现在酰胺Ⅰ和酰胺Ⅲ中α-螺旋、β-折叠构象变化、酪氨酸双峰比值改变以及脂肪族氨基酸C—H波峰的移动等方面,这些变化对形成黏而有弹性的凝胶有贡献。
膳食纤维具有很强的吸水能力或与水结合的能力,可以赋予肉制品很好的质构特性,并且具有预防心血管疾病和癌症等疾病的作用。Sanchez-Gonzalez等[22]通过向鱼糜中添加小麦膳食纤维(WDF),研究其对鱼糜凝胶的影响。结果图谱中—CH峰波向高波数方向移动,并且伴随着峰强度的降低,这些表明WDF发生了水合作用,因为在鱼糜形成凝胶过程中,WDF结合了凝胶中的水。由于WDF的水合作用,纤维既获得了蛋白凝胶中的水分,使蛋白质形成了β-折叠以及疏水相互作用,又做了脱水剂。另外,经添加WDF和加热协同作用,易于形成β-转角,这对形成非特异性聚集有贡献。另外,膳食纤维使得溶胶状态的蛋白三级结构发生了变化,特别是疏水侧链的微环境的变化,使其暴露在溶液中的量增多,同时—CH强度的减弱也表明了蛋白质和纤维素间发生了疏水相互作用。这些结果对添加纤维素的重组鱼糜制品的研究具有一定的意义。
2.2 对肉中脂肪的检测
脂肪是影响肌肉食品品质的重要因素,它不仅是风味物质的前体,也是引起氧化变质的主要成分。肉的氧化变质取决于脂肪酸的不饱和程度[23],具有高不饱和度脂肪酸的肉制品容易发生脂肪氧化,形成腐败味。因此控制不饱和脂肪酸的含量可以有效地避免在贮藏和加工过程中肉品的氧化问题。Lo Fiego等[24]指出,腌肉制品对原材料的要求很严格,需要控制原材料的碘值,否则会引起终产品的酸败。因此,要对脂肪含量以及脂肪酸组成进行研究。
在拉曼光谱中,脂肪结构的变化主要通过以下一些谱带来反映[25]:—CH伸缩振动、C=O伸缩振动、—CH2剪切振动以及C—C伸缩振动等。脂肪的氧化以及脂肪同其他成分(比如蛋白质)作用等都会引起结构的变化。另外,可以通过1660cm-1处的C=C伸缩谱带与1750cm-1处的C=O伸缩谱带或者1445cm-1处的—CH2剪切振动谱带的比值来定量分析脂肪的不饱和度。
3 拉曼光谱技术在肉品品质评价中的应用
肉在加工、贮藏过程中,其主要成分蛋白质和脂肪等大分子都会发生变化,伴随着其功能性和组织特性的变化,进而影响其风味、色泽、质地和保水性等品质方面的变化,通过拉曼光谱图可以定性地分析肉品中这些成分的分子结构和各种基团之间的关系,进而检测肉品的品质,此外还可以根据拉曼光谱峰强度与被测物质浓度成正比的关系进行半定量分析。
3.1 肉色成分分析
肉色是肉质评定的重要指标之一。肉色主要取决于肉中肌红蛋白(myoglobin,Mb)和血红蛋白(hemoglobin,Hb)两大色素蛋白的含量及化学状态。在放血充分的条件下,肌红蛋白的比例可达到80%~90%,是构成肉色的主要因素。肌红蛋白由一条珠蛋白多肽链和一个血红素辅基(heme group)结合而成的复合蛋白质,它的呈色作用源于其分子内的亚铁血红素。肌红蛋白与血红蛋白的主要差别是前者只结合一分子的血色素,而血红蛋白结合四分子的血红素[26]。肌红蛋白在可见区420nm波长处有一个很强的storet吸收带,以及在500~600nm区域有弱的Q带吸收,因此是共振拉曼光谱研究的一种很好的目标分子[27]。因此,可利用拉曼光谱技术来研究肌肉中这些色素蛋白的结构变化,为提高肉品的色泽品质提供信息。
3.1.1 肌红蛋白及其衍生物的测定
腌肉制品因其特殊的风味与色泽深受消费者喜爱,其特征性的粉红色是腌制剂亚硝酸盐与肌红蛋白作用生成的一氧化氮肌红蛋白(MbNO)所致。李涛等[28]利用纳秒瞬态拉曼光谱技术研究小分子配体NO与肌红蛋白Mb结合的动力学过程,通过考察MbNO光解后产物脱氧肌红蛋白与反应物MbNO的ν4特征振动峰的强度比值随激光激发功率的变化,阐述了利用纳秒瞬态拉曼光谱技术研究MbNO体系中NO与脱氧肌红蛋白结合过程的可行性。可见拉曼光谱技术为研究MbNO的形成过程以及检测提供了新途径。
腌肉色素MbNO加热后珠蛋白变性,随后与血红素分离,由鲜肉的MbNO变成了蒸煮腌肉的亚硝酰血红素化合物,对这种化合物的结构一直存在争议。Sun等[29]通过比较煮制后腌肉色素(CCMP)氧化前后拉曼光谱的变化,研究了它的结构和氧化特性。CCMP提取物经自然光和过氧化氢氧化后,鉴定其结构是五位配位-亚硝酰血红素化合物。图谱的变化表明在自然光氧化过程中—NO基团并没有从Fe卟啉环分子中解离出来,但是其共振共轭结构发生了变化。
随着高压处理技术在肉制品中的广泛应用,使得其作用后的肉品品质也得到了相应的研究。Wackerbarth等[30]采用共振拉曼光谱技术研究了经600~700MPa高压处理后猪肉中的肌红蛋白结构的变化。结果表明,无损伤未加压处理的肉组织光谱图呈现出Fe2+去氧肌红蛋白的共振拉曼光谱,但是经过加压处理后形成了六位配位的Fe2+低自旋态的新的Mb种类,指认这种蛋白是双组氨酸复合物,这种结构上的变化与血红素电子跃迁的改变有关,这样会影响肉色;相反,提取并经过压力和非加压处理的猪肉的Mb,其水溶液的共振拉曼光谱图中氧合肌红蛋白的特征峰增加,这是由于溶液中有能结合O2的蛋白质存在,经加压处理后提取的肌红蛋白水溶液,氧合形式部分转化为高铁形式,表明了高压使血红素发生氧化。因此,结构的变化不仅引起了颜色的变化,而且可能诱发不希望发生的氧化副反应,涉及到更进一步肉成分的变化。他们提出在氧合肌红蛋白/去氧合肌红蛋白比值很小之前进行加压处理,可以很大程度上避免以上现象。Tintchev等[31]也用拉曼光谱技术研究了600MPa高压处理后的大马哈鱼(salmon)的肌红蛋白和血红蛋白结构的变化,高压处理后Met-Mb和Met-Hb发生了氧化还原反应。
3.1.2 血红蛋白及其衍生物的测定
亚硝酸盐也会与血红蛋白反应生成亚硝基血红蛋白,它可以代替亚硝酸盐作为肉品的着色剂。沈高山等[32]采用显微拉曼光谱技术研究了NaNO2与氧合血红蛋白(HbO2)在水溶液中的相互作用,监测到不同浓度的NaNO2对不同浓度的HbO2的反应,血红蛋白分子的结构发生了改变且其浓度降低,表现在HbO2特征峰570cm-1与水合高铁血红蛋白特征峰495cm-1强度的比值I570/I494,以及铁离子低自旋态与高自旋态特征峰强度比值I1586/I1555均减少,对Hb氧化态敏感的特征峰向低波数方向移动,对卟啉环中心孔径大小敏感的峰向高波数方向移动。该研究为氧和血红蛋白和水合高铁血红蛋白的结构分析与反应机理提供了有效参考。
目前,拉曼光谱技术主要是应用到各种色素蛋白的结构鉴定与分析方面,并没有实现对肉色的直接检测,如果在进行肉质的感官特征评定时,拉曼光谱技术与其他技术结合,则在一定程度上可能提高在线检测效率和实际的经济效益。
3.2 肉的保水性评价
保水性是肌肉受外力作用下其保持原有水分与添加水分的能力,它对肉的品质有很大的影响,是肉质评定时的重要指标之一。保水力的高低可直接影响到肉的风味、颜色、质地和嫩度等。与传统测定保水性的方法相比,拉曼光谱技术虽不能准确地测定出肉的保水性,但是能够快速地分析推测出保水性。
Pedersen等[33]利用拉曼光谱PLSR建模方法预测新鲜猪肉的滴水损失,发现具有良好的相关性(r=0.95~0.98)。拉曼图谱表明,保水性与位于876~951cm-1和3071~3128cm-1附近的谱带有关。此外,关于冻藏对鱼肉保水性的影响也有报道,Herrero等[34]研究不同冻藏温度(-10℃和-30℃)条件下的狗鳕(hake)鱼肉微观结构的变化与水的拉曼谱带(3100~3500cm-1和50~600cm-1)特征,通过研究这些变化来确定其保水性。结果表明,160cm-1处谱带增强与肌肉蛋白质的构象转化有关,与肌肉中的水分子结构也有关。在冻藏的过程中,νs(OH)强度增加可能为水分子提供了更大的结构空间。利用拉曼光谱技术测定肉品的保水性从而实现屠宰当天鲜肉的分级,具有广阔的应用前景。研究结果显示,拉曼光谱对宰后早期肉的保水性具有较好的相关性。
3.3 肉中脂肪氧化的测定
拉曼光谱技术在肉品脂肪检测方面的应用较少,研究多集中在脂肪酸组成问题上,并通过建立数学模型来进行定量分析。Olsen等[35]利用拉曼光谱技术快速分析并定量检测了猪肉脂肪组织中的和处理后融化状态的脂肪中的饱和、单不饱和、多不饱和脂肪酸以及碘值。其采用了多种建模方法进行了定量分析和辨别。另外,他们指出拉曼技术有望用于猪肉胴体的在线检测,在60s内完成脂肪酸不饱和度的检测。随后Olsen等[36]又研究了检测猪肉脂肪组织碘值的拉曼仪的长期稳定性。结果表明,可在同一台仪器上完成3年后测量的光谱的模式转化。刘德燕等[37]采用多种建模方法对4种不同的动物食品(鸡肉、牛肉、羊肉和猪肉)中脂肪酸进行了定量分析和判别。
此外,利用拉曼光谱技术还可以研究经冻干和冻藏后的肉中脂质的结构。Sarkardei 等[25]利用傅里叶拉曼光谱定量的分析了马鲛鱼(horse mackerel,Trachurus trachurus)和大西洋马鲛(Atlantic mackerel,Scomber scombrus)这两种鱼的脂质。从冻干和贮藏12周的马鲛鱼和大西洋马鲛中提取油,图谱中指认为—CH2伸缩和C=O酯伸缩的谱带强度均有显著减少。3011cm-1和2960~2850cm-1处的谱带强度增加证明了上述结果,这就表明了脂质结构发生了变化,涉及到了—CH基团和疏水相互作用的变化。与马鲛鱼相比, 大西洋马鲛脂质结构变化更明显,这可能是因为其二十碳五烯酸(EPA)含量较高的缘故,另外大西洋马鲛中多不饱和脂肪酸含量较高,也使得其更容易发生氧化。他们也指出了脂质的氧化会影响鱼肉肌原纤维蛋白的溶解性和提取性,这是由于分子间发生交联作用以及疏水相互作用使得蛋白质二级结构发生了变化。
3.4 肌肉嫩度与多汁性评价
肉的嫩度是重要的食用品质之一,它是指肉在食用时口感的老嫩,反应了肉的质地。Beattie等[38]通过拉曼光谱技术对煮制后的牛肉进行原位检测,研究其蛋白结构的变化,建立了嫩度和多汁性与拉曼光谱数据之间的联系,结果表明其具有良好的相关性。牛肉的酰胺Ⅰ(1669cm-1)和酰胺Ⅲ(1235cm-1)两处谱带强度增加与β-折叠含量的增加有关;1445cm-1处谱带对微环境和疏水相互作用很敏感,该处谱带强度的增加表明牛肉疏水相互作用力增强。以上结果表明了蛋白质中α-螺旋和β-折叠的比值以及蛋白质环境的疏水性等对煮制牛肉的感官和质构特性有重要影响。同时发现,反应疏水相互作用的1460~1483cm-1(—CH2和—CH3弯曲振动)区域谱带与多汁性密切相关。
4 结 语
拉曼光谱技术在肉品领域中的应用虽然起步较晚,但是凭借着其无需样品前处理、快速、操作简便无损伤等优点在肉品成分分析中取得了一定进展。在食品分析检测研究中,由于激光光源照射样品时,有机分子吸收光子转化为荧光分子产生的荧光效应,进而影响对拉曼光谱分析,因此对荧光背景扣除技术的研究可拓宽拉曼光谱技术的应用范围。另外,拉曼光谱仪器仍以高精密度、价格昂贵的实验仪器为主,难以适应肉类行业的发展,因此今后的研究重点在于研发低成本、可与其他分离、检测设备联用的在线检测设备,应用于实际的生产中,以期提高在线检测肉品品质的效率。先进的物理化学技术在拉曼光谱以及分子生物等学科方面的应用、拉曼光谱软硬件技术的提高以及图谱数据库的建立和完善,必将推动拉曼光谱技术在肉品科学研究中的应用。
[1]CHOI S, MA C. Structural characterization of globulin from common buckwheat (Fagopyrum esculentum Moench) using circular dichroism and Raman spectroscopy[J]. Food Chemistry, 2007, 102(1): 150-160.
[2]NAFIE L A. Recent advances in linear and nonlinear Raman spectroscopy. Part Ⅳ [J]. Journal of Raman Spectroscopy, 2010, 41(12): 1566-1586.
[3]田高友. 拉曼光谱技术在石油化工领域应用进展[J]. 现代科学仪器, 2009(2): 130-134.
[4]MAZUREK S, SZOSTAK R. Quantitative determination of diclofenac sodium and aminophylline in injection solutions by FT-Raman spectroscopy[J]. Journal of Pharmaceutical and Biomedical Analysis, 2006, 40(5): 1235-1242.
[5]MADARIAGA J M. Raman spectroscopy in art and archaeology[J]. Journal of Raman Spectroscopy, 2010, 41(11): 1389-1393.
[6]BOYD S, BERTINO M F, SEASHOLS S J. Raman spectroscopy of blood samples for forensic applications[J]. Forensic Science International, 2011, 208: 124-128.
[7]LI-CHAN E C Y. The applications of Raman spectroscopy in food science[J]. Trends in Food Science and Technology, 1996, 7: 361-370.
[8]THYGESEN L G, LOKKE M M, MICKLANDER E, et al. Vibrational microspectroscopy of food. Raman vs. FT-IR[J]. Trends in Food Science and Technology, 2003, 14(1): 50-57.
[9]杨铭. 结构生物学概论[M]. 北京: 北京医科大学出版社, 2002: 68-72.
[10]HERRERO A M. Raman spectroscopy for monitoring protein structure in muscle food systems[J]. Food Science and Nutrition, 2008, 48(6): 512-523.
[11]CAREW E B, STANLEY H E, SEIDEL J C, et al. Studies of myosin and its proteolytic fragments by laser Raman spectroscopy[J]. Biophysical Journal, 1983, 44(2): 219-224.
[12]SULTANBAWA Y, LI-CHAN E C Y. Structural changes in natural actomyosin and surimi from ling cod (Ophiodon elongatus) during frozen storage in the absence or presence of cryoprotectans[J]. Journal of Agricultural and Food Chemistry, 2001, 49(10): 4716-4725.
[13]BADII F, HOWELL N K. Elucidation of the effect of formaldehyde and lipids on frozen stored cod collagen by FT-Raman spectroscopy and differential scanning calorimetry[J]. Journal of Agricultural and Food Chemistry, 2003, 51(5): 1440-1446.
[14]CARECHE M, HERRERO A M, RODRIGUEZ-CASADO A, et al. Structural changes of hake (Merluccius merluccius L.) fillets: effects of freezing and frozen storage[J]. Journal of Agricultural and Food Chemistry, 1999, 47(3): 952-959.
[15]HERRERO A M, CARMONA P, CARECHE M. Raman spectroscopic study of structural changes in hake (Merluccius merluccius L.) muscle proteins during frozen storage[J]. Journal of Agricultural and Food Chemistry, 2004, 52(8): 2147-2153.
[16]夏秀芳, 孔保华, 张宏伟. 肌原纤维蛋白凝胶形成机理及影响因素的研究进展[J]. 食品科学, 2009, 30(9): 264-268.
[17]XU Xianglian, HAN Minyi, FEI Ying, et al. Raman spectroscopic study of heat-induced gelation of pork myofibrillar proteins and its relationship with textural characteristic[J]. Meat Science, 2011, 87(3): 159-164.
[18]CHEN H Y, HAN M Y. Raman spectroscopic study of the effects of microbial transglutaminase on heat-induced gelation of pork myofibrillar proteins and its relationship with textural characteristics[J]. Food Research International, 2011, 44(5): 1514-1520.
[19]DAVILA E, PARESA D, HOWELL N K. Studies on plasma protein interactions in heat-induced gels by differential scanning calorimetry and FT-Raman spectroscopy[J]. Food Hydrocolloids, 2007, 21(7): 1144-1152.
[20]LIU Ru, ZHAO Siming, XIE Bijun, et al. Contribution of protein conformation and intermolecular bonds to fish and pork gelation properties [J]. Food Hydrocolloids, 2011, 25(5): 898-906.
[21]SANCHEZ-GONZALEZ I, CARMONA P, MORENO P, et al. Protein and water structural changes in fish surimi during gelation as revealed by isotopic H/D exchange and Raman spectroscopy[J]. Food Chemistry, 2008, 106(1): 56-64.
[22]SANCHEZ-GONZALEZ I, RODRIGUEZ-CASADO A, CARECHE M, et al. Raman analysis of surimi gelation by addition of wheat dietary fibre[J]. Food Chemistry , 2009, 112(1): 162-168.
[23]CARDENIA V, RODRIGUEZ-ESTRADA M T, CUMELLA F, et al. Oxidative stability of pork meat lipids as related to high-oleic sunflower oil and vitamin E diet supplementation and storage conditions[J]. Meat Science, 2011, 88(2): 271-279.
[24]lo FIEGO D P, SANTORO P, MACCHIONI P, et al. Influence of genetic type, live weight at slaughter and carcass fatness on fatty acid composition of subcutaneous adipose tissue of raw ham in the heavy pig[J]. Meat Science, 2005, 69(1): 107-114.
[25]SARKARDEI S, HOWELL N K. The effects of freeze-drying and storage on the the FT-Raman spectra of Atlantic mackerel (Scomber scombrus) and horse mackerel (Trachurus trachurus) [J]. Food Chemistry, 2007, 103(1): 62-70.
[26]孔保华, 马丽珍. 肉品科学与技术[M]. 北京: 中国轻工业出版社, 2007: 71-73.
[27]李正强, 卜凤泉. 色素蛋白的共振Raman和FT-Raman光谱[J]. 光散射学报, 1997, 9(2/3): 245-246.
[28]李涛, 吕荣, 于安池. 时间分辨拉曼光谱研究一氧化氮与肌红蛋白的结合过程[J]. 物理化学学报, 2010, 26(1): 18-22.
[29]SUN W Q, ZHOU G H, XU X L, et al. Studies on the structure and oxidation properties of extracted cooked cured meat pigment by four spectra[J]. Food Chemistry, 2009, 115(2): 596-601.
[30]WACKERBARTH H, KUHLMANN U, TINTCHEV F, et al. Structural changes of myoglobin in pressure-treated pork meat probed by resonance Raman spectroscopy[J]. Food Chemistry, 2009, 115(4): 1194-1198.
[31]TINTCHEV F, KUHLMANN U, WACKERBARTH H, et al. Redox processes in pressurised smoked salmon studied by resonance Raman spectroscopy[J]. Food Chemistry, 2009, 112(2): 482-486.
[32]沈高山, 谷怀民, 闫天秀, 等. 亚硝酸钠和氧合血红蛋白反应的拉曼光谱[J]. 中国激光, 2008, 35(9): 1432-1435.
[33]PEDERSEN D K, MOREL S, ANDERSEN H J, et al. Early prediction of water-holding capacity in meat by multivariate vibrational spectroscopy[J]. Meat Science, 2003, 65(1): 581-592.
[34]HERRERO A M, CARMONA P, GARCIA M L, et al. Ultrastructural changes and structure and mobility of myowater in frozen-stored hake (Merluccius merluccius L.) muscle: relationship with functionality and texture[J]. Journal of Agricultrural and Food Chemistry, 2005, 53(7): 2558-2566.
[35]OLSEN E F, RUKKE E,TTEN A, et al. Quantitative determination of saturated-, monounsaturated-and polyunsaturated fatty acids in pork adipose tissue with non-destructive Raman spectroscopy[J]. Meat Science, 2007, 76(4): 628-634.
[36]OLSEN E F, BAUSTAD C, EGELANDSDAL B, et al. Long-term stability of a Raman instrument determining iodine value in pork adipose tissue[J]. Meat Science, 2010, 85(1): 1-6.
[37]刘燕德, 刘涛, 孙旭东, 等. 拉曼光谱技术在食品质量安全检测中的应用[J]. 光谱学与光谱分析, 2010, 30(11): 3007-3012.
[38]BEATTIE R J, BELL S J, FARMER L J, et al. Preliminary investigation of the application of Raman spectroscopy to the prediction of the sensory quality of beef silverside[J]. Meat Science, 2004, 66(4): 903-913.
Application of Raman Spectroscopy Technique in Meat Science: A Review
CHEN Qian,LI Pei-jun,KONG Bao-hua*
(College of Food Science, Northeast Agricultural University, Harbin 150030, China)
As a novel spectral detection method, Raman spectroscopy technique has been widely used in analysis of physicochemical structure of materials. Raman spectroscopy technique is also promising for component analysis of meat with the advantages of quickness and nondestructive detection. Meanwhile, Raman spectroscopy technique has good application prospect in meat science for its spectra being extremely insensitive to polar materials such as water. In this paper, the principle and classification of Raman spectroscopy technique are introduced briefly, component analysis and quality discrimination of meat by Raman spectroscopy technique are reviewed, and finally, perspective applications of this technique in further meat research is prospected.
Raman spectroscopy;meat science;component analysis;quality discrimination
TS207.3
A
1002-6630(2012)15-0307-07
2011-07-15
国家公益性行业(农业)科研专项(200903012-02);东北农业大学创新专项基金(CXZ011)
陈倩(1988—),女,硕士研究生,研究方向为农产品加工及贮藏。 E-mail:chenqianego7@163.com
*通信作者:孔保华(1963—),女,教授,博士,研究方向为农产品加工及贮藏。E-mail:kongbh@163.com

