组织原位杂交和Taq Man实时荧光定量PCR检测enJSRV及其受体HYAL2在妊娠蒙古绵羊绒毛膜中的表达*
齐景伟,徐萌杰,刘淑英*
(1.内蒙古农业大学动物科学学院,内蒙古呼和浩特 010018;2.内蒙古农业大学兽医学院,内蒙古呼和浩特 010018)
内源性逆转录病毒在数百万年前整合到脊椎动物的基因组中,在胚胎形成过程扮演重要角色,起到增强遗传基因功能,并保护宿主免受相关外源致病性病毒侵害的作用[1]。绵羊基因组中含有与外源性绵羊肺腺瘤逆转录病毒(Exogenous Jaagsiekte heep retrovirus,exJSRV)密切相关的约20拷贝内源性逆转录绵羊肺腺瘤病毒(Endogenous Jaagsieke sheep retrovirus,enJSRV)序列,其中exJSRV 是传染性绵羊肺腺瘤病(Ovine pulmonary adenomatois,OPA)的致病因子,而透明质酸酶2(hyaluroniase 2,HYAL2)是enJSRV 和exJSRV 的共同受体[2]。近年来,学者们对enJSRV、exJSRV 和绵羊三者之间相互作用的研究很感兴趣,进一步探究逆转录病毒与其宿主在进化过程中所发挥的复杂的作用提供了一个独特的模式系统,具有里程碑的意义[3]。但是,对生殖系统相关组织中enJSRV的研究尚处于探索阶段,对反刍动物妊娠早期调节绒毛膜滋养层细胞增殖和分化的分子机制也仍然是个未解之谜[4]。因此,检测绵羊胚胎发育过程中enJS RV及其受体HYAL2的表达就成为揭示其生物学作用的关键。目前,尚无关于妊娠蒙古绵羊绒毛膜中enJSRV及其受体HYAL2表达特性的报道。本研究采用组织原位杂交技术和Taq Man实时荧光定量PCR对其在不同妊娠时期蒙古绵羊绒毛膜的分布定位和表达规律进行了研究,以探索二者在蒙古绵羊胚胎发育过程中可能发挥的作用,为进一步揭示enJSRV的生殖生物学作用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 检材 屠宰不同妊娠时期(30、50、70、90、110、130d,交配日=0d)的蒙古绵羊,每组3只,分别迅速剥离取绒毛膜组织样品各两份,一份放入40mL/L多聚甲醛/0.1mol/L PBS固定液中固定10h,梯度脱水后用石蜡包埋,另一份存于液氮中。1.1.2 主要试 剂 RNAiso Plus、DL 500DNA Marker、DL 2 000DNA Marker、PrimeScript One Step RT-PCR Kit Ver.2、PrimeScript RT reagent Kit Perfect Real Time、Premix Ex Taq(Perfect Real Time)、Digoxigenin RNA labeling kit、Anti-digoxigenin-AP Fab fragment等购自宝生物工程(大连)有限公司。
1.2 方法
1.2.1 PCR探针和引物的设计与合成 根据Gen-Bank中已登录的绵羊enJSRV、HYAL2和β-actin序列,利用DNA Star软件设计并合成如下探针和引物(表1)。
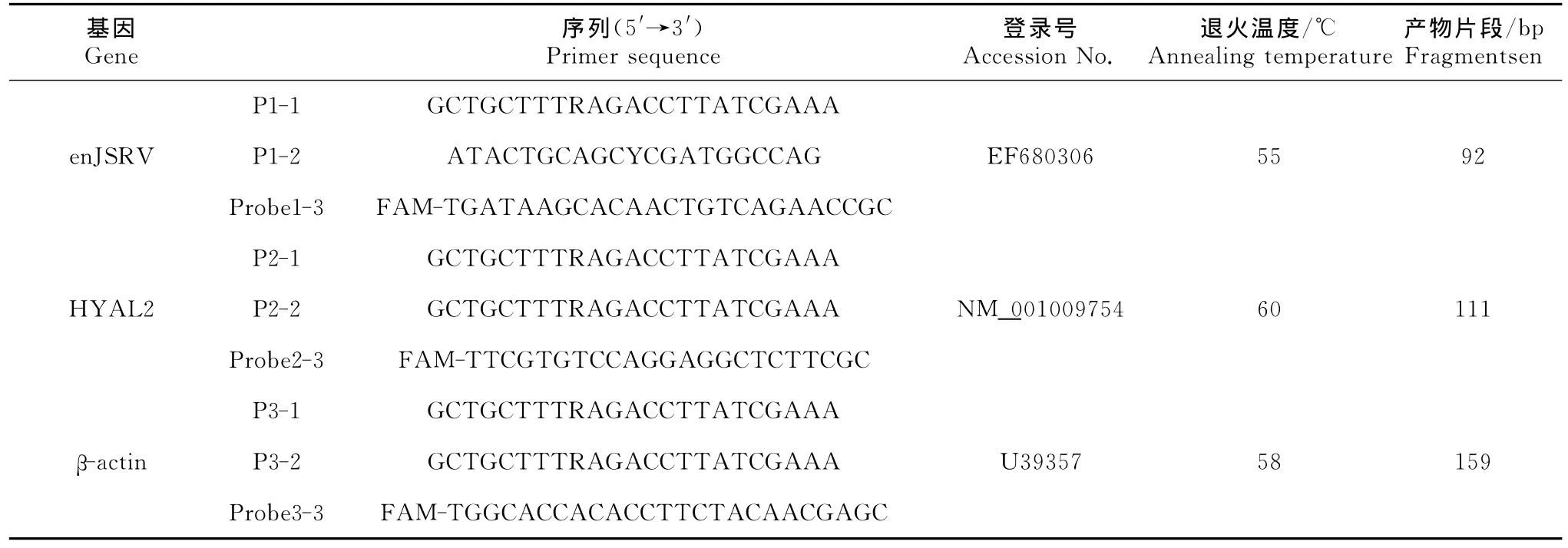
表1 enJSRV,受体HYAL2和管家基因β-actin的引物序列Table 1Primer sequences for enJSRV,receptor HYAL2andβ-actin house keeping genes
1.2.2 总RNA的提取和反转录 将不同妊娠时期蒙古绵羊的绒毛膜组织采用液氮捣碎法[4]处理,然后根据宝生物工程(大连)有限公司的Trizol试剂说明书抽提总RNA,并用微量紫外分光光度计(型号:ND-1000NanoDrop,美国)和10g/L变性琼脂糖凝胶电泳检测RNA的纯度及完整性。反转录体系为10μL:5×Prime Script buffer(for Real Time)2 μL,PrimeScript RT Enzyme Mix Ⅰ0.5μL,Oligo dT Primer(50μmol/L)0.5μL,Random 6mers(100μmol/L)2μL,Total RNA,最后加RNase Free dH2O 至10μL。37℃15min,85℃5s。所得产物即为妊娠蒙古绵羊各时期绒毛膜组织的cDNA。以cDNA为模板进行内参基因β-actin的PCR扩增,判断是否逆转录成功。
1.2.3 荧光定量PCR的稳定性和重复性的检测微量紫外分光光度计测30d妊娠蒙古绵羊绒毛膜组织的浓度后,取4ng/μL依次进行10倍梯度稀释,作为相应的标准品。将标准品进行10倍梯度稀释,分别用荧光定量PCR检测,根据获得的Ct值检测该方法的灵敏性。对10倍~3倍比稀释液的标准品分别做5个反应管,检测比较同一次反应不同反应管间的批内变异。荧光定量PCR反应体系为25μL,其中cDNA 2μL,Premix Ex Taq (2×)12.5μL,上游引物(10pmol/μL)0.5μL,下游引物(10pmol/μL)0.5μL,荧光探针溶液1μL,RNase Free dH2O 8.5μL于实时荧光定量PCR仪进行PCR扩增。联机运行软件为 MJ Opticon Moni-tor TM Analysis Software Version 3.1,采用两步法运行程序:95℃预变性3 0s;95℃5s,60℃30s,40个PCR循环。
1.2.4 标准曲线的建立 将10倍梯度稀释的各个标准品的起始拷贝数取常用对数,作为横坐标,其所对应的Ct值作为纵坐标,即可做出相应的标准曲线。反应体系及运行条件同1.2.3。
1.2.5 妊娠蒙古绵羊各时期绒毛膜组织enJSRV及其受体HYAL2基因表达水平的检测 将妊娠蒙古绵羊各时期绒毛膜组织的cDNA作为模板,进行荧光定量PCR,获得相应的Ct值。根据荧光曲线的Ct值以及标准曲线计算定量结果SPSS。反应体系及运行条件同1.2.3。
1.2.6 SP正、反义RNA探针的合成 PCR产物经20g/L变性琼脂糖凝胶电泳分析,检测扩增片段大小。经纯化后,用TA克隆的方法将该目的片段克隆到pMD 19-T Vector载体中。将构建好的质粒转化到大肠埃希菌感受态细胞中,挑取阳性克隆进行培养后小量提取质粒,分别用限制性内切酶BamH I和Sal I进行酶切,使其完全线性化,回收纯化酶切片段,以其为模板,用地高辛标记试剂盒内(Roche,Cat.№11 175 025 910,德国)的 SP6 和T7转录酶进行体外转录,合成地高辛标记的enJSRV及其受体 HYAL2正、反义探针。用变性琼脂糖电泳和微量紫外分光光度计(型号:ND-1000 NanoDrop,美国)对合成的探针进行初步鉴定。最后经斑点杂交(dot blot)方法分析探针的标记效率及浓度。
1.2.7 原位杂交检测enJSRV及其受体 HYAL2 mRNA在绒毛膜的定位 将烘烤后的切片(5μm)经二甲苯脱蜡,梯度酒精下行至无RNase水,空气干燥后用蛋白酶 K/0.1mol/L PBS(pH 7.4)消化1min~2min,经甘氨酸处理进行杂交前预处理。在每张切片上滴加20μL预杂交液(5×SSC,5×Denhardt,50%去离子甲酰胺,10/L SDS,200μg/mL鲑鱼精DNA)湿盒内在42℃恒温箱预杂交1h后,再滴加20μL杂交液(5×SSC,5×Denhardt,50%去离子甲酰胺,10g/L SDS,250μg/mL鲑鱼精DNA,100g/L硫酸葡聚糖,探针于湿盒内在42℃恒温箱杂交18h。杂交后经SSC、封闭液、抗地高辛AP液、马来酸缓冲液、显色缓冲液、NBT/BCIP显色液、无酶水、伊红复染、梯度酒精脱水、二甲苯透明后封片照相。除使用相应的正义探针代替反义探针外其余试验步骤完全相同做正义探针对照试验。
2 结果
2.1 荧光定量PCR的稳定性和重复性
所有样品的总RNA经微量紫外分光光度计(型号:ND-1000NanoDrop,美国)检测,测得其吸光度A260/A280比值均在1.8~2.0之间,可用于 mRNA的表达分析。之后将标准品按体积比1∶10倍比稀释后作为定量PCR的模板进行检测。对10倍~3倍比稀释液的标准品做5个反应管检测,同一次反应不同反应管的批内变异系数为0.92%,说明该方法的稳定性和重复性都很好,适于利用该方法进行后续试验。
2.2 妊娠蒙古绵羊各时期绒毛膜enJSRV及其受体HYAL2基因相对表达水平的检测
以β-actin基因为内参,由内参的定量结果求出RNA量的误差(本试验是对于30d绒毛膜组织的相对值),用enJSRV及其受体 HYAL2基因的定量结果除以上述误差值,以校正enJSRV及其受体HYAL2基因的定量结果,由校正值计算出样品间对于30d绒毛膜的相对值(图1)。图1表明妊娠蒙古绵羊在各时期绒毛膜组织中均有enJSRV及其受体HYAL2的表达。通过统计学分析得出,妊娠蒙古绵羊绒毛膜组织中enJSRV mRNA的表达于妊娠50d时表达量最低,70d和110d相对较高,且差异都极显著(P<0.01),到130d时又降低到起始水平;受体HYAL2的表达于130d时表达量最低,90d相对较高,且差异都极显著(P<0.01)。而enJSRV与其受体HYAL2mRNA之间无线性相关性(图1)。
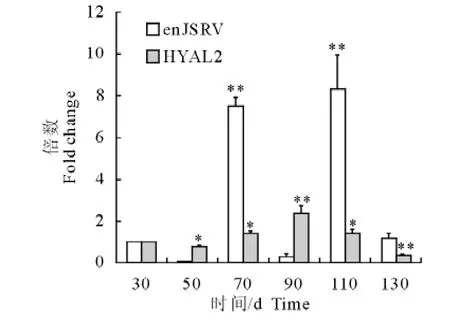
图1 enJSRV及其受体HYAL2基因在各时期的相对表达水平Fig.1Expression level of enJSRV and HYAL2 gene in different periods
2.3 探针检测结果
探针的检测结果如图2,从上到下依次为control DNA、地高辛标记的enJSRV和HYAL2探针形成的斑点。根据试剂盒说明书的稀释浓度图中数字1~5表示按control DNA的浓度分别为10、3、1、0.3、0.1pg/μL的倍比稀释。通过比对计算得出enJSRV正、反义探针浓度分别为3.75pg/μL和4.65pg/μL;HYAL2探针浓度分别为3.25pg/μL和3.40pg/μL。

图2 探针灵敏度检测Fig.2Detection of sensibility of probes
2.4 enJSRV及其受体 HYAL2在妊娠蒙古绵羊绒毛膜的表达定位
采用地高辛标记的enJSRV及其受体HYAL2 cRNAs探针对不同妊娠时期蒙古绵羊绒毛膜进行原位杂交。结果显示,enJSRV及其受体 HYAL2 mRNAs在妊娠30、50、130d蒙古绵羊绒毛膜组织中均有阳性信号出现。从图3中蓝紫色阳性信号分布情况可见,enJSRV 及其受体 HYAL2mRNAs特异性表达在绒毛膜的滋养层巨型双核细胞(trophoblastic giant binucleated cell,BNC)、多核合胞体小半鞘翅(multinucleate syncytial plaque,SP)和滋养外胚层(trophectoderm,Tr)。在相应的正义探针对照试验中均无阳性信号出现。

图3 原位杂交检测enJSRV及其受体HYAL2在妊娠蒙古绵羊绒毛膜的表达Fig.3Expression of enJSRV and HYAL2mRNAs in the chorion of pregnant Mongolian ewes
3 讨论
绒毛膜由滋养层及衬于其内面的胚外中胚层组成,其外表面有大量绒毛,绒毛上皮表面覆盖大量微绒毛,绒毛的发育及微绒毛的出现使绒毛膜与子宫蜕膜的接触面积大大增加,有利于胚胎与母体之间进行物质交换[5]。随着胚胎发育,丛密绒毛膜与基蜕膜共同构成了胎盘。当囊胚着床后,滋养层细胞分裂增殖,进而分化融合为合胞体滋养层细胞,形成绒毛干,构成完备的母体胚胎胎盘循环,以满足妊娠子宫的血供需求,所以胎盘的正常形成是维系胚胎生长发育的关键所在,而期间必有重要的生物分子以特异的表达形式和规律参与[6-8]。近年来的研究表明,内源性逆转录病毒(ERV)在胎盘中的表达可能参与妊娠过程中的局部免疫调节,介导细胞间的相互作用,并防止外源性逆转录病毒的胎期传染[9-11]。
本试验中发现,enJSRV在蒙古绵羊不同妊娠期的绒毛膜组织中均有表达,且特异性表达在绒毛膜的滋养层巨型双核细胞、多核合胞体小半鞘翅和滋养外胚层。其中enJSRV mRNA在绒毛膜的表达于妊娠50d时最低,这可能是由于在妊娠的早期,或者是妊娠中期的早期,绒毛膜正在发育分化,还未形成胎盘,没有母体血液供应时,靠子宫内膜腺上皮产生的碳水化合物和富含脂质的分泌物来提供营养物质,同时调节母胎界面的免疫反应和绒毛滋养细胞的浸润,进而维持胚胎的存活和正常胎盘的发育。到妊娠110d,enJSRV mRNA在绒毛膜的表达量较高,这一时期绒毛膜与子宫蜕膜牢固连接,胎盘已完全形成,胚胎进入发育成熟阶段,需要汲取大量的营养物质,因此作为维持母体与胚胎之间物质交换的绒毛干发挥着关键作用。而妊娠130d时,enJSRV mRNA表达水平降低,此期绵羊处于临产期,胎盘已发育成熟,其屏障作用减弱,因而出现排斥现象而将胚胎排出体外;再者,胚胎大约在完全发育成熟时,当所产生的在免疫学上有保护作用的细胞数量降到最低时,才会使母畜发生免疫学反应,排斥胚胎[12]。Dunlap K A 等[13]研究者通过体内外的研究发现在胎盘发育期,enJSRV的表达被阻止后,胎盘的生长速度下降,绒毛滋养层大型双核细胞(giant binucleate cell,BNC)停止发育,结果胚胎不能正常着床,导致绵羊流产。说明enJSRV参与调节绒毛滋养层的生长,影响胎盘发育,诱导机体产生免疫耐受,是妊娠所不可或缺的因素。
另外,绒毛膜的合体滋养层细胞产生绒毛膜促性腺激素(chorionic gonadotropin,CG),CG的主要功能就是刺激黄体的生成,利于雌激素和孕酮持续分泌,以促进子宫蜕膜的形成,使胎盘生长成熟[14]。研究表明,CG在妊娠期的分泌水平与enJSRV的表达相一致。因此,将enJSRV的mRNA表达量的变化规律与妊娠绵羊绒毛膜发育过程和功能结合考虑,推测enJSRV参与妊娠过程中绒毛滋养层细胞的分化融合,促进胎盘的发育完善,同时有助于宿主的防御。
透明质酸酶2(HYAL2)是enJSRV与exJSRV的共同受体,当enJSRV与受体HYAL2结合后,会降低exJSRV可利用的受体,防止相应外源性病毒的侵入[15]。而当enJSRV 和exJSRV 同表达在一个宿主细胞内时,enJSRV形成的病毒粒子不能释放出宿主细胞表面,它还阻止exJSRV形成的病毒粒子的释放,进而保护宿主免受感染[16]。本试验中发现在绒毛膜enJSRV的受体HYAL2表达量90d相对较高,这可能由于该阶段正是胎盘形成期,绒毛膜增生明显,大量细胞增殖分化,致使机体内透明质酸(hyaluronic acid,HA )的浓度升高,相应降解HA的 HYAL2也高表达。而妊娠早期(30d)和妊娠晚期(130d)绒毛膜内的 HYAL2mRNA表达量则均较低,此时绒毛膜或处于未分化期或处于早已发育成熟期,机体还未有大量细胞的增殖和分化,或机体不再需要细胞大量的增殖和分化,其调节因子透明质酸的浓度明显下降,HYAL2的表达随之较低。
本试验表明,enJSRV与其受体 HYAL2mRNA之间表达量无线性相关。尽管enJSRV与其受体HYAL2以绒毛膜滋养细胞为位点相互作用,调控胎盘形成发育,但可能由于二者的表达调控机制不同,致使它们间无线性相关性。
[1]Wang Y U,LIU Shu-ying.Cloning and sequence analysis of complete genome from the Inner Mongolia strain of the endogenous betaretroviruses (enJSRV)[J].Virologica Sinica,2008,23(1):15-24.
[2]Palmarini M,Mura M,Spencer T.Endogenous betaretrovir uses of sheep:teaching new lessons in retroviral interference and adaptation[J].J Gen Virol,2004,85:1-13.
[3]Arnaud F,Varela M,Spencer T E,et al.Coevolution of endogenous betaretroviruses of sheep and their host Cell[J].Cell Mol Life Sci,2008,65(21):3422-3432.
[4]Spencer T E,Mura M,Gray C A,et al.Receptor usage and fetal expression of ovine endogenous betaretroviruses:implications for coevolution of endogenous and exogenous retrovirus[J].J Virol,2003,77:749-753.
[5]Fan H,Palmarini M,Martini J C.Transformation and oncogenesis by jaagsiekte sheep retrovirus[J].Curr Top Microbiol Immunol,2003,275:139-177.
[6]杨增明,孙青原,夏国良.生殖生物学 [M].北京:科学出版社,2005:248-256.
[7]Kathrin A D,Palmarini M,Varela M,et al.Endogenous retroviruses regulate periimplantation placental growth and differentiation[J].Proc Natl Acad Sci U S A,2006,103(39):14390-14395.
[8]Rote N S,Chakrabarti S,Stetzer B P.The role of human endogenous retroviruses in trophoblast differentiation and placental development[J].Placenta,2004,25(8):673-683.
[9]Mura M,Murcia P,Caporale M,et al.Late viral interference induced by transdominant Gag of an endogenous retrovirus[J].Proc Natl Acad Sci U S A,2004,101(30):11117-11122.
[10]Aide H P,Cornet P B,Delvaux D,et al.Opposite regulation of transforming growth f actors-beta2and-beta3expression in the human endometrium[J].Endocrinology,2008,149(3):1015-1025.
[11]Wollenhaupt K,Welter H,Einspanier R,et al.Expression of epidermal growth factor repetor(EGF-R),vascular endothelial growth factor repetor(VEGF-R)and endometrium during the time of implantation[J].J Reprod Dev,2004,50(3):269-278.
[12]Summers C,Neill W,Dewar P,et al.Systemic immune responses following infection with jaagsiekte sheep retrovirus and in the terminal stages of ovine pulmonary adenocarcinoma[J].J Virol,2002,83:1753-1757.
[13]Dunlap K A,Palmarini M,Varela M,et al.Endogenous retroviruses regulate periimplantation placental growth and differentiation[J].Proc Natl Acad Sci U S A,2006,103(39):14390-14395.
[14]Spencer T E,Johnson G A,Bazer F W,et al.Pregnancy recognition and conceptus implantation in domestic ruminants:roles of progesterone,interferons and endogenous retroviruses[J].Reprod Fertil,2007,19:65-78.
[15]Arnaud F,Murcia P R,Palmarini M.Mechanisms of late restriction induced by an endogenous retrovirus[J].J Virol,2007,81(20):11441-11451.
[16]Arnaud F,Caporale M,Varela M,et al.A paradigm for virus-host coevolution:sequential counter-adaptations between endogenous and exogenous retroviruses[J].PLoS Pathog,2007,3(11):e170.

