金黄色葡萄球菌耐药性及肠毒素分型研究
史 红,王 娟,郑增忍*,单 虎,王述柏,李玉清,黄秀梅,刘开成,韩 艳,张 鹏
(1.青岛农业大学,山东青岛 266109;2.中国动物卫生与流行病学中心,山东青岛 266032)
金黄色葡萄球菌耐药性及肠毒素分型研究
史 红1,王 娟2,郑增忍2*,单 虎1,王述柏1,李玉清2,黄秀梅2,刘开成1,韩 艳1,张 鹏1
(1.青岛农业大学,山东青岛 266109;2.中国动物卫生与流行病学中心,山东青岛 266032)
为了解从生鲜乳中分离得到的31株金黄色葡萄球菌的耐药性和肠毒素分布情况,用微量肉汤稀释法进行药敏试验,用PCR方法进行肠毒素的检测和分型。结果表明,31株金黄色葡萄球菌耐药率在50%以上的抗菌药有7种,药耐药率小于10%的有3种;敏感率大于50%的抗菌药有6种,敏感率小于10%的有5种。31株金黄色葡萄球菌毒素基因携带率为93.5%,同时携带2种及以上毒素的菌株占67.7%,有SEA基因的占38.7%,含其他传统的毒素基因类型SEB、SEC、SED和SEE基因的菌株只占40.4%,携带新发现的毒素基因SEG、SHE、SEI和SEJ的菌株占67.7%。说明本次试验中的31株金黄色葡萄球菌对6类13种抗菌药都有不同程度的耐药性,且多重耐药现象比较严重。生鲜乳中分离的金黄色葡萄球菌带毒率高,且携带新发现的肠毒素基因较多。
金黄色葡萄球菌;耐药性;肠毒素
奶牛乳房炎是世界范围内发生最普遍、防治最难的奶牛疾病之一。奶牛乳房炎不仅引起奶牛产乳量的下降和乳品质的改变,严重时还会使奶牛泌乳机能完全丧失,造成巨大的经济损失,有时还会影响食用者的身体健康[1]。病原微生物感染是奶牛乳房炎的主要发病因素。引起奶牛乳房炎的病原微生物的种类繁多,有细菌、支原体、真菌、病毒等。据杨克礼等[2]报道,患乳房炎的奶牛乳汁中以金黄色葡萄球菌(Staphylococcusaureus)的带菌率最高,其次是大肠埃希菌(Escherichiacoli)和链球菌(Streptococcus)。目前使用抗生素是治疗奶牛乳房炎的主要方法,但随着抗生素在世界范围内的大量使用及滥用,导致细菌出现严重的耐药性[3]。
金黄色葡萄球菌能产生多种毒素,主要有肠毒素 (staphylococcal enterotoxins,SEs)、剥脱毒素(exfoliative toxin,ETs)和毒性休克综合征毒素1(toxic shock syndrome toxin,TSST-1)等。肠毒素是引起食物中毒的主要因子,由金黄色葡萄球菌引起的食品中毒是个世界性卫生问题,在美国由其引起的食品中毒占整个细菌性食品中毒的33%,加拿大则更多,达45%[4]。我国也常发生金黄色葡萄球菌食物中毒,是卫生防疫部门重点监测项目。金黄色葡萄球菌肠毒素是一类结构相关、毒力相似、抗原性不同、对热稳定(100℃耐热30min)的外毒素,除了SEA、SEB、SEC、SED、SEE 5种传统的血清型外,近几年还发现了 SEG、SHH、SEI、SEJ、SEK、SEL、SEM、SEN 和SEO 等新型的肠毒素[5-7]。本文对从生鲜乳中分离到的31株金黄色葡萄球菌进行了耐药性研究和肠毒素的分型分布的研究。
1 材料与方法
1.1 材料
1.1.1 菌株 在奶牛场采集生鲜乳,从生鲜乳中分离得到31株金黄色葡萄球菌。金黄色葡萄球菌(Staphylococcusaureus)标准质控菌 ATCC29213购自中国药品生物制品检定所。
1.1.2 药品及试剂 动物源细菌耐药性金黄色葡萄球菌冻干型细菌定量药敏(MIC)测试盒为天津市金章科技发展有限公司产品,配套产品有冻干药敏试剂盒、0.5麦氏比浊管、1.5mL 无菌4.5g/L NaCl溶液安瓿(制备0.5麦氏待测菌悬液)、10mL MH肉汤管及30mL V型无菌槽;胰蛋白胨、琼脂粉和酵母粉为北京陆桥技术有限公司产品;溶菌酶和细菌基因组DNA提取试剂盒为天根生化科技(北京)有限公司产品;Taq酶和DNA Marker为宝生物工程(大连)有限公司产品。
1.2 方法
1.2.1 药敏试验 根据临床药物的使用情况和对公共卫生的影响选择6类13种抗菌药,按照美国临床实验室标准化协会(CLSI)微量肉汤稀释法(M38-A2文件)检测所有菌株对这6类13种抗菌药的最低抑菌浓度。6类13种抗菌药分别是青霉素类(青霉素/P、氨苄西林/AM、奥格门丁/A/C),头孢类(头孢西丁/CX、头孢噻呋/CEF),大环内酯类(替米考星/TIL、红霉素/E、泰妙菌素/TIA),万古霉素类(万古霉素/Va),磺胺类(磺胺异恶唑/SF、新诺明/SXT),氟喹诺酮类(恩诺沙星/ENR、氧氟沙星/OFL)。
对保存的31株金黄色葡萄球菌菌株根据冻干型细菌定量药敏(MIC)测试盒说明书进行药敏试验。
1.2.2 金黄色葡萄球菌分离株肠毒素基因分型
1.2.2.1 模板DNA的制备 按照细菌基因组DNA提取试剂盒的说明书制备模板DNA。
1.2.2.2 目的基因的PCR扩增 对所有菌株做肠毒素基因 SEA、SEB、SEC、SED、SEE、SEG、SEH、SEI和SEJ的检测。
PCR反应体系:模板DNA 1μL、上下游引物(20pmol/μL)各0.5μL,10×PCR buffer 2.5μL,MgCl2(25mmol/L)2μL,dNTP Mixture(2.5 mmol/L)0.5μL,Taq酶(5u/μL)0.5μL,加灭菌蒸馏水至25μL。
PCR反应程序:94℃ 5min;94℃ 1min,55℃1min,72℃1min,30个循环;最后72℃ 10min。PCR产物用15g/L琼脂糖凝胶电泳,电泳后在凝胶成像系统中成像。引物见表1[8]。
2 结果
2.1 药敏试验结果
31株金黄色葡萄球菌分离菌株对6类13种抗菌药都有不同程度的耐药性。对青霉素类药物(氨苄西林、青霉素、奥格门丁)的耐药性最严重,对氨苄西林和青霉素的耐药率均为100%,对奥格门丁的耐药率为93.55%,其次是对是红霉素和头孢噻呋,耐药率均为96.77%,对头孢西丁的耐药率为64.52%,对磺胺异恶唑的耐药率为54.84%,耐药率在50%以上抗菌药有7种。对氧氟沙星的耐药率为6.45%,对恩诺沙星和新诺明的耐药率均为3.23%,对泰妙菌素、替米考星、万古霉素均无耐药性。31株金黄色葡萄球菌分离菌株除对青霉素类药物的氨苄西林、青霉素及大环内酯类药物的红霉素无敏感性外,对其余10种抗菌药都有不同程度的敏感性。其中对泰妙菌素、替米考星、万古霉素的敏感率均为100%,其次是新诺明、恩诺沙星,敏感率分别为96.77%、93.54%,敏感率大于50%的有6种抗菌药,敏感率小于10%的有5种药物(表1)。

表1 引物序列Table 1 Nucleotide seguences of the primers
2.2 分离菌株肠毒素检测结果
对金黄色葡萄球菌肠毒素基因SEA、SEB、SEC、SED、SEE、SEG、SHH、SEI和SEJ的PCR结果进行扩增,电泳结果见图1。由扩增结果可知,金黄色葡萄球菌肠毒素基因SEA、SEB、SEC、SED、SEE、SEG、SHH、SEI和SEJ的扩增条带大小与设计相符,说明此方法较为有效。
结果表明从生牛奶中分离的31株金黄色葡萄球菌检测到SEA-SAJ基因的有29株,占93.5%,同时携带2种及以上毒素基因的菌株有21株,占67.7%。带有SEI肠毒素基因的最多,有25株,占80.6%。携带传统肠毒素基因SEA-SEE的总共有13株,占40.4%。携带新型肠毒素SEG-SEJ的菌株较多共有29株,占87.1%。携带各型肠毒素基因的菌株数量见图2。
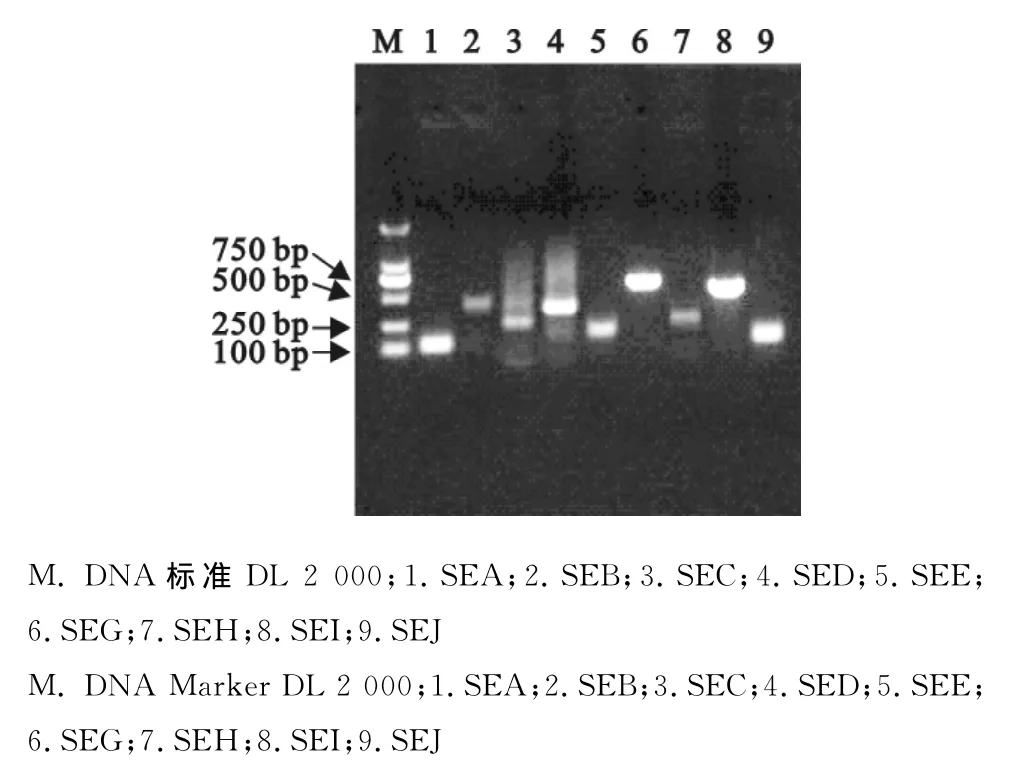
图1 各型肠毒素基因扩增电泳图Fig.1 Electrophoresis results of each type of enterotoxin genes
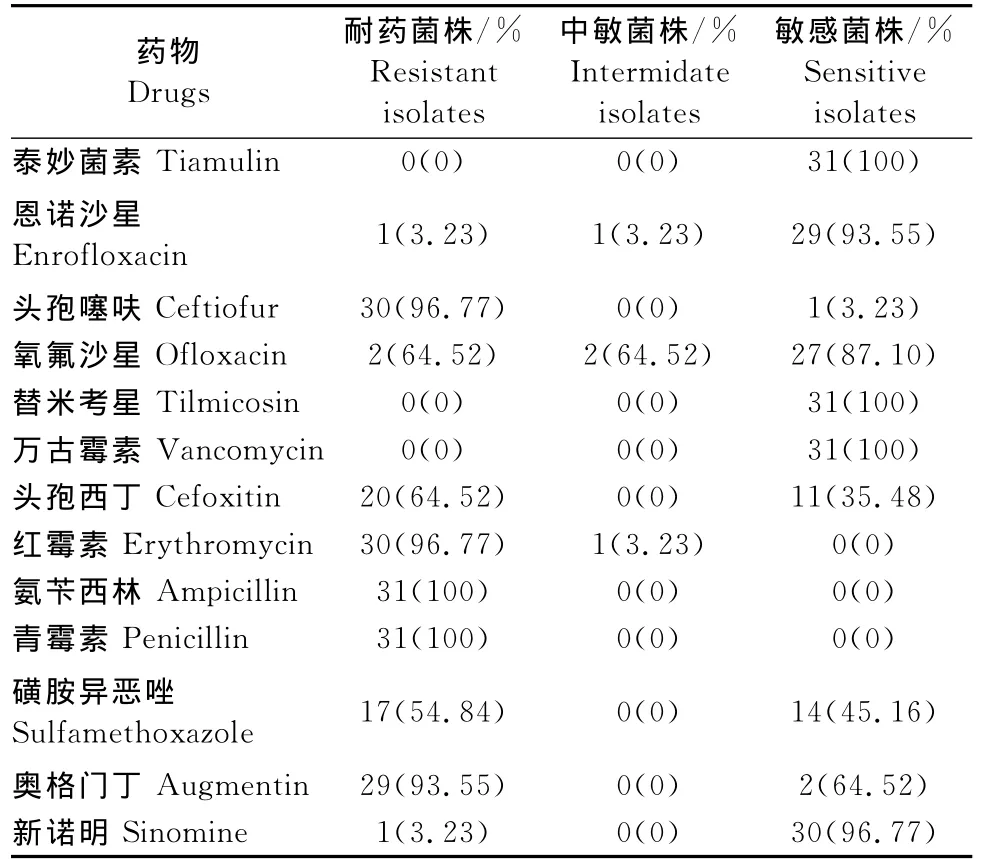
表2 31株金黄色葡萄球菌分离株药敏感性检测结果Table 2 Drug sensitivity test of 31 Staphylococcusaureus isolates
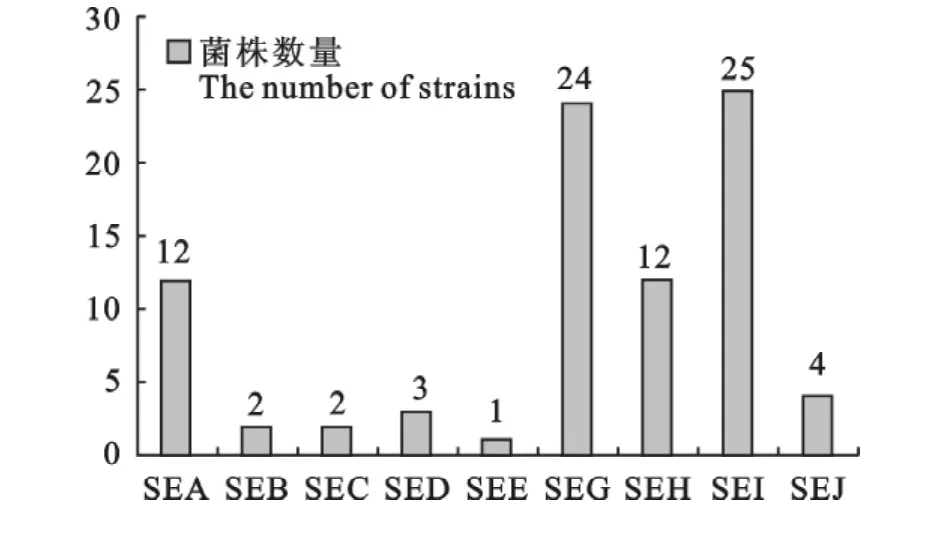
图2 31株金黄色葡萄球菌分离株肠毒素检测结果Fig.2 The results of enterotoxin detection of the 31 Staphylococcusaureus isolates
3 讨论
本次研究中31株金黄色葡萄球菌对6类13种抗菌药都有不同程度的耐药性,多重耐药现象也比较严重。从分离菌株耐药谱可以看出,31株金黄色葡萄球菌中没有0耐菌株出现,无4耐以下、9耐及10耐以上菌株,4耐、8耐及10耐各有1株菌。分离菌株都具有多重耐药性,主要集中在5耐~7耐,占总分离菌株的90.32%。菌株耐药主要是由于动物在饲养过程中使用亚治疗量的抗生素。耐药菌排入环境后能长期保持耐药性,细菌耐药性的出现不仅给临床及兽医用药带来了麻烦,重要的是其耐药性还可通过食物链传播,临床细菌的耐药性与食物中细菌的耐药性直接相关[9-10]。食源性致病菌的耐药性对食品安全及人类健康造成了严重的威胁,现已引起很多国家的重视。控制兽药在饲养过程中的使用,并严格遵守安全休药期对降低食源性耐药菌株的出现有着重要意义。
对于金黄色葡萄球菌肠毒素的检测,以往主要用免疫学方法,不仅费时,而且比较困难。原因是:①肠毒素的特异性抗体难以制备;②肠毒素的表达在不同条件下差异很大,常出现假阳性或假阴性的结果,毒株含有毒素基因但基因表达不好或缺乏稳定的遗传成分时易出现假阴性,有些毒株的血清型容易产生交叉反应,因而又常出现假阳性[11]。本文用PCR技术对肠毒素进行了检测,PCR技术具有特异性强、敏感性、灵敏度高的特点,既节省了检测时间,又可节省人力物力,达到事半功倍的效果。
金黄色葡萄球菌肠毒素类型众多,携带各类肠毒素基因的金黄色葡萄球菌广泛存在。不同类别的肠毒素基因在金黄色葡萄球菌中的分布状况的研究日益受到重视。宋黎黎等[12]从正常人咽拭子中分离的54株金黄色葡萄球菌,同时携带2种及以上毒素基因的菌株占44.4%。带有SED肠毒素基因的菌株最多占44.4%,检测到SEA基因占18.5%,SEB、SEC和SEJ基因分别占9.3%,SEE、SEG和SEI基因分别占14.8%,SHE基因占37.0%。张严峻等[13]从感染病人中分离的80株金黄色葡萄球菌毒素基因携带率为85.0%,同时携带2种及以上毒素基因的菌株占52.94%,有SEA基因的占29.4%,含其它传统的毒素基因类型SEB、SEC、SED和SEE基因的菌株只占39.71%,携带新发现的毒素基因SEG、SEH、SEI和SEJ的菌株占83.82%。Hazariwala A等[14]从家禽中分离到34株金黄色葡萄球菌,检测SEA、SEB、SEC、SED、SEE基因,其中1株为阳性。这与我们的结果有很大差别,表明,肠毒素基因的分布状况与菌株的来源存在相关性。对不同来源的菌株的各型肠毒素的分布还有待进行系统的和深入的研究。
[1]史冬艳,郝永清,张爱荣,等.奶牛金黄色葡萄球菌性乳房炎研究进展[J].动物医学进展,2010,31(7):82-86.
[2]杨克礼,宋士喜,朱先春,等.奶牛临床型乳腺炎病原菌分离试验[J].中国奶牛,2000(4):17-18.
[3]魏小娟,蒲万霞,周绪正,等.兰州地区奶牛乳房炎病原菌的分离鉴定及药敏试验[J].动物医学进展,2007,28(8):113-114.
[4]杨 洋,张 伟,袁耀武,等.PCR检测乳品中金黄色葡萄球菌[J].中国农业科学,2006,39(5):990-990.
[5]Letertre C,Perelle S,Dilasser F,et al.Identification of a new putative enterotoxin SEU encoded by the egc cluster ofStaphylococcusaureus[J].J Appl Microbiol,2003,95(1):38-43.
[6]Omoe K,Hu D L,Takahashi-Omoe H,et al.Identification and characterization of a new staphylococcal enterotoxin-related putative toxin encoded by two kinds of plasmids[J].Infect Immun,2003,71(10):6088-6094.
[7]Omoe K,Imanishi K,Hu D L,et al.Biological properties of staphylococcal enterotoxin-like toxin type R [J].Infect I mmun,2004,72(6):3664–3667.
[8]Monday S R,Bohach G A.Use of multiplex PCR to detect classical and newly described pyrogenic toxin genes in staphylococcal isolates[J].J Clin Microbiol,1999,37:3411-3414.
[9]Olsen S J,DeBess E E,Mc Givern T E,et al.A nosocomial outbreak of fluoroquinolone-resistant salmonella infection [J].N Engl J Med,2001,344:1572-1579.
[10]Smith D L,Harris A D,Johnson J A,et al.Animal antibiotic use has an early but important impact on the emergence of antibiotic resistance in human commensal bacteria [J].Proc Natl Acad Sci U S A,2002,99(9):6434-6439.
[11]邱 阳,王 刚,卢行安,等.金黄色葡萄球菌肠毒素检测方法的研究进展[J].细胞与分子免疫学杂志,2010,26(5):511-513.
[12]宋黎黎,杨兰萍,朱 斌,等.PCR技术在金黄色葡萄球菌肠毒素基因分型中的运用[J].安徽预防医学杂志,2010,16(2):150-151.
[13]张严峻,张俊彦,梅玲玲,等.金黄色葡萄球菌肠毒素基因的分型和分布[J].中国卫生检验杂志,2005,15(6):682-684.
[14]Hazariwala A,Sanders Q,Hudson C R,et al.Distribution of staphylococcal enterotoxin genes amongStaphylococcusaureusisolates from poultry and humans with invasive staphylococcal disease[J].Avian Dis,2002,46(1):132-136.
Drug Susceptibility Test and Typing of Toxin Genes amongStaphylococcusaureus
SHI Hong1,WANG Juan2,ZHENG Zeng-ren2,SHAN Hu1,WANG Shu-bai1,LI Yu-qing2,HUANG Xiu-mei2,LIU Kai-cheng1,HAN Yan1,ZHANG Peng1
(1.QingdaoAgriculturalUniversity,Qingdao,Shandong,266109,China;2.ChinaAnimalHealthandEpidemiologyCenter,Qingdao,Shandong,266032,China)
To research on the drug susceptibility and the type of toxin genes ofStaphylococcalaureusisolates from raw milk of cows,drug susceptibility was tested with the broth microdilution method.Toxin genes were amplified by PCR,and detected by electrophoresis.The results showed that there were 7antimicrobials to which the resistant rates of 31Staphylococcusaureusisolates were higher than 50%,and 3 antimicrobials lower than 10%.And there were 6antimicrobials to which the drug-susceptibility rates were higher than 50%,and 5antimicrobials lower than 10%.The toxin genes of SEA-SEE and SEG -SEJ could be detected from 31Staphylococcusaureusisolates from raw milk of cows.Staphylococcusaureusisolates with toxin genes accounted for 93.5%of all theStaphylococcusaureusisolates,the isolates with more than one toxin genes accounted for 67.7%,the isolates with SEA gene accounted for 48.4%,the isolates with other traditional toxin genes accounted for 40.4%,and the isolates with newly found toxin genes accounted for 67.7%.Therefore,31Staphylococcusaureusisolates were resistant to antimicrobials to varying degrees,and multiple-antibiotic-resistant was serious.Staphylococcusaureusisolates with toxin genes accounted for high ratio,and with newly found toxin genes also accounted for high ratio.
Staphylococcusaureus;drug susceptibility;toxin gene
S852.611
A
1007-5038(2012)06-0087-04
2012-02-13
史 红(1987-),女,山东临沂人,硕士,主要从事动物流行病学与动物产品卫生安全研究。*通讯作者

