SD大鼠2型糖尿病模型的建立及相关指标的测定
陈 嘉,张永斌,桑传兰,陈 苑,高 欣,董浩然,曹崇波
(广州中医药大学实验动物中心,广东广州 510405)
SD大鼠2型糖尿病模型的建立及相关指标的测定
陈 嘉,张永斌,桑传兰,陈 苑,高 欣,董浩然,曹崇波
(广州中医药大学实验动物中心,广东广州 510405)
通过链脲佐菌素(STZ)结合高糖高脂饮食诱导建立2型糖尿病大鼠模型。30只健康雄性SD大鼠随机分为模型组(20只)、空白组(10只)。模型组喂饲高糖高脂饲料4周后,用STZ 30mg/kg一次性左下腹腔注射。检测试验第1周、第4周,注射STZ后第1周、第4周、第8周、第12周空腹体重、血清葡萄糖(BG)、甘油三酯(TG)、胆固醇(TC)、胰岛素(INS)、葡萄糖依赖性促胰岛素释放肽(GIP)、胰岛素样生长因子1(IGF-1)、胰高血糖素样多肽-1(GLP-1)等指标,进行统计分析。处死大鼠,取胰腺进行病理切片检查。动物成模率为75%。试验第4周,模型组TG、TC值明显升高,与空白组比较,P<0.01。注射STZ后第1、4、8、12周,模型组BG、TG、TC值均明显升高,与空白组比较,P<0.01;ISI均明显降低,与空白组比较,P<0.01。注射STZ后第1、4、8周,模型组的 GLP-1、IGF-1值明显降低,与空白组比较,P<0.01。注射STZ后第12周,模型组的GLP-1、GIP、IGF-1值明显降低,与空白组比较,P<0.01。试验结果表明,STZ一次性左下腹腔注射结合高糖高脂饮食可成功诱导2型糖尿病大鼠模型。GIP、IGF-1、GLP-1等细胞因子参与了2型糖尿病的病理发生。
2型糖尿病;链脲佐菌素;动物模型
糖尿病是严重危害人类健康的慢性疾病之一,目前全球糖尿病患者超过7亿,其中90%为非胰岛素依赖型糖尿病,即2型糖尿病。目前,2型糖尿病的发病机制尚未明确,缺乏长效、安全、依从性高的治疗方法。建立一种既符合人类2型糖尿病发病特点,而又简单,经济的动物模型是当前研究2型糖尿病发病机制及研发抗2型糖尿病药物及治疗方法亟待解决的问题。目前国内多采用化学药物损伤法造模,具有操作简便,成模率高的特点。链脲佐菌素(Streptozotocin,STZ)是一种较理想的化学药物,其对胰岛β细胞有特异性杀伤作用,而对其他组织损伤较小,为目前国内外制作糖尿病动物模型中较多使用的一种药物。本试验通过喂饲高糖高脂饲料加STZ对大鼠进行腹腔注射,建立一种较佳的类似人类2型糖尿病的动物模型。通过动态观察动物体重、血糖、血脂、胰岛素(insulin,INS)及调节胰岛素分泌的胃肠道激素变化,包括葡萄糖依赖性促胰岛素释放肽(glucose-dependent insulintropic polypeptide,GIP)、胰 岛 素 样 生 长 因 子 1(insulin-like growthtor-1,IGF-1)、胰高血糖素样多肽1(gluca-gon-likeptide-1,GLP-1)等,为 SD 大鼠2型糖尿病动物模型的使用提供试验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级SD大鼠,体重180g~220g,30只,雄性。购于广州中医药大学实验动物中心,许可证号:SCXK(粤)2008-0020。
1.1.2 试剂 链脲佐菌素(STZ)为晶欣生物科技公司产品(LOT:120705);胰岛素ELISA试剂盒(LOT:U28071539)、胰高血糖素样肽ELISA试剂盒(LOT:V10071540)、糖依赖性胰岛素释放肽ELISA试剂盒(LOT:U28071541)为Cusa Bio Biotech Co.,Ltd公司产品;胰岛素样生长因子1ELISA试剂盒(LOT:NO997106)为博士德生物工程有很公司产品;血糖试纸(稳豪型血糖试纸,LOT:3079894)、血糖检测试剂盒(批号:1010131)、甘油三酯检测试剂盒(批号:0710111)、总胆固醇检测试剂盒(批号:0411021)生化检测试剂均为四川迈克生物科技股份有限公司产品。
1.1.3 器材设备 电子血糖分析仪(One Touch Ultra,稳豪血糖仪),全自动生化分析仪(7060型),酶标仪为美国Thermo Labsystems公司产品。
1.1.4 饲料 普通饲料及高糖高脂饲料均购于广州市花都区花东信华实验动物养殖场。高糖高脂饲料配方:180g/L 猪油,200g/L 蔗糖,30g/L蛋黄粉,590g/L基本饲料。
1.2 方法
1.2.1 分组 将30只SPF级SD大鼠购回后,适应性喂养1周,无异常发现者,随机分成2组,正常组10只,模型组20只。
1.2.2 动物模型的建立 空白组大鼠予普通饲料,模型组大鼠予高糖高脂饲料,喂养4周。4周后将模型组大鼠禁食不禁水12h后,腹腔注射STZ(30 mg/kg)。STZ注射5d后,对注射STZ的大鼠测定尾静脉随机血糖,认为随机血糖>16.7mmol/L者为2型糖尿病造模成功。
1.2.3 指标的记录与测定 每日8:00~10:00时对大鼠进行一般状态观察。每周记录1次体重。大鼠腹腔注射0.6mol/L水合氯醛,眼眶静脉丛采血,检测实验第1周、第4周;注射注射STZ后第1周、4周、8周、12周的空腹血糖(BG)、血清甘油三酯(TG)、血清总胆固醇(TC)、INS、GLP-1、GIP、IGF-1的含量。12周麻醉后处死动物,剥离并摘取胰腺,称重后置1.33mol/L多聚甲醛溶液中浸泡固定,进行组织形态学检查。
1.2.4 统计学处理 采用SPSS11.0软件,试验数据以平均数±标准差(±SD)表示,采用独立样本t检验,P<0.05为差异显著。
2 结果
STZ注射后,有2只大鼠未成模,模型组有3只大鼠死亡。
2.1 各组大鼠的一般状态
模型组大鼠出现饮水增多、尿量增多、拉尾排便、排尿、毛松、懒动等症状。
2.2 体重情况
喂养4周后,空白组体重321.63g±26.59g,模型组体重346.63g±34.44g,与空白组比较,体重增加,但差异不显著(P>0.05)。注射STZ后,模型组相应时间点的体重比空白组轻,但差异不显著(P>0.05)(表1)。
2.3 代谢相关指标
试验第1周,2个组的BG、TG、TC、INS、胰岛素敏感指数(ISI)比较,均无统计学意义(P>0.05)。试验第4周,模型组TG、TC值明显升高,与空白组比较,P<0.01。注射STZ后第1、4、8、12周,模型组BG、TG、TC值均明显升高,与空白组比较,P<0.01;ISI均明显降低,与空白组比较,P<0.01(表2)。
表1 两组大鼠体重比较(±SD,n=8,单位 :g)Table 1 Comparison of body weights in rats of two groups(±SD,n=8,unit:g)
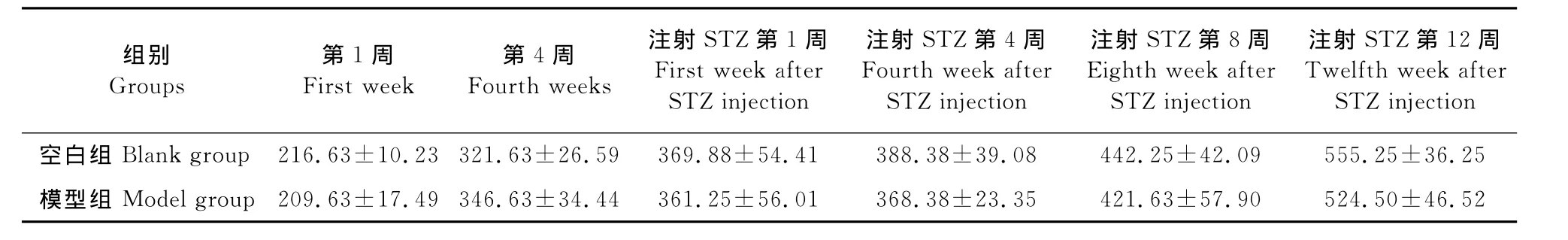
表1 两组大鼠体重比较(±SD,n=8,单位 :g)Table 1 Comparison of body weights in rats of two groups(±SD,n=8,unit:g)
ection空白组 Blank group 216.63±10.23 321.63±26.59 369.88±54.41 388组别Groups第1周First week第4周Fourth weeks注射STZ第1周First week after STZ injection注射STZ第4周Fourth week after STZ injection注射STZ第8周Eighth week after STZ injection注射STZ第12周Twelfth week after STZ inj.38±39.08 442.25±42.09 555.25±36.25模型组 Model group 209.63±17.49 346.63±34.44 361.25±56.01 368.38±23.35 421.63±57.90 524.50±46.52
表2 两组大鼠血糖、血脂及胰岛素比较(±SD,n=8)Table 2 Comparison of BG,TC,TG,INS in rats of two groups(±SD,n=8)
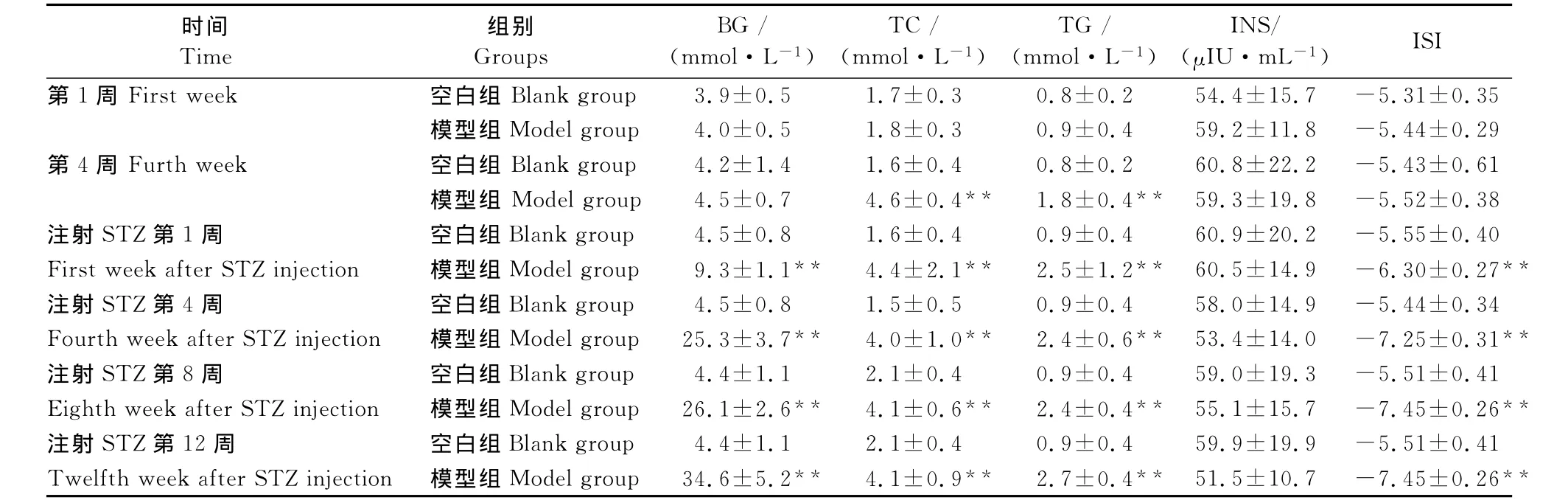
表2 两组大鼠血糖、血脂及胰岛素比较(±SD,n=8)Table 2 Comparison of BG,TC,TG,INS in rats of two groups(±SD,n=8)
注:胰岛素敏感指数(ISI)=ln[1/(FBG×INS)];与空白组比较,“**”P<0.01。Note:Insulin sensitivity index(ISI)=ln[1/(FBG×INS)];Compared with blank group,“**”P<0.01.
ISI时间Time组别Groups BG/(mmol·L-1)TC/(mmol·L-1)TG/(mmol·L-1)INS/(μIU·mL-1)第1周 First week 空白组 Blank group 3.9±0.5 1.7±0.3 0.8±0.2 54.4±15.7 -5.31±0.35模型组 Model group 4.0±0.5 1.8±0.3 0.9±0.4 59.2±11.8 -5.44±0.29第4周 Furth week 空白组 Blank group 4.2±1.4 1.6±0.4 0.8±0.2 60.8±22.2 -5.43±0.61模型组 Model group 4.5±0.7 4.6±0.4** 1.8±0.4** 59.3±19.8 -5.52±0.38注射STZ第1周 空白组Blank group 4.5±0.8 1.6±0.4 0.9±0.4 60.9±20.2 -5.55±0.40 First week after STZ injection 模型组 Model group 9.3±1.1** 4.4±2.1** 2.5±1.2** 60.5±14.9 -6.30±0.27**注射STZ第4周 空白组Blank group 4.5±0.8 1.5±0.5 0.9±0.4 58.0±14.9 -5.44±0.34 Fourth week after STZ injection 模型组 Model group 25.3±3.7** 4.0±1.0** 2.4±0.6** 53.4±14.0 -7.25±0.31**注射STZ第8周 空白组Blank group 4.4±1.1 2.1±0.4 0.9±0.4 59.0±19.3 -5.51±0.41 Eighth week after STZ injection 模型组 Model group 26.1±2.6** 4.1±0.6** 2.4±0.4** 55.1±15.7 -7.45±0.26**注射STZ第12周 空白组Blank group 4.4±1.1 2.1±0.4 0.9±0.4 59.9±19.9 -5.51±0.41 Twelfth week after STZ injection 模型组 Model group 34.6±5.2** 4.1±0.9** 2.7±0.4** 51.5±10.7 -7.45±0.26**
2.4 胃肠道分泌激素的变化
试验第1、第4周,2个组的 GIP、GLP-1、IGF-1值比较,差异不显著(P>0.05)。注射STZ后第1、4、8周,模型组的 GLP-1、IGF-1值明显降低,与空白组比较差异显著,P<0.01。注射STZ后第12周,模型组的 GLP-1、GIP、IGF-1值明显降低,与空白组比较差异显著,P<0.01(表3)。
表3 两组大鼠胃肠道分泌激素比较(±SD,n=8)Table 3 Comparison of gastrointestinal hormones in rats of two groups(±SD,n=8)
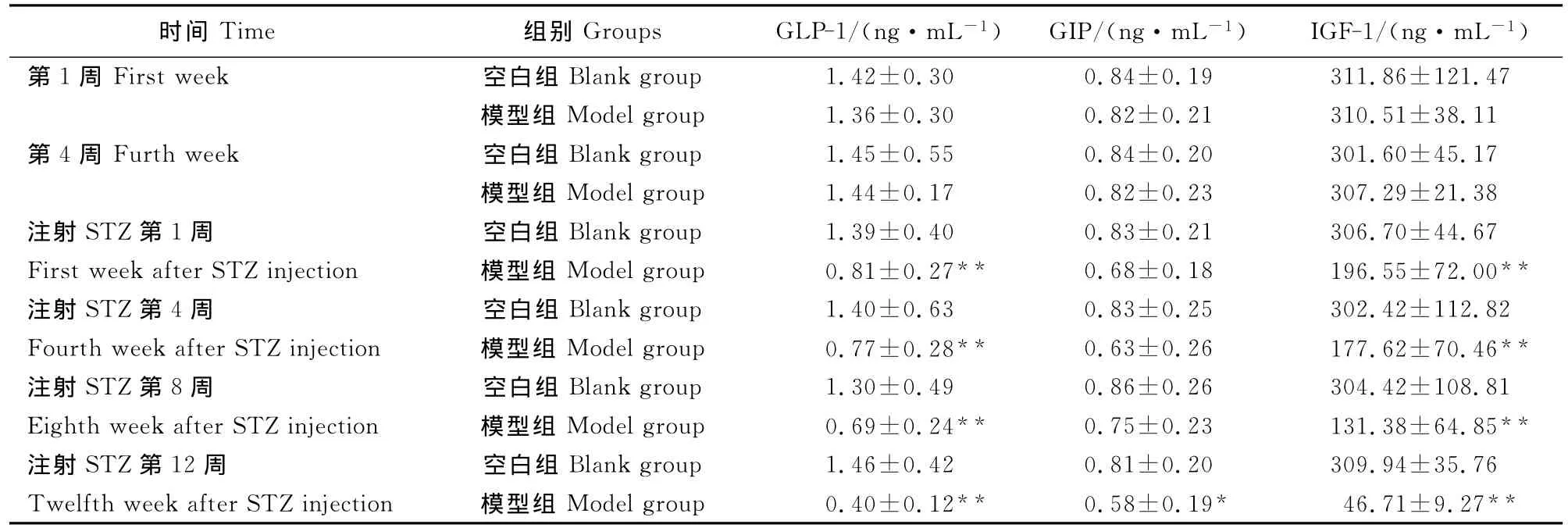
表3 两组大鼠胃肠道分泌激素比较(±SD,n=8)Table 3 Comparison of gastrointestinal hormones in rats of two groups(±SD,n=8)
注:与空白组比较,“**”P<0.01。Note:Compared with blank group,“**”P<0.01.
时间 Time 组别 Groups GLP-1/(ng·mL-1) GIP/(ng·mL-1) IGF-1/(ng·mL-1)1.42±0.30 0.84±0.19 311.86±121.47模型组 Model group 1.36±0.30 0.82±0.21 310.51±38.11第4周 Furth week 空白组 Blank group 1.45±0.55 0.84±0.20 301.60±45.17模型组 Model group 1.44±0.17 0.82±0.23 307.29±21.38注射STZ第1周 空白组 Blank group 1.39±0.40 0.83±0.21 306.70±44.67 First week after STZ injection 模型组 Model group 0.81±0.27** 0.68±0.18 196.55±72.00**注射STZ第4周 空白组 Blank group 1.40±0.63 0.83±0.25 302.42±112.82 Fourth week after STZ injection 模型组 Model group 0.77±0.28** 0.63±0.26 177.62±70.46**注射STZ第8周 空白组 Blank group 1.30±0.49 0.86±0.26 304.42±108.81 Eighth week after STZ injection 模型组 Model group 0.69±0.24** 0.75±0.23 131.38±64.85**注射STZ第12周 空白组 Blank group 1.46±0.42 0.81±0.20 309.94±35.76 Twelfth week after STZ injection 模型组 Model group 0.40±0.12** 0.58±0.19* 46.71±9.27第1周First week 空白组Blank group**
2.5 胰腺病理组织学变化
模型组大鼠的胰腺在病理上与空白组大鼠比较出现了下列改变:胰岛体积缩小,细胞数目减少,间隙增大,出现明显空泡变性(图1)。
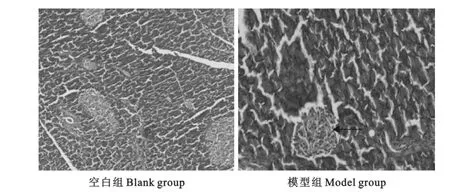
图1 大鼠胰腺切片(HE×400)Fig.1 The sections of pancreas in rats(HE×400)
3 讨论
建立2型糖尿病动物模型可以通过高糖高脂饮食诱导大鼠胰岛素抵抗后,再注射低剂量STZ损伤胰岛功能,引起血糖升高,模拟2型糖尿病的发病过程[1-3]。既往研究报道中,高糖高脂饲料喂养时间为4周~10周不等,STZ注射剂量为25mg/kg~90 mg/kg[4-7],高糖高脂饲料喂养时间过长,导致试验周期过长;STZ剂量偏大,实验动物胰岛β细胞破坏过多,则更倾向于1型糖尿病的表型特点[8],影响研究结果,而且死亡率增加。本研究予高糖高脂饲料喂养4周后,一次性腹腔注射STZ(30mg/kg),5d后,对注射STZ的大鼠测定尾静脉随机血糖,认为随机血糖>16.7mmol/L者为2型糖尿病造模成功,成模率为75%,与文献报道的接近[9-12]。以高糖高脂饲料喂饲4周后,模型组TG、TC值开始明显升高,直至实验第16周(注射STZ后12周),模型组TG、TC值仍明显高于空白组。注射STZ后1周~12周,模型组ISI均明显降低,符合2型糖尿病的特点。病理检查结果显示,模型组大鼠的胰腺胰岛体积缩小,细胞数目减少,间隙增大,出现明显空泡变性,可能是由于STZ直接破坏胰岛β细胞造成的病理变化。
糖尿病的发生是由各种致病因子作用于机体导致胰岛功能减退、胰岛素抵抗等而引发的一系列代谢紊乱综合征。现已知胃肠道的黏膜上分布有大量的内分泌细胞,胃肠内分泌细胞和胰腺内分泌细胞同APUD系,其分泌的激素可直接影响到胰岛的功能,即“肠-胰岛轴(enteroinsular axis)”。所谓肠-胰岛素轴是指肠道在食物特别是碳水化合物的刺激下通过释放内分泌递质来促使胰岛素释放,而且葡萄糖经肠道摄入可以引起比经静脉注射更高的β细胞分泌胰岛素反应,这种胃肠激素与胰岛素分泌之间的关系称为“肠-胰岛轴”。调节胰岛素分泌的胃肠道激素包括GIP、IGF,可促使机体产生胰岛素抵抗现象;以及酪酪肽(peotide YY,PYY)、GLP-1等,使血糖降低、胰岛凋亡的速率减低、显著促使胰岛增殖[13-14]。本研究通过 ELISA 方法检测了实验第1周、第4周、注射STZ后第1周、第4周、第8周、第12周血清 GIP、IGF-1、GLP-1含量的变化,初步探讨这些胃肠激素与糖尿病形成的关系。
葡萄糖依赖性促胰岛素释放肽(GIP)是由分布于小肠上段的K细胞在摄入营养后反应性分泌的一种重要的分泌素。GIP在动物和人体均能发挥葡萄糖依赖的促胰岛素分泌作用,尤其对早期相胰岛素分泌更为重要。另外,GIP还能促进胰岛β细胞的增殖和存活。本试验观察到试验的早期,模型组大鼠血清的GIP含量与空白大鼠比较,无明显差异,但随着时间的推移,模型组大鼠血清的GIP含量有逐渐下降的趋势,但与空白组比较仍无明显差异。直至注射STZ后第12周,模型组大鼠血清的GIP含量明显低于空白组,两者比较,差异有统计学意义。提示GIP在2型糖尿病发病机制中起了一定的作用。
胰岛素样生长因子1(IGF-1)具有促进生长发育、促进物质代谢以及免疫调节等作用。研究表明,2型糖尿病患者IGF-1水平下降,IGF-1与胰岛素抵抗指数呈负相关。本研究发现,注射STZ后第1周,模型组大鼠血清IGF-1明显下降,而且随着时间的推移,有逐渐下降的趋势,与胰岛素敏感性指数呈正相关,与文献报道相符[15]。
胰高血糖素样多肽1(GLP-1)是一种生理性肽类肠道激素,主要由回肠末端、结肠和直肠中的神经内分泌细胞L细胞分泌。GLP-1与胰岛β细胞上特异性的受体结合后,具有刺激胰岛素分泌,提高β细胞对葡萄糖的敏感性,刺激β细胞中胰岛素基因的转录和翻译等作用。本研究发现,注射STZ后第1周,模型组大鼠血清GLP-1明显下降,而且随着时间的推移,有逐渐下降的趋势,提示GLP-1在2型糖尿病发病机制中也起了一定的作用。
[1]Negis Y,Aytan N,Ozer N,et al.The effect of tocopherylphosphates on atherosclerosis progression in rabbits fed with a highcholesterol diet[J].Arch Physiol Biochem,2006(450):63-66.
[2]杨架林,李 果,刘优萍,等.长期高脂饮食加小剂量链脲佐菌素建立人类普通2型糖尿病大鼠模型的研究[J].中国实验动物学报,2003,11(3):138-1411.
[3]郭啸华,刘志红,李 恒,等.高糖高脂饮食诱导的2型糖尿病大鼠模型及其肾病特点[J].中国糖尿病杂志,2002,10(5):290-2941.
[4]周 敏,柴可夫.实验性2型糖尿病动物模型研究及其进展[J].浙江中医学院学报,2001,25(5):79-81.
[5]李 静,刘德义,程昌勇,等.滋阴益气活血组方对STZ糖尿病模型大鼠糖代谢的影响[J].动物医学进展,2010,31(11):47-50.
[6]李 静,刘德义.丹参对链脲佐菌糖尿病模型大鼠抗氧化功能的影响[J].动物医学进展,2010,31(4):30-33.
[7]郑素玲,陈 超,武 炜,等.链脲佐菌素诱导小鼠Ⅱ型糖尿病模型的研究[J].动物医学进展,2010,31(7):60-63.
[8]杨作丰,董 娜,李 洋,等.牛磺酸对链脲佐菌素所致大鼠Ⅰ型糖尿病的治疗作用[J].动物医学进展,2012,33(1):66-70.
[9]何清华,周迎生,王 征,等.2型糖尿病大鼠模型制备的影响因素及其特点[J].中国实验动物学报,2007,15(6):425-430.
[10]汤 球.2型糖尿病大鼠模型的制备与评价[J].四川医学,2011,32(4):463-465.
[11]蒋朝晖,吕玉晶,赵 芳,等.高脂高糖饮食结合链脲佐菌素建立2型糖尿病大鼠模型的改良[J].中国比较医学杂志,2011,21(1):33-35.
[12]汪 峰,杨国珍,刘 宓,等.链脲佐菌素诱导的糖尿病大鼠模型稳定性观察[J].贵阳医学院学报,2012,37(1):40-42.
[13]Buteau J,El-Assaad W,Rhodes C J,et al.Glucagon-like peptide-1prevents beta cell glucolipotoxicity[J].Diabetes,2008,57:1205-1215.
[14]毕恒太,张 玮.十二指肠空肠旁路术治疗2型糖尿病大鼠的实验研究[J].中国药物与临床,2012年,12(2):182-184.
[15]李 晗,高宏凯,张新国.胰岛素样生长因子1与2型糖尿病胰岛素抵抗的关系研究进展[J].医学综述,2010,16(6):906-908.
Establishment of SD Rat Model of Type 2 Diabetes Mellitus and Detection of Related Indexes
CHEN Jia,ZHANG Yong-bin,SANG Chuan-lan,CHEN Yuan,GAO Xin,DONG Hao-ran,CAO Chong-bo
(GuangzhouUniversityofChineseMedicine,LaboratoryAnimalCenter,Guangzhou,Guangdong,510405,China)
In order to establish a rat model of type 2diabetes mellitus(T2DM)induced by streptozotocin(STZ)in combination with high-sugar and high-fat diets,30healthy male SD rats were randomly divided into the T2DM model group(20rats)and the blank group(10rats).STZ(30mg/kg)was injected into rats in the T2DM model group.Rats in the T2DM model group were fed with high-sugar and high-fat diets for 4weeks.The fasting blood glucose(BG),blood triglyceride(TG),blood cholesterol(TC),body weight,fasting insulin(INS),glucose dependent insulinotropic releasing peptide(GIP),insulin-like growth factor-1(IGF-1),glucagon like peptide-1(GLP-1)were detected in first week,fourth week and after first week,fourth week,eighth week,twelfth week after STZ injection.The sections of pancreas were detected by histopathological examination.The success rate was 75%.Values of TG,TC in T2DM model group increased significantly than those in blank group(P<0.01)after 4 weeks.Values of BG,TG,TC in T2DM model group increased significantly than those in blank group(P<0.01)1,4,8,12weeks after injection of STZ;ISI decreased significantly than those in blank group,P<0.01;values of GLP-1,IGF-1in T2DM model group decreased significantly than those in blank group(P<0.01)1,4,8weeks after injection of STZ;values of GLP-1,IGF-1,GIP in T2DM model group decreased significantly than those in blank group(P<0.01)12weeks after injection of STZ.The method of inducing T2DM by high-sugar and high-fat diet with STZ injection was effective.GIP,IGF-1,GLP-1involved in the pathogenesis of type 2diabetes mellitus.
type 2diabetes mellitus;streptozotocin;animal model
S852.3
A
1007-5038(2012)06-0091-05
2012-03-22
广东省科技计划项目(粤科规划字[2010]138号;2010B060500013);广东省科技计划项目(粤科规划字[2011]71;2011B060300007)
陈 嘉(1975-),女,广西北海人,副研究员,主要从事实验动物学研究。*通讯作者

