MicroRNA-338-3p在结直肠癌中的表达及其临床意义
苏桂源 邓海军 孙凯 余江 李国新
南方医科大学南方医院普通外科,广东 广州 510515
结直肠癌(colorectal carcinoma,CRC)是消化道常见恶性肿瘤,近年来发病率和死亡率明显上升,随着分子生物学技术的发展,已经明确结直肠癌的发生、发展是一个多步骤、多基因参与的过程,而抑癌基因的失活在癌的发生中具有重要作用,研究新的抑癌基因对结直肠癌的诊断治疗及预后有重要意义。研究表明,微小RNA(microRNA,miRNA)对生物体生长发育和分化调控起着重要作用,其表达失衡可促进多种肿瘤的发生、发展[1-2]。miRNA-338-3p(miR-338-3p)是新发现的miRNA,可通过调控肿瘤细胞侵袭、转移等恶性生物学行为参与肿瘤的演进过程,但其在结直肠癌中的表达状况及其调控靶目标鲜见研究报道[3]。本实验旨在观察结直肠癌与毗邻癌旁组织中miR-338-3p差异表达状况,并分析其表达水平与临床病理特征之间的关系及对预后判断的价值,探讨miR-338-3p在结直肠癌发生、发展中的作用。
1 资料和方法
1.1 一般资料
40例结直肠癌及对照癌旁组织标本取自南方医院2008年9—11月间手术患者,均经术后病理学检查证实。其中男性21例,女性19例;年龄(55.8±11.2)岁;结肠癌24例,直肠癌16例。完善相关病理资料,包括肿瘤细胞分化程度、浸润层次、TNM分期(NCCN 2009版)、CEA水平等。癌旁组织取自距离癌肿5 cm的肠黏膜,另切取距离癌肿10 cm以上肠黏膜作为正常对照。患者术前均未接受放化疗。标本采集后快速放至液氮中冷冻,-80 ℃保存。
1.2 随访资料
随访时间自术后第1天至末次随访或死亡时间,以月为计算单位,随访至2011年11月截止,随访时间最长36个月,最短4个月,死亡11例,随访方式为门诊复查、信件及电话随访。
1.3 试剂与仪器
TRIzol试剂购自Invitrogen公司,Allin-One™ miRNA qRT-PCR检测试剂盒购自GeneCopoeia公司,DU800核酸蛋白分析仪购自美国Beckman Coulter公司,PCR仪采用ABI Prism®7500。
1.4 引物设计与合成
由miRBase数据库(http://microrna.sanger.ac.uk/)和GenBank查找基因序列,使用Primer-Express 2.0软件进行引物设计,miR-338-3p及内参照RNU6B由GeneCopoeia公司设计合成。
1.5 Real-time RT-PCR检测标本中miR-338-3p表达
常规TRIzol试剂抽提总RNA,DEPC水溶解沉淀,应用DU800核酸蛋白分析仪测定RNA浓度,根据RNA在A260nm/A280nm≥1.8及甲醛变性凝胶电泳28 S、18 S的RNA条带亮度比值≥1.5鉴定RNA纯度及完整性。miRNA逆转录反应:往冰上预冷的RNase free反应管内加入以下试剂至总体积25 μL:终浓度为2.0 μg的总RNA 2.0 μL、2.5 U/μL PolyA聚合酶 1.0 μL、逆转录酶RTase Mix 1.0 μL、5×Reaction Buffer 5.0 μL、去RNase无菌蒸馏水16 μL;混匀配制的反应液,短暂离心后在37 ℃反应60 min,结束后再进行85 ℃ 5 min灭活处理,所得逆转录产物用灭菌水稀释5倍进行下游qPCR实验。构建miR-338-3p和RNU6B的Real-time Q-PCR反应体系:cDNA 2.0 μL、2×All-in-ONE Q-PCR Mix 10 μL、通用PCR引物2.0 μL、50×Rox Reference Dye 0.4 μL、无菌蒸馏水3.6 μL、miR-338-3p或RNU6B引物2.0 μL;qPCR反应采用标准的三步法进行:95 ℃预热10 min;95 ℃变性10 s、60 ℃退火20 s、72 ℃延伸34 s,共40个循环;循环结束后立即进行熔解曲线分析66 ℃~95 ℃、升温速率为每次0.5 ℃、恒温时间每次6 s,每个标本均作复管PCR反应,并重复3次。
1.6 PCR产物的定量校正和判定标准
以RNU6B作为内参照,用RNU6B的拷贝数作为校正基数,通过Light Cycler软件直接获得各样本中miR-338-3p的Ct(cycle threshold)值,与同样本中RNU6B的Ct值相减,即获得该样本中miR-338-3p的ΔCt值;由于以Real-time Q-PCR来检测RNA时,受到不同RNA样本存在不同的逆转录效率的限制,我们再以正常肠黏膜的ΔCt值作为校正,得出-ΔΔCT值,ΔΔCT=(CTmiR-338-3p-CTU6)目的样本-(CTmiR-338-3p-CTU6)校正样本,按目的基因表达量=2-ΔΔCT公式计算各样本中miR-338-p的确切含量。
1.7 统计学处理
应用SPSS 13.0软件进行统计分析,实验所得数据以表示,组间比较采用配对设计两两比较t检验;肿瘤临床病理参数与miR-338-3p表达水平之间的关系分析采用Mann-Whitney检验和Kruskal-Wallis检验;用Kaplan-Meier法分析生存期并绘制生存曲线,生存曲线的比较用log-rank检验进行分析。P<0.05为差异有统计学意义。
2 结 果
2.1 PCR反应效果及特异性
40例样本中miR-338-3p cDNA显示呈指数增长,并扩增达到平台期,Ct值处于15~35之间,其扩增曲线为一组典型的S型曲线(图1),扩增效率理想。通过设置复孔取平均值,即得到各样本中目的基因扩增的Ct值作为miR-338-3p定量判定。PCR完成后于溶解程序中收集荧光信号,得到熔解曲线,miR-338-3p对应的Tm值为(77.43±0.14) ℃,熔解温度均一,峰形单一锐利,证明反应特异性良好,无非特异扩增、引物二聚体及发夹结构的出现(图2)。
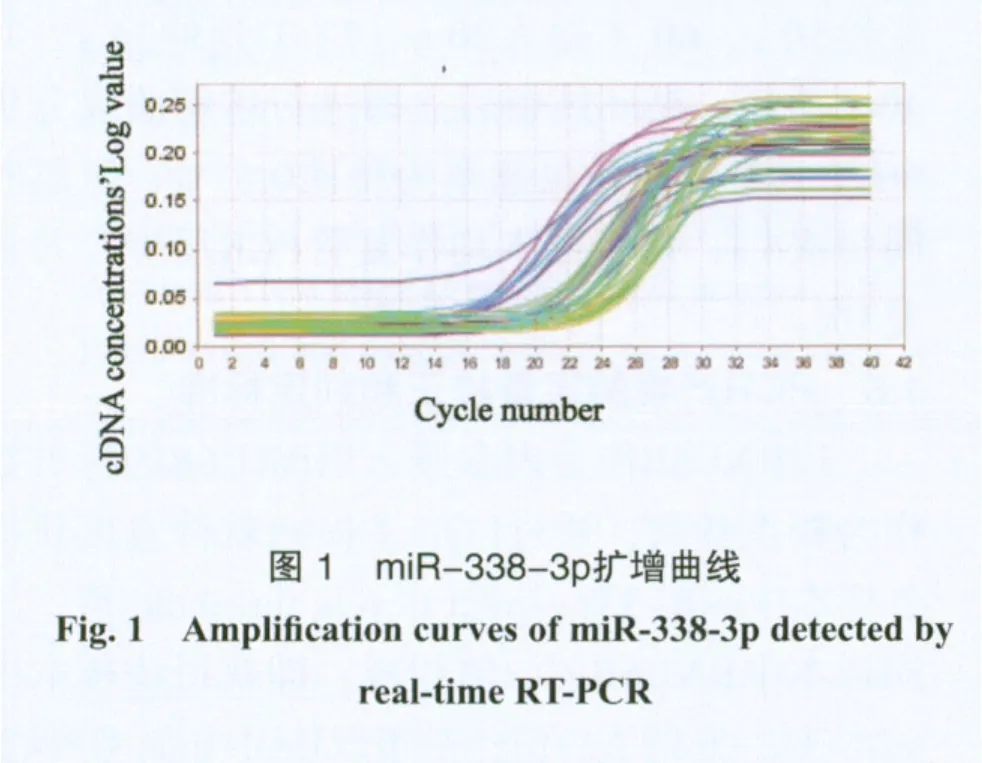
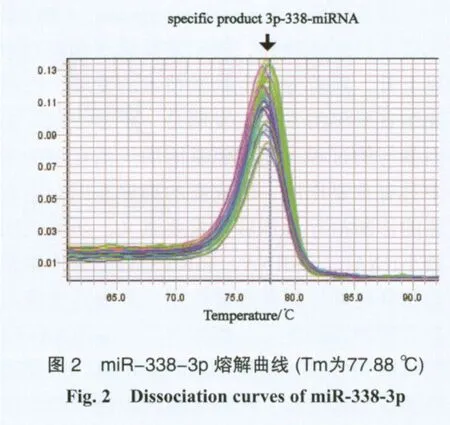
2.2 miR-338-3p含量测定
与癌旁组织相比,miR-338-3p在结直肠癌组织中表达明显下调(0.122 6±0.087 3vs0.905 8±0.410 5),差异有统计学意义(P<0.01)。
2.3 miR-338-3p表达水平与结直肠癌临床病理特征的关系
miR-338-3p表达水平与肿瘤TNM分期(P=0.031)、浸润深度(P=0.001)以及分化程度(P=0.042)有关,而与性别、年龄、肿瘤部位、CEA水平无关(表1)。
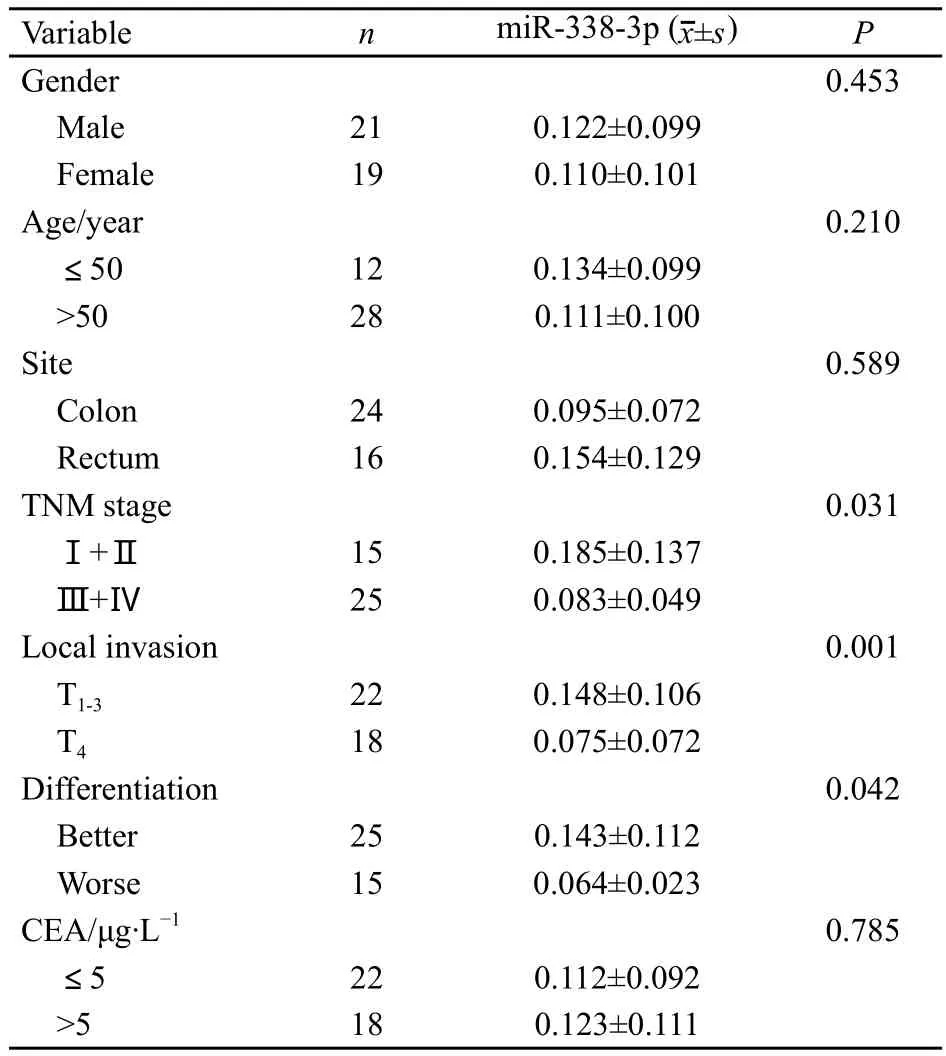
表 1 miR-338-3p表达水平与结直肠癌临床病理特征的关系Tab.1 Relationship between miR-338-3p expression and clinicopathological features in colorectal cancer patients
2.4 miR-338-3p表达水平与预后的关系
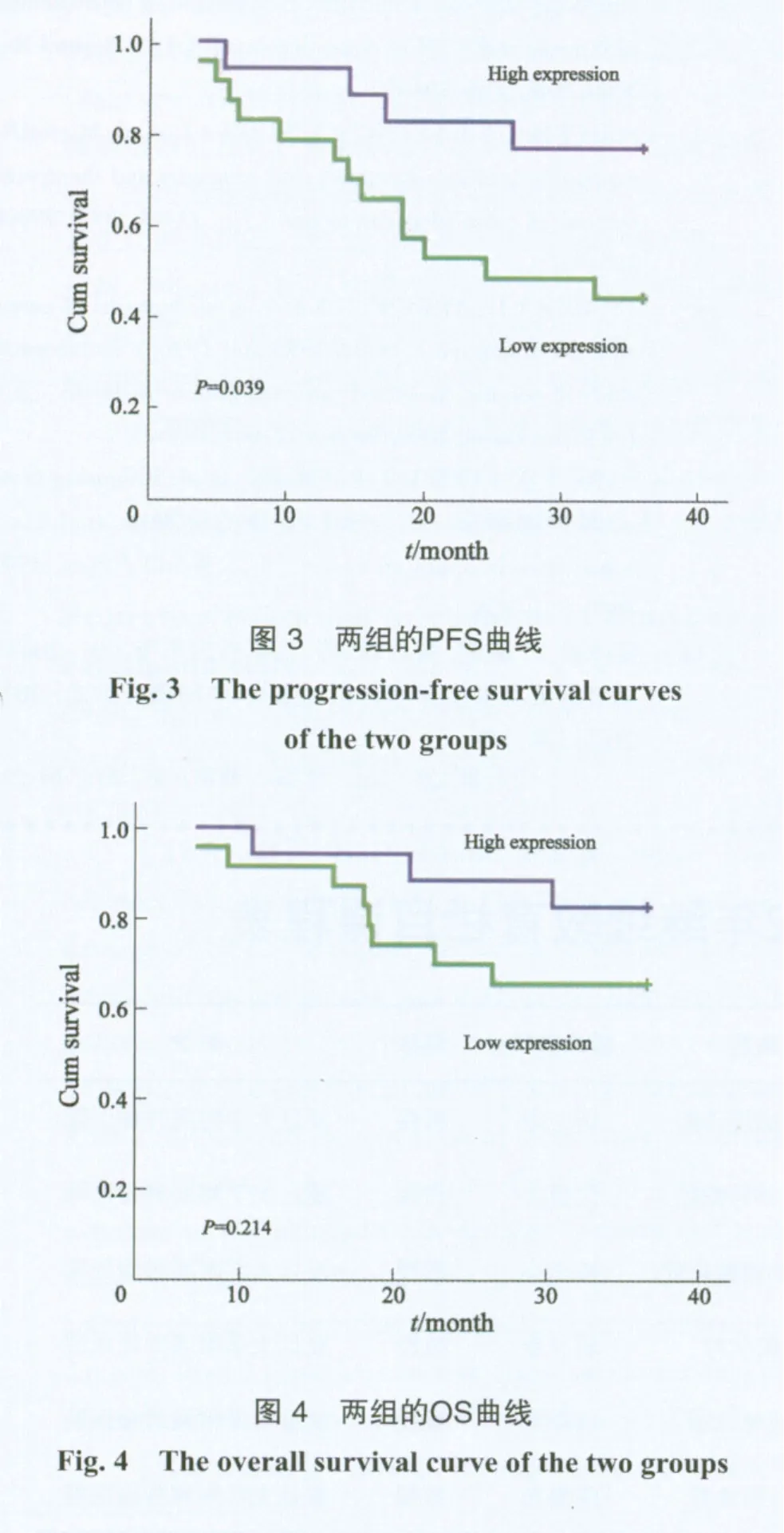
以结直肠癌患者的术后3年无进展生存期(progression-free survival,PFS)及总生存期(overall survival,OS)分别绘制生存曲线,取样本中miR-338-3p表达水平的平均值0.122 6阈值,将40例样本分为高表达组与低表达组,结果miR-338-3p低表达组与高表达组的PFS差异有统计学意义(P=0.039),低表达组的手术预后效果显著低于高表达组(图3);而miR-338-3p低表达组与高表达组的OS差异无统计学意义(P=0.214,图4)。
3 讨 论
结直肠癌的发生是多因素、多步骤的发展过程,同样也是多基因发生异常变化的过程,随着研究的发展,越来越多的分子生物学标志表达变化被确认与结直肠癌的发生有关,并具有相应的临床价值[4]。miRNA是存在于生物体内的一类长度约为19~22个核苷酸的非编码小分子RNA,参与基因转录后水平的调控,既往研究证实miRNA对生命体的生长发育、增殖分化等基本生物学行为起着关键的调控作用,而其失衡表达亦可促进多种人类疾病尤其是肿瘤的发生、发展,miRNA与肿瘤调控关系逐渐成为研究热点[5-6]。
miR-338-3p是新发现的一种miRNA,其在多种恶性肿瘤中表达下调。国内学者曾应用液相芯片筛选肝细胞癌与毗邻癌旁组织中差异表达miRNA,发现miR-338-3p在肝细胞癌中表达显著下调;进一步应用Hierarchical Cluster软件以miR-338-3p为标准配对标本进行聚类分析时,可将肝细胞癌与毗邻癌旁组织明显分开[7]。本研究结果亦证实,miR-338-3p在结直肠癌中表达水平较癌旁组织显著下降,提示miR-338-3p下调可能作为“抑癌基因”的表达缺失而参与了肿瘤始发及演进,但其具体发挥何种抑癌生物学作用尚不清楚。miR-338-3p定位于染色体17q25.3,而染色体17q23-25位点常是多种恶性肿瘤的突变“热点”,且其突变后的遗传表型常与肿瘤的血管侵袭和远处转移等恶性生物学行为密切相关,此现象亦提示了miR-338-3p可能参与了肿瘤侵袭转移的恶性进程,亦与我们前期预实验中所发现的miR-338-3p在转移性结直肠癌中表达水平更行下降的状况相一致,说明miR-338-3p可能是一种与结直肠癌侵袭转移密切相关的“抑癌基因”。
结直肠癌的临床病理特征是判断肿瘤恶性程度及预后的主要依据[8],本研究结果表明,TNM分期Ⅲ+Ⅳ期的结直肠癌组织中miR-338-3p表达水平显著低于Ⅰ+Ⅱ期结直肠癌组织;癌组织的局部浸润达到T4期的miR-338-3p表达水平显著低于T1~T3期;分化程度低的结直肠癌组织miR-338-3p表达水平显著低于高、中分化的结直肠癌组织。因此miR-338-3p的低表达不仅与结直肠癌的发生有关,并且与肿瘤的侵袭、浸润及分化程度相关。
既往研究发现,结直肠癌患者术后30%~50%会出现复发或者转移,且复发者80%~90%发生在术后2~3年内[9-11]。本研究的3年随访资料显示,在PFS的比较中miR-338-3p低表达组的生存时间显著低于高表达组,虽然OS两组之间差异无统计学意义,但低表达组的生存率(65.2%)低于高表达组(82.4%),提示miR-338-3p表达水平越低,其术后复发转移的可能性越大,临床预后越差。
综上所述,miR-338-3p与结直肠癌的发生发展有关,可能也是结直肠癌的一个抑制侵袭转移因子,其低表达水平与肿瘤的TNM分期、浸润深度以及分化程度密切相关,并可作为结直肠癌预后判断的新的生物标志物。
[1]BANDRES E, AGIRRE X, BITARTE N, et al.Epigenetic regulation of microRNA expression in colorectal cancer [J].Int J Cancer, 2009, 125(11): 2737-2743.
[2]SUN K, WANG W, ZENG J J, et al.MicroRNA-221 inhibits CDKN1C/p57 expression in human colorectal carcinoma[J].Acta Pharmacol Sin, 2011, 32(3): 375-384.
[3]TSUCHIYA S, OKU M, IMANAKAI Y, et al.MicroRNA-338-3p and microRNA-451 contribute to the formation of basolateral polarity in epithelial cells [J].Nucleic Acids Res, 2009, 37(11): 3821-3827.
[4]HE L, HE X, LIM L P, et al.A microRNA component of the p53 tumor suppressor network [J].Nature, 2007,447(7148): 1130-1134.
[5]GUARNIERI D J, DILEONE R J.MicroRNAs: a new class of gene regulators [J].Ann Med, 2008, 40(3): 197-208.
[6]NG E K O, CHONG W W S, JIN H, et al.Differential expression of MicroRNA in plasma of patients with colorectal cancer: a potential marker for colorectal cancer screening[J].Gut, 2009, 58(10): 1375-1381.
[7]HUANG X H, WANG Q, CHEN J S, et al.Bead-based microarray analysis of microRNA expression in hepatocellular carcinoma: miR-338 is down-regulated [J].Hepatol Res,2009, 39(8): 786-794.
[8]SCHETTER A J, LEUNG S Y, SOHN J J, et al.MicroRNA expression profiles associated with prognosis and therapeutic outcome in colon adenocarcinoma [J].JAMA, 2008, 299(4):425-436.
[9]TSUKUMA H, AJIKI W, IOKA A, et al.Survival of cancer patients diagnosed between 1993 and 1996: a collaborative study of population-based cancer registries in Japan [J].Jpn J Clin Oncol, 2006, 36(9): 602-607.
[10]PARK Y J, PARK K J, PARK J G, et al.Prognosis factor in 2230 Korean colorectal cancer patients: analysis of consecutively operated cases [J].World J Surg, 1999,23(7): 721-726.
[11]陈永胜, 丁璐璐, 张永辉, 等.江苏省启东市2001-2007年结直肠癌患者生存率分析 [J].中国癌症杂志, 2011,21(2): 134-139.

