Aes对肝癌细胞恶性生物学行为的影响
李明星 袁丹丹 陈亮 李黎博 陈柳 李荣惠庞晓辉 夏洪伟 冷卫兵 唐秋琳 毕锋
四川大学华西医院生物治疗国家重点实验室,
信号转导及分子靶向治疗研究室,△腹部肿瘤科,四川 成都 610041
肝癌是我国最常见的恶性肿瘤之一,其复发转移是影响预后的主要因素[1],因此研究与肝癌细胞侵袭、转移的相关分子机制是该领域的一大热点。Aes(amino-terminal enhancer of split,Aes)是转录因子Groucho/TLE家族成员,能与转录因子结合调控转录,但不具有DNA结合位点[2]。近期的研究表明Aes能够通过抑制notch信号通路抑制结肠癌的转移,且Aes的表达缺失能够促进结肠癌的血行转移[3-4],提示Aes在肿瘤转移中扮演着重要角色。为进一步探讨Aes在肝癌转移中的作用,我们检测了Aes在不同肝癌细胞系中的表达情况,通过构建Aes表达载体,转染其低表达的肝癌细胞系HepG2,观察其对肝癌细胞的增殖、侵袭和迁移能力的影响。
1 材料和方法
1.1 材料
1.1.1 细胞系
人肝癌细胞系HepG2、SMMC-7721为本实验室保存。
1.1.2 试剂
细胞培养基RPMI-1640、小牛血清,转染试剂LipofectamineTM2000、Opti-MEM均购自美国Invitrogen公司,兔抗人Aes多克隆抗体购自美国Sigma公司,鼠抗人β-actin单克隆抗体购自武汉博士德公司,CCK-8试剂盒购自日本Dojindo公司,RT-PCR试剂盒购自TaKaRa,质粒pEGFP-N1为本实验室保存。
1.2 方法
1.2.1 质粒的构建和细胞转染及实验分组
通过Primer Premier 5.0设计Aes(NM_001130)的引物,上游引物HindⅢ5’-CCCAAGCTTCCGCGATTGACATGAT-3’、下游引物KpnⅠ 5’-GGGGTACCGTATCCGACTTC TCGCCAT-3’,以cDNA为模板扩增Aes片段,双酶切目的片段,将其连到pEGFP-N1的HindⅢ和KpnⅠ位点,通过酶切鉴定以及测序验证。依照说明书,通过LipofectamineTM2000分别将pEGFP-N1和pEGFP-Aes转入肝癌细胞系HepG2,实验分pEGFP-N1(对照组)和pEGFPAes(实验组)。
1.2.2 RT-PCR检查Aes mRNA的表达
设计A e s上下游引物,上游引物:5’-CACCAGGAGGATGATGGCGAG-3’,下游引物:5’-GGCGTGGAGGTGTCTGGAACTA-3’,扩增产物为560 bp。以GADPH为内参,其上游引物序列为5’-AGAAGGCTGGGGCTCATTT G-3’,下游引物序列为5’-AGGGGCCAT CCACAGTCTTC-3’。TRIzol试剂提取待测细胞的总RNA,取一定量的RNA逆转录获得cDNA后,进行半定量PCR扩增,扩增条件为95 ℃预变性3 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,共30个循环,72 ℃延伸5 min,4 ℃保存。
1.2.3 蛋白质印迹法(Western blot)检测不同细胞系中Aes的表达及外源Aes的表达
收集对数期生长的待测细胞及转染48 h之后的细胞,RIPA裂解液重悬细胞并反复吹打,超声破碎后,4 ℃,134 00×g,离心15 min。取上清液作为细胞总蛋白,BCA法测定蛋白浓度。取一定量的蛋白样品40 μg,进行12%SDSPAGE;260 mA湿转90 min至PVDF膜,5%脱脂奶粉封闭2 h,一抗4 ℃温育过夜,TBST洗涤3次,加入二抗避光温育,摇床2 h,Odyssey红外激发扫描成像系统扫描成像结果。
1.2.4 荧光显微镜观察蛋白定位
转染pEGFP-N1和pEGFP-Aes的细胞在Nikon荧光显微镜蓝光激发下,绿色荧光蛋白发绿光。
1.2.5 细胞增殖能力检测实验
将细胞以每孔1×103接种于96孔板中,LipofectamineTM2000转染,每天每组取3孔,每孔避光加10 μL CCK-8,37 ℃温箱温育2~4 h,Micro-ELISA仪读取光密度,选择490 nm波长,测定各孔吸光值(A),连续5 d,记录结果,以时间为横坐标,A490nm值为纵坐标绘制细胞生长曲线。实验重复3次。
1.2.6 划痕实验检测细胞迁移能力
以每孔2×105个细胞接种对数生长期细胞于6孔板中,第2天分别用LipofectamineTM2000转染pEGFP-N1和pEGFP-Aes,用移液枪头分别在培养板底部呈一字形划痕,每天观察并拍照,镜下记录划痕区细胞的迁移情况,软件分析划痕区的相对距离,并计算其相对迁移率:(第0天记录的相对距离-第3天记录的相对距离)/第0天记录的相对距离×100%。实验重复3次。
1.2.7 Transwell小室检测细胞侵袭能力
将BD hanging cell culture inserts置入24孔板中,将BD Matrigel Basement Membrance Matrix 按1∶3的比例用无血清培养基稀释,取35 μL铺入小室底层,37 ℃放置2 h使其凝固;收集转染48 h的细胞,用无血清培养基重悬,将1×104个细胞250 μL加入小室,下层培养板中加入700 μL含小牛血清20%的RPMI-1640培养基。培养48 h后用棉签拭去小室上层细胞,HE染色,显微镜下观察侵袭的细胞数目,分15个视野对细胞进行计数。实验重复3次。
1.3 统计学处理
实验数据通过SPSS 18.0统计学软件分析,用表示,样本间均数比较采用独立样本t检验,P<0.05为差异有统计学意义。
2 结 果
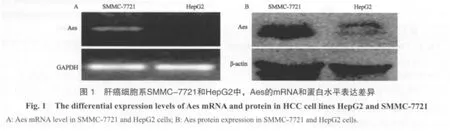
2.1 Aes在不同肝癌细胞系中的表达情况
通过RT-PCR和Western blot检测肝癌细胞系HepG2和SMMC-7721中Aes的mRNA和蛋白表达(图1),发现相对于SMMC-7721,Aes在HepG2中的表达明显降低。因此,我们在随后的试验中选择HepG2作为研究对象,观察了Aes对HepG2恶性生物学行为的影响。
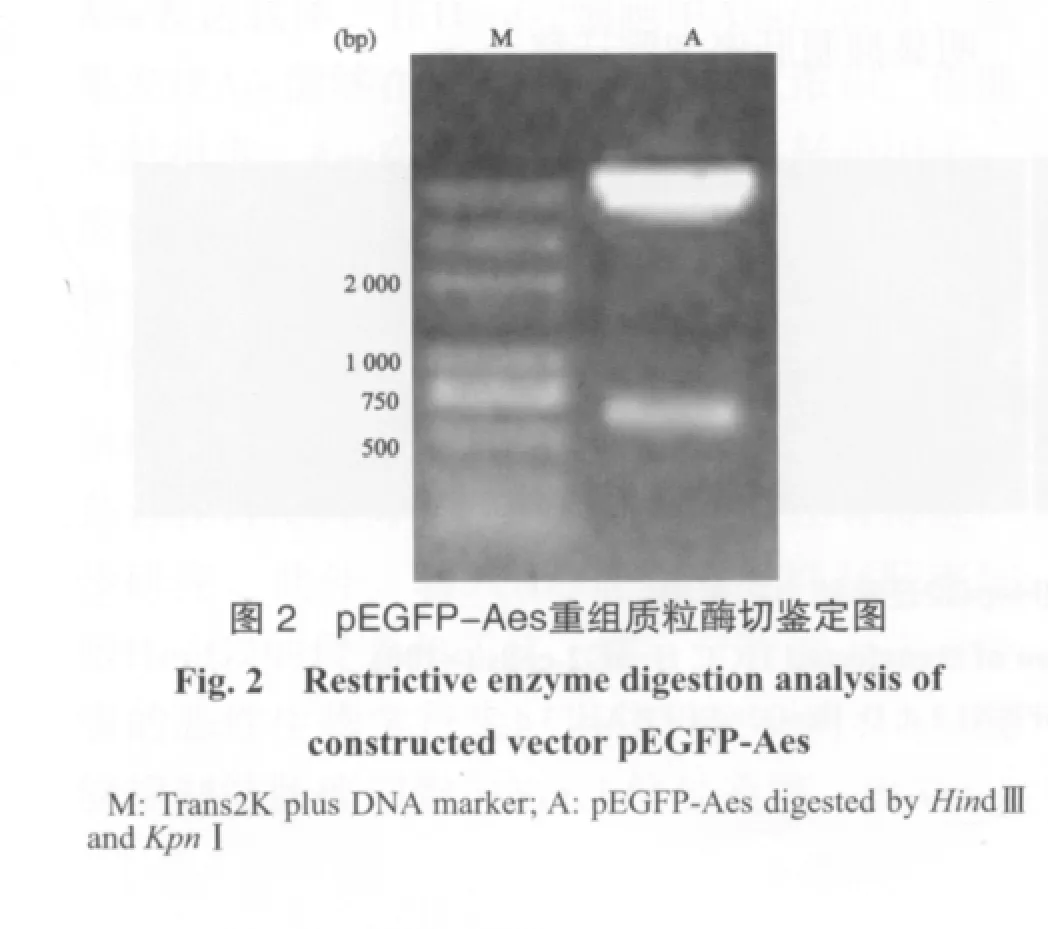
2.2 pEGFP-Aes重组蛋白表达载体构建、酶切鉴定
将构建好的pEGFP-Aes分别经HindⅢ和KpnⅠ酶切后电泳,可见593 bp(Aes编码区片段大小)的片段(图2)。
2.3 pEGFP-Aes在HepG2细胞中的表达鉴定
通过Western blot检测转入的pEGFP-Aes的表达,在荧光显微镜下观察Aes在细胞中的定位,发现Aes在细胞核和细胞质中都有表达,并且能在细胞核中形成点状浓积(图3)。
2.4 Aes对肝癌细胞HepG2生物学行为的影响
2.4.1 Aes对肝癌细胞HepG2增殖的影响
将pEGFP-N1、pEGFP-Aes分别转染HepG2细胞后,CCK-8检测细胞增殖活性,发现与pEGFP-N1组相比,pEGFP-Aes对肝癌细胞HepG2的增殖并无显著影响(图4)。
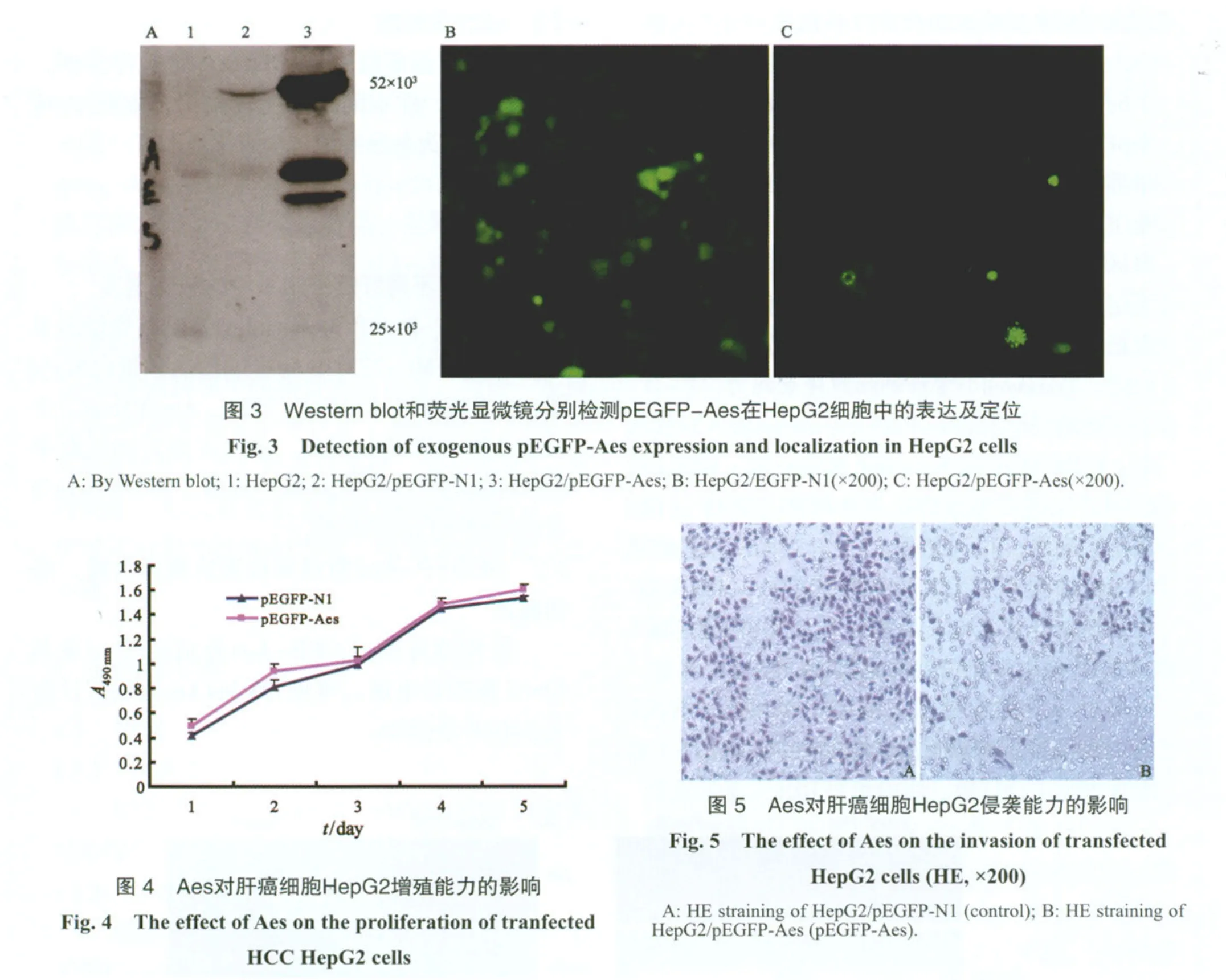
2.4.2 Aes抑制肝癌细胞HepG2的侵袭能力
同pEGFP-N1组相比,转染了pEGFP-Aes的肝癌细胞HepG2发生侵袭的细胞数目明显减少,差异有统计学意义(P<0.05,图5,表1)。
2.4.3 Aes抑制肝癌细胞HepG2的迁移能力
pEGFP-N1组划痕区明显变窄,而pEGFPAes组肿瘤细胞划痕间距离基本没有变化,迁移率明显降低(P<0.05,图6,表1),说明Aes能够明显抑制肝癌细胞迁移。


表 1 pEGFP-Aes对HepG2侵袭迁移能力的影响Tab.1 The effect of pEGFP-Aes on the invasion and migration of transfected HepG2 cells
3 讨 论
Groucho/TLE家族主要是通过与转录因子结合来调控下游基因的表达,Aes是该家族的重要成员之一,但其本身并不具有DNA结合位点,在成骨、神经及眼的发育过程中起重要作用[5-7]。早期的研究表明,Aes能够通过调节TCF/LEF-1的活性来激活Wnt信号通路,从而进一步参与调控发育[8]。
目前,关于Aes的报道较少,其在肿瘤发生、发展和转移过程中所起的作用尚不明确。有研究发现,在细胞质中,Aes能与线粒体蛋白Bit1结合诱导线粒体途径的细胞凋亡[9],近期的研究表明,Aes在结肠癌转移中扮演重要角色,Aes的表达缺失可能是导致结肠癌发生转移的重要因素,但Aes不参与调控结直肠肿瘤的生长[4]。
Aes是否在肝癌转移中也起着至关重要的作用目前尚不清楚。本研究首先检测了不同肝癌细胞系HepG2和SMMC-7721中Aes的表达水平,发现无论是mRNA水平还是蛋白水平,Aes在HepG2中都比较低,由此我们构建pEGFPAes表达载体,在HepG2细胞中Aes过表达,结果发现Aes能够在细胞核中形成点状浓积。根据文献报道,Aes在细胞核内可以募集转录因子,形成难溶的转录抑制复合物,抑制下游基因的转录[3]。我们在荧光显微镜下看到的点状浓积可能是Aes与其他转录因子相互结合抑制基因转录的复合物,但Aes结合的是哪些转录因子,是否在行使其抑制转录因子的功能还有待进一步研究。此外,转入Aes能够明显抑制肝癌细胞HepG2的侵袭和迁移,在一定程度上逆转肿瘤的恶性生物学行为。以往研究证明,Aes能够抑制结肠癌细胞中Notch信号通路,而Notch信号通路与肿瘤的侵袭和迁移有很大联系,例如Notch通路中的配体Notch1表达下调将会抑制NF-κB的活性,进而抑制VEGF和MMP-9的表达[10-11],但此种推断尚需要进一步的实验 证实。总之,研究Aes在抑制肝癌细胞的侵袭和迁移方面所起的重要作用,能够为肝癌的治疗和预后提供一个新的靶点。
[1]AKRIVIADIS E A, LLOVET J M, EFREMIDIS S C, et al.Hepatocellular carcinoma [J].Br J Surg, 1998, 85(10):1319-1331.
[2]BEAGLE B, JOHNSON G V W.AES/GRG5: More than just a dominant-negative TLE/GRG family member [J].Dev Dyn,2010, 239(11): 2795-2805.
[3]SONOSHITA M, AOKI M, FUWA H ,et al.Suppression of colon cancer metastasis by Aes through inhibition of Notch signaling [J].Cancer Cell, 2011, 19(1): 125-137.
[4]CHRISTOFORI G.Metastatic colon cancer cells negotiate the intravasation Notch [J].Cancer Cell, 2011, 19(1): 6-8.
[5]ZHU C C, DYER M A, UCHIKAWA M, et al.Six3-mediated auto repression and eye development requires its interaction with members of the Groucho-related family of co-repressors[J].Development, 2002, 129(12): 2835-2849.
[6]ZHANG X, CHEN H M, JARAMILLO E, et al.Histone deacetylase-related protein inhibits AES-mediated neuronal cell death by direct interaction [J].J Neurosci Res, 2008,86(11): 2423-2431.
[7]GHOSH-DASTIDAR S, NARAYANAN S, STIFANI S, et al.Transducin-like enhancer of split-1 (TLE1) combines with forkhead box protein G1 (FoxG1) to promote neuronal survival[J].J Biol Chem, 2012, 287(18): 14749-59.
[8]ROOSE J, MOLENAAR M, PETERSON J, et al.The xenopus Wnt effector XTcf-3 interacts with Groucho-related transcriptional repressors [J].Nature, 1998, 395(6702):608-612.
[9]JAN Y, MATTER M, PAI J T, et al.A mitochondrial protein,Bit, mediates apoptosis regulated by integrins and Groucho/TLE corepressors [J].Cell, 2004, 116(5): 751-762.
[10]WANG Z, BANERJEE S, LI Y, et al.Down-regulation of notch-1 inhibits invasion by inactivation of nuclear factorkappaB, vascular endothelial growth factor, and matrix metalloproteinase-9 in pancreatic cancer cells [J].Cancer Res, 2006, 66(5): 2778-2784.
[11]WANG Z, LI Y, BANERJEE S, et al.Down-regulation of Notch-1 and Jagged-1 inhibits prostate cancer cell growth,migration and invasion, and induces apoptosis via inactivation of Akt, mTOR, and NF-kappaB signaling pathways [J].J Cell Biochem, 2010, 109(4): 726-736.

